抗中性粒细胞胞质抗体相关性血管炎(anti-neutrophil cytoplasmic antibody-associated vasculitis,AAV)是一类可累及全身多系统的自身免疫性疾病,以寡免疫性小血管炎和致病性抗中性粒细胞胞质抗体(anti-neutrophil cytoplasmic antibody,ANCA)存在为特点,根据组织病理学特点可分为显微镜下多血管炎(microscopic polyangiitis,MPA)、肉芽肿性多血管炎(granulomatosis with polyangiitis,GPA)、嗜酸性肉芽肿性多血管炎(eosinophilic granulomatosis with polyangiitis,EGPA)和单器官AAV[1]。ANCA的靶抗原以髓过氧化物酶(myeloperoxidase,MPO)和蛋白酶3(proteimase 3,PR3)为主,还包括人白细胞弹性蛋白酶(human leukocyte elastase,HLE)、乳铁蛋白(lactoferrin,LF)、溶酶体(lysozyme,LYS)、组织蛋白酶G(cathepsin G,Cath G)和杀菌/通透性增高蛋白(bactericidal/permeability increasing protein,BPI)等。已有研究表明,根据ANCA特异性对AAV进行分类可以传达更有用的临床诊断信息[2],2012年Chapel Hill共识会议(Chapel Hill consensus conference,CHCC)提出的血管炎分类标准中依据ANCA的类型将AAV细分为3类:MPO-AAV、PR3-AAV和ANCA阴性AAV[1, 3]。IgG4相关疾病(IgG4-related disease,IgG4-RD)是近年来新发现的一组疾病,主要表现为血清IgG4水平升高、受累组织中淋巴细胞和IgG4+浆细胞浸润并伴随纤维化硬化改变。国内外均有研究报道AAV与IgG4-RD在临床上有一定比例的重叠[4-6],IgG4水平在AAV患者血液中有明显升高,可能与机体辅助性T细胞(helper T cell,Th)1/Th2细胞因子调节有关。本研究收集苏州大学附属第二医院AAV患者血清,通过定量检测血清中IgG4和IgG水平及Th1/Th2细胞因子的表达情况,分析两者之间的关系,为AAV的诊断和治疗提供实验依据。
1 资料和方法 1.1 资料和标本收集收集苏州大学附属第二医院2017年1月至2019年1月确诊的AAV患者(诊断符合2012年CHCC提出的血管炎分类标准)及年龄、性别相匹配的同期健康体检人群资料和血液样本,均排除急慢性感染和风湿免疫性疾病。AAV患者及对照组血清均保存于-80 ℃冰箱。研究程序遵循苏州大学附属第二医院医学伦理委员会制定的伦理学标准,并获得该委员会的批准。样本的采集均在获得受试者知情同意后完成。
1.2 主要试剂与仪器IgG4 ELISA检测试剂盒(批号:E201811;型号:96T)为艾莱萨生物科技(上海)有限公司产品,IgG检测试剂盒(批号:M801108;型号:300T)为西门子医疗系统有限公司(中国)产品,抗MPO、PR3抗体IgG检测试剂盒(批号:D180206AR;型号:16T)为欧蒙医学实验诊断股份公司产品,Th1/Th2细胞因子流式细胞术微球阵列(cytometric bead array,CBA)检测试剂盒(批号:7317652;型号:80T)为美国BD公司产品。酶标仪(型号:TECAN Sunrise)为瑞士帝肯公司产品,全自动蛋白分析仪(型号:SIEMENS BN ProSpec System)为德国西门子公司产品,流式细胞仪(型号:BD FACSCanton Ⅱ)为美国BD公司产品。
1.3 检测方法 1.3.1 IgG4及IgG的测定按试剂盒说明检测血清IgG4水平。在预先包被抗IgG4抗体的微孔中,依次加入标准物、临床样本、HRP标记的二抗,经过温育后洗涤,用底物TMB显色,显色后用硫酸终止,用酶标仪在450 nm波长下测定光密度(D450)值,再根据标准品拟合回归曲线并计算出样本血清中IgG4水平。血清IgG水平测定采用免疫散射比浊法,在全自动蛋白分析仪上自动完成。
1.3.2 抗MPO、PR3抗体测定按试剂盒说明测定抗MPO、PR3抗体。预先将患者血清以1∶101稀释,吸取1.5 mL稀释血清加入预先包被纯化MPO和PR3抗原的膜条温育槽内,室温条件下温育15 min,洗涤液清洗3次后加入1.5 mL酶结合物(碱性磷酸酶标记的羊抗人IgG)反应15 min,再次洗涤液清洗3次后加入1.5 mL底物,室温反应15 min,蒸馏水清洗终止反应。实验全程在摇床上进行,最后风干判断结果。根据检测结果将AAV分为MPO-AAV、PR3-AAV和ANCA阴性AAV。
1.3.3 血清Th1/Th2细胞因子测定按Th1/Th2细胞因子CBA检测试剂盒说明书配制IL-2、IL-4、IL-6、IL-10、TNF-α和干扰素γ(interferon γ,IFN-γ)6种细胞因子微球混合液,每次实验均需制备标准管和阴性对照管,在试管中加入6种微球混合液50 μL,再于每管中加入50 μL血清、50 μL藻红蛋白(P-phycoerythrin,PE)标记的荧光二抗,充分混匀室温避光反应3 h;每管加1 mL洗液,250×g离心5 min,弃上清加250 L洗液混匀3~5 s后立即上流式细胞仪检测;最后用BD CBA软件分析检测数据,得到细胞因子结果。
1.4 统计学处理采用SPSS 17.0软件分析数据。正态分布的计量资料以x±s表示,两组间比较采用独立样本t检验;非正态分布数据用中位数(下四分位数,上四分位数)表示,两组间比较采用Mann-Whitney U检验。两指标之间的相关性研究采用Pearson相关分析或Spearman相关分析。检验水准(α)为0.05。
2 结果 2.1 一般资料共收集到50例AAV患者血清样本。其中MPO-AAV患者40例(80.0%),男12例、女28例,年龄为25~86(57±18)岁;PR3-AAV患者7例(14.0%),男3例、女4例,年龄为45~86(69±15)岁;ANCA阴性AAV患者3例(6.0%),男1例、女2例,年龄为47~75(60±14)岁。收集到同期健康体检人群样本40例作为对照组,男12例、女28例,年龄为18~65(39±12)岁。由于PR3-AAV和ANCA阴性AAV病例数较少,可能不具有代表性,不做进一步检测分析。
2.2 MPO-AAV患者血清IgG4、Th1/Th2细胞因子水平分析MPO-AAV组血清IgG4水平和IgG4/IgG比值均高于对照组,差异均有统计学意义(P均<0.01);两组IgG水平差异无统计学意义(P>0.05)。MPO-AAV组Th1细胞因子(IL-2、TNF-α、IFN-γ)水平与对照组相比差异均无统计学意义(P均>0.05)。MPO-AAV组Th2细胞因子中的IL-4和IL-6水平均高于对照组,差异均有统计学意义(P均<0.001);两组IL-10水平差异无统计学意义(P>0.05)。见表 1。
|
|
表 1 MPO-AAV组和对照组血清IgG4、IgG、Th1/Th2细胞因子水平比较 |
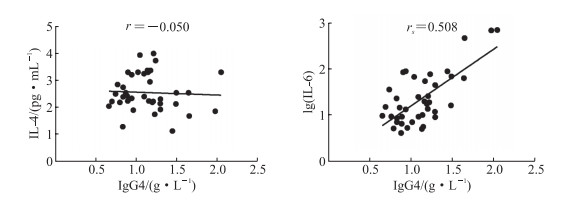
2.3 MPO-AAV患者血清IgG4水平与IL-4、IL-6水平相关性分析
Pearson相关分析表明,MPO-AAV患者血清IgG4水平与IL-4水平无关(r=-0.050,P>0.05);Spearman相关分析表明,MPO-AAV患者血清IgG4水平与IL-6水平呈正相关(rs=0.508,P<0.05)。见图 1。
|
图 1 MPO-AAV患者血清IgG4水平与IL-4、IL-6水平的相关性分析 IL-6水平计量单位为pg/mL. MPO-AAV:髓过氧化物酶-抗中性粒细胞胞质抗体相关性血管炎;IgG:免疫球蛋白G;IL:白细胞介素. |
3 讨论
本研究结果表明,我院AAV中MPO-AAV占比高达80.0%(40/50),MPO-AAV患者血清IgG4升高,Th2细胞因子中的IL-4和IL-6均升高,且IgG4升高与IL-6升高呈正相关。MPO-AAV和PR3-AAV患者通常具有不同的累及器官、血管外炎症反应模式、临床表现、临床结局及遗传相关性,研究表明GPA患者主要为PR3-ANCA阳性,在欧美多见[4];而MPA患者主要为MPO-ANCA阳性,我国人群中以MPO-ANCA阳性的MPA患者为主,临床表现以肺间质病变/肺出血和肾脏损害最为突出[7]。从本研究收集的病例来看,我院AAV患者也是以MPO-AAV为主,这种差别普遍被认为是由于ANCA亚型的地域差别造成的[8]。AAV患者血清中常能检测出高水平的ANCA,它不仅可以作为诊断AAV的重要实验室指标,同时也是致病的重要因素,补体激活特别是旁路激活途径对于AAV的发展至关重要,其中间产物C5a具有中心作用[9],激活中性粒细胞并诱导中性粒细胞对内皮细胞的损伤,导致血管发生坏死性炎症反应的自身免疫性疾病[10]。
IgG4-RD主要表现为血清IgG4水平升高,受累组织中淋巴细胞和IgG4+浆细胞浸润等[11]。目前IgG4-RD尚缺乏国际统一的诊断标准,临床上较多采用的诊断要素是:血清IgG4水平>1.35 g/L,病损组织中IgG4阳性细胞/IgG阳性细胞>40%[12]。IgG4是健康人外周血中水平最低的IgG亚类,其铰链区特殊的氨基酸基序使得不同IgG4分子间可进行半分子交换,形成具有2种不同抗原表位的独特分子[13],IgG4可以通过替代途径激活补体,另外IgG4还与慢性过敏性刺激有关,甚至在脱敏后依然可对过敏原产生免疫应答,且有抑制IgE产生的作用[14]。本研究发现MPO-AAV患者血清IgG4水平升高,可能与ANCA及Th细胞的调节有关,但值得注意的是MPO-AAV患者中有7例(17.5%)IgG4水平超过1.35 g/L这一阈值,目前虽尚无证据表明MPO-AAV也属IgG4-RD,但IgG4的升高或许可以联合MPO-ANCA作为诊断MPO-AAV的一项非特异性指标。
ANCA的生成受到一系列免疫细胞和免疫分子的调节,研究表明,中性粒细胞胞外诱捕网(neutrophil extracellular trap,NET)[15]和中性粒细胞微粒(neutrophil microparticle,NMP)[16]附着的靶抗原(HLE、MPO等)可暴露于自身免疫系统,并被抗原提呈细胞识别、提呈给T、B细胞导致自身抗体的产生[17]。T细胞主要通过分泌细胞因子发挥免疫调节作用,Th1可分泌IL-2、IFN-γ、IFN-α和TNF-β等,介导细胞毒反应和局部炎症,与细胞免疫有关;Th2可分泌IL-4、IL-5、IL-6和IL-10等,刺激B细胞增殖并产生Ig,与体液免疫有关。本研究中MPO-AAV患者血清Th1细胞因子升高不明显,而Th2细胞因子中IL-4和IL-6有明显升高,表明MPO-AAV患者的Th1/Th2平衡偏向Th2细胞因子,MPO-AAV患者体液免疫及Th2细胞因子均有激活。因此,抑制体液免疫和相关细胞因子活性将会是AAV免疫靶向治疗的有效位点。有研究发现B细胞靶向治疗药CD20抗体利妥昔单抗(rituximab)配合糖皮质激素能有效治疗AAV[18];另一种靶向药物塔西单抗(tocilizumab)是一种针对IL-6的人源化单克隆抗体,能够在重度多系统MPA患者中诱导完全和持续的疾病缓解,并使IL-6相关的促炎细胞因子和趋化因子的循环水平正常化[19],提示AAV的免疫靶向治疗可能是一种较好的辅助治疗方法。IL-4是负责驱动Th2应答的主要细胞因子[20],它最先被认为是诱导IgG4应答的主要细胞因子[21]。Kuroki等[22]发现,当有Th2细胞因子特别是IL-4存在时,特发性膜性肾病患者IgG4的表达显著升高;Akiyama等[23]进一步通过Mikulicz病患者的外周血单个核细胞体外培养发现,2型滤泡辅助性T细胞(follicular helper T2 cell,Tfh2)可能通过分泌IL-4促进B细胞高频突变,向产生IgG4方向转化,同时IL-6对IgG4的升高也有促进作用[24]。本研究中MPO-AAV患者血清Th2细胞因子IL-4和IL-6水平均较正常体检者的高,提示其可能是导致IgG4水平增高的重要原因。IgG4水平与IL-6水平呈正相关,但却与IL-4水平无明显相关性,原因可能是细胞因子在免疫系统内的调节存在相互协同和拮抗的现象,并不总是表现为完全的一致性。综合本研究结果和既往研究,均提示AAV患者免疫平衡偏向Th2细胞因子,体液免疫在调节B细胞分泌ANCA及促进IgG4升高的过程中起着十分重要的作用,检测Th2细胞因子对治疗和判断患者的免疫状态可能有重要的作用。
综上所述,我院收治的AAV患者中以MPO-AAV为主,IgG4在MPO-AAV患者血清中明显升高,这与Th2细胞因子IL-4、IL-6等的调节密不可分。IgG4虽非特异性抗体,但它的升高或许可以作为联合ANCA辅助诊断MPO-AAV的一项非特异性指标,检测Th2细胞因子有助于MPO-AAV免疫靶向治疗效果的监测。IgG4的生物学特性及其在MPO-AAV中的作用还需要进一步深入研究。
| [1] |
JENNETTE J C, FALK R J, BACON P A, BASU N, CID M C, FERRARIO F, et al. 2012 revised international Chapel Hill consensus conference nomenclature of vasculitides[J]. Arthritis Rheum, 2013, 65: 1-11. |
| [2] |
CORNEC D, CORNEC-LE GALL E, FERVENZA F C, SPECKS U. ANCA-associated vasculitis-clinical utility of using ANCA specificity to classify patients[J]. Nat Rev Rheumatol, 2016, 12: 570-579. DOI:10.1038/nrrheum.2016.123 |
| [3] |
JENNETTE J C. Overview of the 2012 revised international Chapel Hill consensus conference nomenclature of vasculitides[J]. Clin Exp Nephrol, 2013, 17: 603-606. DOI:10.1007/s10157-013-0869-6 |
| [4] |
DANLOS F X, ROSSI G M, BLOCKMANS D, EMMI G, KRONBICHLER A, DURUPT S, et al. Antineutrophil cytoplasmic antibody-associated vasculitides and IgG4-related disease: a new overlap syndrome[J]. Autoimmun Rev, 2017, 16: 1036-1043. DOI:10.1016/j.autrev.2017.07.020 |
| [5] |
DELLA-TORRE E, LANZILLOTTA M, CAMPOCHIARO C, BOZZALLA E, BOZZOLO E, BANDIERA A, et al. Antineutrophil cytoplasmic antibody positivity in IgG4-related disease: a case report and review of the literature[J/OL]. Medicine, 2016, 95: e4633. DOI: 10.1097/MD.0000000000004633.
|
| [6] |
高辉, 张萍, 李贵森, 王莉. ANCA相关性肾炎合并IgG4相关性疾病一例[J]. 中华肾脏病杂志, 2014, 30: 953-954. DOI:10.3760/cma.j.issn.1001-7097.2014.12.014 |
| [7] |
张清, 周惠琼, 李艳红, 郭娟, 徐鹏慧, 卢敏辉, 等. 抗中性粒细胞胞质抗体相关性血管炎46例临床分析[J]. 中华医学杂志, 2016, 96: 2146-2149. DOI:10.3760/cma.j.issn.0376-2491.2016.27.007 |
| [8] |
LI Z Y, MA T T, CHEN M, ZHAO M H. The prevalence and management of anti-neutrophil cytoplasmic antibody-associated vasculitis in China[J]. Kidney Dis (Basel), 2016, 1: 216-223. |
| [9] |
CHEN M, JAYNE D R W, ZHAO M H. Complement in ANCA-associated vasculitis: mechanisms and implications for management[J]. Nat Rev Nephrol, 2017, 13: 359-367. |
| [10] |
徐鹏程, 闫铁昆. 抗中性粒细胞胞浆抗体在血管炎中致病机制的研究进展[J]. 免疫学杂志, 2016, 32: 77-81. |
| [11] |
WALLACE Z S, STONE J H. An update on IgG4-related disease[J]. Curr Opin Rheumatol, 2015, 27: 83-90. DOI:10.1097/BOR.0000000000000133 |
| [12] |
师千与, 刘燕鹰. 免疫球蛋白G4相关疾病的诊治进展[J]. 中华风湿病学杂志, 2021, 25: 564-569. DOI:10.3760/cma.j.cn141217-20201120-00438 |
| [13] |
AALBERSE R C, SCHUURMAN J. IgG4 breaking the rules[J]. Immunology, 2002, 105: 9-19. DOI:10.1046/j.0019-2805.2001.01341.x |
| [14] |
STONE J H, ZEN Y, DESHPANDE V. IgG4-related disease[J]. N Engl J Med, 2012, 366: 539-551. DOI:10.1056/NEJMra1104650 |
| [15] |
孟海妹, 焦亚冲, 刘宜昕, 万春友, 邢冬红, 马骏, 等. 中性粒细胞胞外诱捕网促进类风湿关节炎血管新生的初步研究[J]. 天津医药, 2017, 45: 13-16, 115. DOI:10.11958/20161290 |
| [16] |
HONG Y, ELEFTHERIOU D, HUSSAIN A A K, PRICE-KUEHNE F E, SAVAGE C O, JAYNE D, et al. Anti-neutrophil cytoplasmic antibodies stimulate release of neutrophil microparticles[J]. J Am Soc Nephrol, 2012, 23: 49-62. DOI:10.1681/ASN.2011030298 |
| [17] |
LEE K H, KRONBICHLER A, PARK D D Y, PARK Y, MOON H, KIM H, et al. Neutrophil extracellular traps (NETs) in autoimmune diseases: a comprehensive review[J]. Autoimmun Rev, 2017, 16: 1160-1173. DOI:10.1016/j.autrev.2017.09.012 |
| [18] |
CHOCOVA Z, HRUSKOVA Z, MARECKOVA H, SVOBODOVA B, DUSKOVA D, BEDNAROVA V, et al. Rituximab use in patients with ANCA-associated vasculitis: clinical efficacy and impact on immunological parameters[J]. Clin Rheumatol, 2015, 34: 107-115. DOI:10.1007/s10067-014-2816-7 |
| [19] |
BERTI A, CAVALLI G, CAMPOCHIARO C, GUGLIELMI B, BALDISSERA E, CAPPIO S, et al. Interleukin-6 in ANCA-associated vasculitis: rationale for successful treatment with tocilizumab[J]. Semin Arthritis Rheum, 2015, 45: 48-54. DOI:10.1016/j.semarthrit.2015.02.002 |
| [20] |
TIPPING P G, KITCHING A R. Glomerulonephritis, Th1 and Th2:what's new?[J]. Clin Exp Immunol, 2005, 142: 207-215. DOI:10.1111/j.1365-2249.2005.02842.x |
| [21] |
SPIEGELBERG H L. Fc receptors for IgE and interleukin-4 induced IgE and IgG4 secretion[J]. J Invest Dermatol, 1990, 94(6 Suppl): 49S-52S. |
| [22] |
KUROKI A, IYODA M, SHIBATA T, SUGISAKI T. Th2 cytokines increase and stimulate B cells to produce IgG4 in idiopathic membranous nephropathy[J]. Kidney Int, 2005, 68: 302-310. DOI:10.1111/j.1523-1755.2005.00415.x |
| [23] |
AKIYAMA M, YASUOKA H, YOSHIMOTO K, TAKEUCHI T. Interleukin-4 contributes to the shift of balance of IgG subclasses toward IgG4 in IgG4-related disease[J]. Cytokine, 2018, 110: 416-419. DOI:10.1016/j.cyto.2018.05.009 |
| [24] |
CARBONE G, WILSON A, DIEHL S A, BUNN J, COOPER S M, RINCON M. Interleukin-6 receptor blockade selectively reduces IL-21 production by CD4 T cells and IgG4 autoantibodies in rheumatoid arthritis[J]. Int J Biol Sci, 2013, 9: 279-288. DOI:10.7150/ijbs.5996 |
 2022, Vol. 43
2022, Vol. 43


