次氯酸(hypochlorous acid,HClO)是哺乳动物体内的一种内源性抗菌剂,通过破坏DNA、使蛋白质变性和酶失活等作用杀灭细菌[1]。HClO具有天然来源、起效快、抗菌谱广、不产生耐药性及毒性低等优点,但其化学物质不稳定,易分解成杀菌效果较弱的次氯酸根离子,临床应用有限[2]。随着HClO制备技术的发展,稳定性更好的HClO消毒剂逐步面市,在抗生素滥用导致耐药菌株逐渐增多的背景下,HClO重新获得临床医师的关注。含HClO的商品化冲洗液、敷料等已被证实对糖尿病足感染、下肢溃疡、烧伤感染、坏死性筋膜炎等有良好的治疗效果[3-5],口腔科也应用次氯酸盐作为根管治疗冲洗液[6-7]。牙龈及根管微环境与骨微环境类似,因此我们猜想HClO冲洗可能对开放性骨折的感染预防和慢性骨髓炎具有潜在治疗效果。目前将HClO应用于骨骼系统感染治疗的报道少见。本研究通过体外实验评估不同浓度HClO对成纤维细胞和成骨细胞的安全性,以及低浓度HClO对革兰氏阳性和革兰氏阴性菌的抗菌有效性,为后期推广临床试验提供体外依据。
1 材料和方法 1.1 实验材料小鼠上皮样成纤维细胞系L929(CL-0137)和小鼠成骨细胞系MC3T3-E1(CL-0251)均购于武汉普诺赛生命科技有限公司,分别使用含10% FBS、1%青霉素-链霉素的RPMI 1640培养基和α-MEM培养基(美国HyClone公司)培养。细胞在37 ℃、5% CO2培养箱中培养,每2 d换1次培养基,细胞融合度达70%后按1∶3传代培养。C57BL/6小鼠购自北京维通利华实验动物技术有限公司[实验动物生产许可证号:SCXK(京)2021-0006]。金黄色葡萄球菌(ATCC®25923)和大肠埃希菌(ATCC®35218)标准菌株购自美国模式培养物保藏中心。LB液体培养基和固体培养基购自生工生物工程(上海)股份有限公司。HClO购自国药集团上海有限公司,MTT试剂盒购自武汉赛维尔生物科技有限公司,膜联蛋白Ⅴ-FITC/PI细胞凋亡检测试剂盒购自上海碧云天生物技术有限公司。
1.2 细胞集落形成实验实验设置空白对照组和不同浓度(10%、30%、50%和100%)HClO组,每组设3个生物学重复。取处于对数生长期的L929、MC3T3-E1细胞,制备单细胞悬液,按每孔100~200个细胞的密度接种至24孔培养板中,在37 ℃、5% CO2培养箱中培养24 h后加入对应浓度的HClO继续培养。于加入HClO后1、3、5、7 d在倒置显微镜下观察细胞集落形成情况并拍照,计数大于10个细胞的单细胞集落。
1.3 细胞增殖实验实验设置空白对照组和不同浓度(10%、30%、50%和100%)HClO组,每组设3个生物学重复。取处于对数生长期的L929、MC3T3-E1细胞,制备单细胞悬液,按每孔5×104个细胞的密度接种至96孔培养板中,在37 ℃、5% CO2培养箱中培养12 h后更换含对应浓度HClO的完全培养基,继续培养24 h后采用MTT试剂盒检测细胞增殖情况,计算细胞增殖抑制率。
1.4 细胞凋亡实验实验设置空白对照组和不同浓度(10%、30%、50%和100%)HClO组,每组设3个生物学重复。L929、MC3T3-E1细胞融合度至80%后接种于6孔板中。待细胞完全生长稳定后加入对应浓度的HClO继续培养24 h,然后离心提取细胞,用膜联蛋白Ⅴ-FITC/PI细胞凋亡检测试剂盒染色,上流式细胞仪检测细胞凋亡率。
1.5 溶血实验实验设置生理盐水组、PBS组和不同浓度(10%、30%、50%和100%)HClO组,每组设3个生物学重复。提取C57BL/6小鼠红细胞,充分洗涤后吸弃上层生理盐水,取底部红细胞,制备成2%的红细胞悬液。根据分组将生理盐水、PBS和不同浓度HClO与红细胞悬液混合,37 ℃恒温水浴锅水浴,每隔1 h记录溶血情况至3 h。
1.6 细菌生长抑制实验金黄色葡萄球菌实验设置空白对照组、2.5 mg/mL万古霉素(阳性对照)组和10% HClO组,大肠埃希菌实验设置空白对照组、2.5 mg/mL头孢西丁钠(阳性对照)组和10% HClO组,每组设3个生物学重复。将金黄色葡萄球菌和大肠埃希菌接种至1 mL LB液体培养基,于37 ℃、160 r/min培养12 h;然后吸取菌液在LB固体培养基上划线,倒置培养于37 ℃恒温箱12 h至长出单菌落。取单菌落接种至1 mL LB液体培养基中,37 ℃、160 r/min培养过夜。根据分组情况将HClO和万古霉素加入菌液中,继续以37 ℃、160 r/min培养细菌,于0、2、6、24、72 h取样测定600 nm波长处的光密度(D600)值。配制对应组别的固体培养基,将菌液涂布于各平板后0、2、6、24、72 h观察细菌生长情况并拍照。
1.7 抑菌圈实验金黄色葡萄球菌实验设置空白对照组、2.5 mg/mL万古霉素(阳性对照)组、10% HClO组、15%碘伏组和15%过氧化氢组,大肠埃希菌实验设置空白对照组、2.5 mg/mL头孢西丁钠(阳性对照)组、10% HClO组、15%碘伏组和15%过氧化氢组,每组设3个生物学重复。制备直径为6 mm的无菌纸片,121 ℃高压灭菌,待干燥后根据分组情况制备相应的对照和药物敏感性检测纸片,25 ℃避光干燥。取单菌落,用生理盐水制备D600为0.5~0.6的菌悬液,均匀涂布于LB固体平板培养基,贴上对照或药物敏感性检测纸片,37 ℃倒置培养24及48 h后测量抑菌圈大小。
1.8 统计学处理采用SPSS 22.0软件分析数据。采用Shapiro-Wilk检验对所有数据进行正态性检验,符合正态分布的数据以x±s表示,多组间比较采用单因素方差分析,多重比较采用最小显著性差异法。检验水准(α)为0.05。
2 结果 2.1 不同浓度HClO对L929和MC3T3-E1细胞集落形成的影响空白对照组L929、MC3T3-E1细胞的集落形成明显,细胞增殖趋势正常,7 d开始出现细胞衰老。10% HClO处理的L929细胞随着培养时间的延长增殖明显,3 d前集落形成速度较空白对照组慢,其中3 d时形成的集落数少于空白对照组(P < 0.05);5 d时形成的集落数与空白对照组相比差异无统计学意义(P>0.05);7 d时细胞衰老明显,形成的集落数少于空白对照组(P < 0.01)。10% HClO处理的MC3T3-E1细胞3 d时形成的集落数少于空白对照组(P < 0.05);5 d时形成的集落数与空白对照组相比差异无统计学意义(P>0.05);7 d时细胞衰老明显,形成的集落数少于空白对照组(P < 0.01)。30%、50%、100% HClO作用1、3、5、7 d,L929、MC3T3-E1细胞均无单细胞集落形成,细胞基本死亡。见图 1。
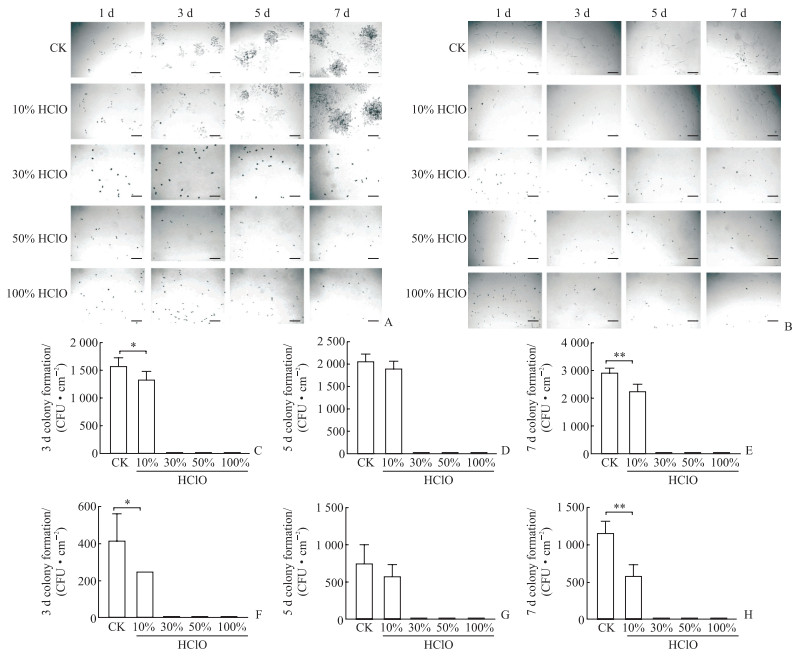
|
图 1 L929和MC3T3-E1细胞在不同浓度HClO刺激下的集落形成情况 Fig 1 Colony formation of L929 and MC3T3-E1 cells stimulated by different concentrations of HClO A, B: Colony formation images of L929 (A) and MC3T3-E1 (B) cells after interventing with different concentrations of HClO; C-E: Colony numbers of L929 cells 3 d (C), 5 d (D) and 7 d (E) after HClO stimulation; F-H: Colony numbers of MC3T3-E1 cells 3 d (F), 5 d (G) and 7 d (H) after HClO stimulation. Scale bar=100 μm. *P < 0.05, **P < 0.01. n=3, x±s. HClO: Hypochlorous acid; CK: Control check; CFU: Colony forming unit. |
2.2 不同浓度HClO对L929和MC3T3-E1细胞增殖及凋亡的影响
细胞增殖实验结果显示,HClO对L929及MC3T3-E1细胞生长抑制作用存在浓度依赖,10% HClO组2种细胞的增殖抑制率较低,而30%、50%和100% HClO组2种细胞的增殖抑制率增高,与10% HClO组相比差异均有统计学意义(P均 < 0.01,图 2A~2C)。细胞凋亡实验结果显示,随着HClO浓度的升高,L929和MC3T3-E1细胞的凋亡率也逐渐升高(图 2D~2F)。
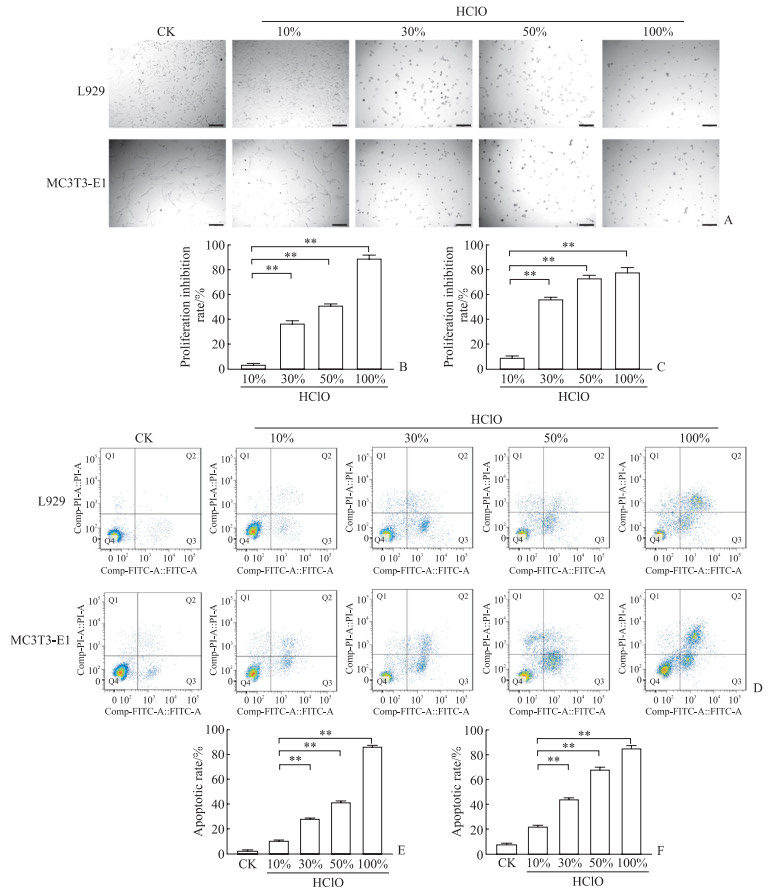
|
图 2 L929和MC3T3-E1细胞在不同浓度HClO刺激下的增殖及凋亡情况 Fig 2 Proliferation and apoptosis of L929 and MC3T3-E1 cells stimulated by different concentrations of HClO A: Images of L929 and MC3T3-E1 cells 24 h after different concentrations of HClO stimulation; B, C: Proliferation inhibition rates of L929 (B) and MC3T3-E1 (C) cells 24 h after different concentrations of HClO stimulation; D: Flow cytometry images of L929 and MC3T3-E1 cells 24 h after HClO treatment; E, F: Apoptotic rates of L929 (E) and MC3T3-E1 (F) cells 24 h after HClO stimulation. Scale bar=100 μm. **P < 0.01. n=3, x±s. HClO: Hypochlorous acid; CK: Control check; FITC: Fluorescein isothiocyanate; PI: Propidium iodide. |
2.3 不同浓度HClO对小鼠红细胞的溶血风险
溶血实验结果显示,生理盐水阳性对照组出现明显溶血反应,但各浓度HClO组温育后1~3 h均未发生溶血,与PBS阴性对照组相比无明显差异(图 3)。

|
图 3 不同浓度HClO作用下小鼠红细胞的溶血反应 Fig 3 Hemolysis responses of erythrocytes to different concentrations of HClO in mice A: 1 h; B: 2 h; C: 3 h. HClO: Hypochlorous acid; NS: Normal saline; PBS: Phosphate buffered saline. |
2.4 低浓度HClO对革兰氏阳性菌的抑制作用
金黄色葡萄球菌生长抑制实验结果(图 4A、4B)显示,万古霉素阳性对照组0~72 h细菌没有明显增殖;空白对照组细菌逐渐增殖,24 h后进入平台期;10% HClO组细菌增殖趋势与空白对照组一致,但培养至6 h及之后各个时间点D600均低于空白对照组(P均 < 0.01),说明其对金黄色葡萄球菌有明显抑制作用。抑菌圈实验结果(图 4C、4D)显示万古霉素对金黄色葡萄球菌的抑制作用优于3种消毒剂(P均 < 0.01),10% HClO抑菌效果与碘伏和过氧化氢无明显差异。
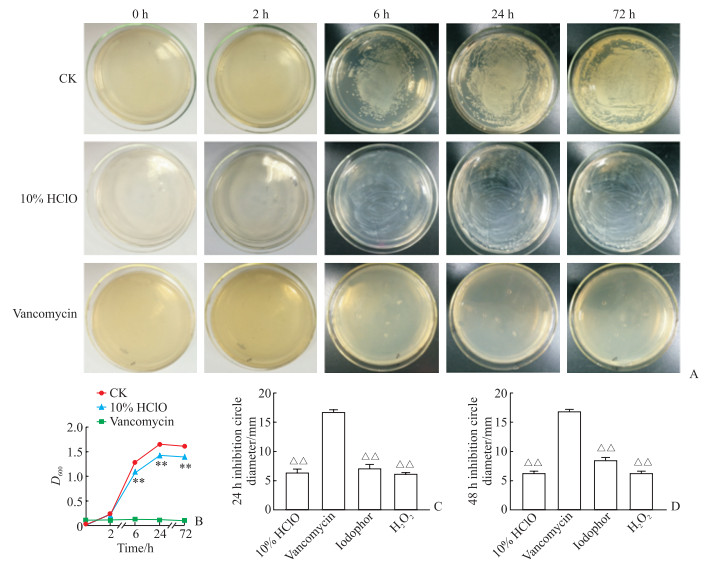
|
图 4 10% HClO对金黄色葡萄球菌生长的抑制作用 Fig 4 Inhibition of Staphylococcus aureus growth by 10% HClO A: Images of Staphylococcus aureus 0-72 h after 10% HClO and vancomycin stimulation; B: D600 of Staphylococcus aureus 0-72 h after 10% HClO and vancomycin stimulation; C, D: Diameter of inhibition circle of Staphylococcus aureus 24 h (C) and 48 h (D) after 10% HClO, vancomycin, iodophor and H2O2 treatment. **P < 0.01 vs CK group; △△P < 0.01 vs vancomycin group. n=3, x±s. HClO: Hypochlorous acid; CK: Control check; H2O2: Hydrogen peroxide. |
2.5 低浓度HClO对革兰氏阴性菌的抑制作用
大肠埃希菌生长抑制实验结果(图 5A、5B)显示,头孢西丁钠阳性对照组0~72 h细菌几乎没有生长;空白对照组大肠埃希菌随培养时间的延长明显增殖;10% HClO对大肠埃希菌抑制效果明显,处理至6 h及之后各时间点D600均低于空白对照组(P均 < 0.01)。抑菌圈实验结果(图 5C、5D)显示头孢西丁钠对大肠埃希菌的抑制作用优于3种消毒剂(P均 < 0.01),10% HClO抑菌效果与碘伏和过氧化氢无明显差异。
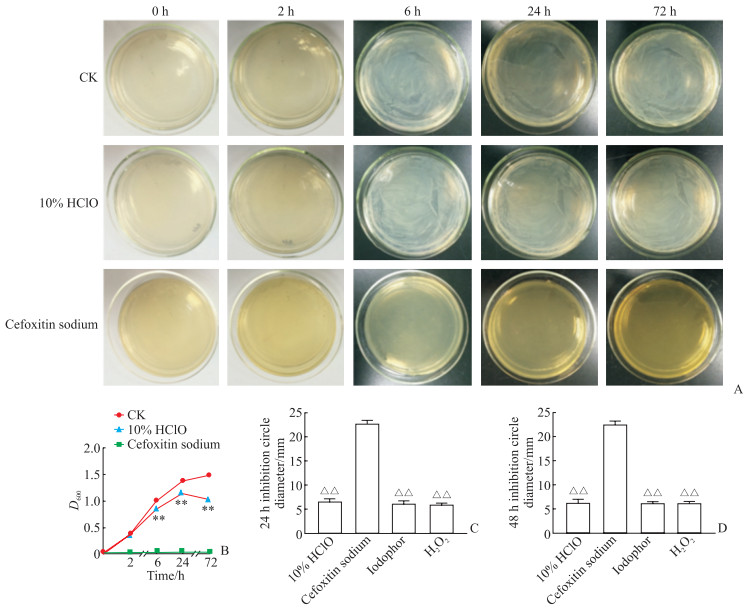
|
图 5 10% HClO对大肠埃希菌生长的抑制作用 Fig 5 Inhibition of Escherichia coli growth by 10% HClO A: Images of Escherichia coli 0-72 h after 10% HClO and cefoxitin sodium treatment; B: D600 of Escherichia coli 0-72 h after 10% HClO and cefoxitin sodium treatment; C, D: Diameter of inhibition circle of Escherichia coli 24 h (C) and 48 h (D) after 10% HClO, cefoxitin sodium, iodophor and H2O2 treatment. **P < 0.01 vs CK group; △△P < 0.01 vs cefoxitin sodium group. n=3, x±s. HClO: Hypochlorous acid; CK: Control check; H2O2: Hydrogen peroxide. |
3 讨论
HClO具有以下优点:(1)起效快速,可在1 min内杀灭临床常见细菌;(2)可以中和细菌毒素包括金黄色葡萄球菌α-溶血素和化脓链球菌链激酶;(3)杀菌效果强,可以穿透细菌生物膜起作用;(4)作为天然抗菌剂,低浓度HClO具有较低的生物毒性;(5)抗菌谱广,且不产生耐药性[8-10]。虽然HClO具有以上优势,但以往HClO制备工艺差,保存方法不合适导致HClO因稳定性差而未能在临床广泛应用[4]。目前HClO制备工艺提升,各种含HClO敷料及溶液的出现使HClO再次成为清创和创面治疗的主要消毒剂之一[11]。
HClO及含HClO消毒剂主要应用于慢性创面和口腔感染的治疗[12-14]。应用HClO治疗开放性骨折及骨科感染的报道极少。开放性骨折内固定术后感染易形成依附于内植物表面的生物膜,导致系统性应用抗生素疗效差及创面冲洗不彻底[15]。HClO穿透力强,易透过生物膜,是潜在的骨感染清创药物[8, 16]。朱书芳[17]报道了1例应用含0.01% 纯HClO的冲洗液冲洗耐甲氧西林金黄色葡萄球菌感染的化脓性骨髓炎病例。该患者诊断为骨折内固定术后感染、骨髓炎,细菌培养提示耐甲氧西林金黄色葡萄球菌阳性,在骨髓炎清创术中采用生理盐水-过氧化氢-生理盐水序贯冲洗,加用0.01%纯HClO冲洗液冲洗伤口并湿敷1 min,术后负压引流,持续使用0.01%纯HClO冲洗创面。患者清创术后21 d创面无感染征象,在植皮后20 d创面愈合,清创术后6个月骨折断端形成骨痂。该病例报告表明采用HClO冲洗治疗骨髓炎具有一定的可行性,但目前尚未见大样本量研究。此外,HClO应用于骨科领域的体外研究也很少,尚无体外数据支持HClO的临床应用。
大量针对不同类型细胞的体外研究表明低浓度HClO未出现细胞毒性[18-19]。本研究探讨了HClO对成骨细胞与成纤维细胞的安全性。研究结果显示,10% HClO对成纤维细胞和成骨细胞的毒性较低,短期应用细胞增殖未受明显影响,也未出现明显凋亡,但是持续低浓度刺激1周后出现细胞衰老加速,这可能是因为HClO的强氧化性导致大量氧自由基产生,后者是细胞衰老的主要元凶。因此长期低浓度HClO处理伤口可能存在负面效果,但是短期应用低浓度HClO冲洗创面具有可行性。此外,溶血实验结果显示各浓度HClO均不会导致溶血反应,提示在清创手术中即使出现HClO入血也不会导致溶血,安全性较高。
碘伏、过氧化氢是传统开放性骨折及骨髓炎的清创消毒剂。碘伏适用于皮肤及黏膜处,刺激性相对较小,患者耐受性好[20]。过氧化氢可通过氧化作用分解腐烂组织,适用于厌氧伤口的清创,但不适用于肉芽创面的持续冲洗引流。本研究观察了10% HClO、碘伏与过氧化氢针对革兰氏阳性和革兰氏阴性菌的抑菌效果,发现3种消毒剂24 h和48 h抑菌圈直径差异无统计学意义。对于大肠埃希菌,10% HClO具有与碘伏和过氧化氢相似的杀菌效果;但对于金黄色葡萄球菌,10% HClO的杀菌效果稍弱于碘伏,可能与HClO降解、浓度下降有关。本研究结果表明HClO可能需要多频次、短间隙给药,维持HClO的浓度以保证杀菌效果。结合HClO低毒性特点,其既可以作为清创术中冲洗消毒剂,也可以术后持续使用。
HClO冲洗也存在潜在的风险,除了本实验提示的HClO的氧化性可能导致细胞衰老外,次氯酸根离子可能导致骨质疏松。Kerbl等[21]以20 mm厚的犬股骨切片进行体外研究,通过CT及组织学染色发现向骨组织内注射5.25%次氯酸钠会导致骨小梁结构稀疏。该研究使用次氯酸钠而非HClO,导致骨质结构稀疏的原因主要为次氯酸根离子。临床应用HClO冲洗治疗骨髓炎及开放性骨折的不良反应仍需要开展更多体内研究来探索。本研究的主要缺陷即缺乏体内研究结果,后期将利用大鼠骨髓炎模型,采用低浓度HClO冲洗病灶,观察HClO冲洗对大鼠各重要脏器的影响,并观察感染表征的变化和骨折愈合情况。
综上所述,本研究提供了低浓度(10%)HClO对于骨组织主要细胞安全性的研究数据,也验证了低浓度HClO具有良好的杀菌效果,是潜在的骨髓炎及开放性骨折冲洗剂。
| [1] |
BLOCK M S, ROWAN B G. Hypochlorous acid: a review[J]. J Oral Maxillofac Surg, 2020, 78: 1461-1466. DOI:10.1016/j.joms.2020.06.029 |
| [2] |
王昳娜, 何振华, 周瑾, 孙晓芬. 次氯酸在伤口护理中的应用研究进展[J]. 护理研究, 2021, 35: 2904-2909. DOI:10.12102/j.issn.1009-6493.2021.16.023 |
| [3] |
WONGKIETKACHORN A, SURAKUNPRAPHA P, WITTAYAPAIROCH J, WONGKIETKACHORN N, WONGKIETKACHORN S. The use of hypochlorous acid lavage to treat infected cavity wounds[J/OL]. Plast Reconstr Surg Glob Open, 2020, 8: e2604. DOI: 10.1097/GOX.0000000000002604.
|
| [4] |
GOLD M H, ANDRIESSEN A, BHATIA A C, BITTER P Jr, CHILUKURI S, COHEN J L, et al. Topical stabilized hypochlorous acid: the future gold standard for wound care and scar management in dermatologic and plastic surgery procedures[J]. J Cosmet Dermatol, 2020, 19: 270-277. DOI:10.1111/jocd.13280 |
| [5] |
GOLD M H, ANDRIESSEN A, BHATIA A C, BITTER P Jr, CHILUKURI S, COHEN J L, et al. Topical stabilized hypochlorous acid: the future gold standard for wound care and scar management in dermatologic and plastic surgery procedures[J]. J Cosmet Dermatol, 2020, 19: 270-277. DOI:10.1111/jocd.13280 |
| [6] |
VERMA N, SANGWAN P, TEWARI S, DUHAN J. Effect of different concentrations of sodium hypochlorite on outcome of primary root canal treatment: a randomized controlled trial[J]. J Endod, 2019, 45: 357-363. |
| [7] |
杨菲菲. 超声下1% 次氯酸钠液联合洗必泰液对感染根管内粪肠球菌清除效果的分析[J]. 当代医学, 2020, 26: 46-48. |
| [8] |
DAY A, ALKHALIL A, CARNEY B C, HOFFMAN H N, MOFFATT L T, SHUPP J W. Disruption of biofilms and neutralization of bacteria using hypochlorous acid solution: an in vivo and in vitro evaluation[J]. Adv Skin Wound Care, 2017, 30: 543-551. DOI:10.1097/01.ASW.0000526607.80113.66 |
| [9] |
DEL ROSSO J Q, BHATIA N. Status report on topical hypochlorous acid: clinical relevance of specific formulations, potential modes of action, and study outcomes[J]. J Clin Aesthet Dermatol, 2018, 11: 36-39. |
| [10] |
CHEN C J, CHEN C C, DING S J. Effectiveness of hypochlorous acid to reduce the biofilms on titanium alloy surfaces in vitro[J/OL]. Int J Mol Sci, 2016, 17: 1161. DOI: 10.3390/ijms17071161.
|
| [11] |
顾峥嵘, 陈晓, 翁蔚宗, 曹烈虎, 苏佳灿. 次氯酸临床研究及使用进展[J]. 世界复合医学, 2015, 1: 336-339. |
| [12] |
ELIASSON B, FAGERDAHL A M, JÖNSSON A, APELQVIST J. Debriding effect of amino acid-buffered hypochlorite on hard-to-heal wounds covered by devitalised tissue: pilot study[J]. J Wound Care, 2021, 30: 455-464. DOI:10.12968/jowc.2021.30.6.455 |
| [13] |
MALLOW P J, HIEBERT J M, ROBSON M C. Costeffectiveness of hypochlorous acid preserved wound cleanser versus saline irrigation in conjunction with ultrasonic debridement for complex wounds[J]. J Health Econ Outcomes Res, 2021, 8: 76-81. DOI:10.36469/jheor.2021.28429 |
| [14] |
HERRUZO R, HERRUZO I. Antimicrobial efficacy of a very stable hypochlorous acid formula compared with other antiseptics used in treating wounds: in-vitro study on micro-organisms with or without biofilm[J]. J Hosp Infect, 2020, 105: 289-294. DOI:10.1016/j.jhin.2020.01.013 |
| [15] |
SIDDIQI A, ABDO Z E, SPRINGER B D, CHEN A F. Pursuit of the ideal antiseptic irrigation solution in the management of periprosthetic joint infections[J]. J Bone Jt Infect, 2021, 6: 189-198. DOI:10.5194/jbji-6-189-2021 |
| [16] |
RAVAL Y S, FLURIN L, MOHAMED A, GREENWOODQUAINTANCE K E, BEYENAL H, PATEL R. In vitro activity of hydrogen peroxide and hypochlorous acid generated by electrochemical scaffolds against planktonic and biofilm bacteria[J/OL]. Antimicrob Agents Chemother, 2021, 65: e01966-e01920. DOI: 10.1128/AAC.01966-20.
|
| [17] |
朱书芳. 纯次氯酸冲洗液应用1例创伤后骨髓炎的治疗[J]. 医学信息, 2018, 31: 186-187. |
| [18] |
SLAUGHTER R J, WATTS M, VALE J A, GRIEVE J R, SCHEP L J. The clinical toxicology of sodium hypochlorite[J]. Clin Toxicol (Phila), 2019, 57: 303-311. DOI:10.1080/15563650.2018.1543889 |
| [19] |
SEVERING A L, REMBE J D, KOESTER V, STUERMER E K. Safety and efficacy profiles of different commercial sodium hypochlorite/hypochlorous acid solutions (NaClO/HClO): antimicrobial efficacy, cytotoxic impact and physicochemical parameters in vitro[J]. J Antimicrob Chemother, 2019, 74: 365-372. DOI:10.1093/jac/dky432 |
| [20] |
周海微, 李学渊, 应瑛, 孙凌燕, 王萑. 不同消毒液对手外科感染伤口消毒的效果比较[J]. 解放军护理杂志, 2017, 34: 70-72. |
| [21] |
KERBL F M, DEVILLIERS P, LITAKER M, ELEAZER P D. Physical effects of sodium hypochlorite on bone: an ex vivo study[J]. J Endod, 2012, 38: 357-359. DOI:10.1016/j.joen.2011.12.031 |
 2022, Vol. 43
2022, Vol. 43


