2. 上海国际医学中心介入超声科,上海 201318;
3. 中国人民解放军联勤保障部队 904 医院苏州医疗区特诊科,苏州 215007
2. Department of Ultrasonic Intervention, Shanghai International Medical Center, Shanghai 201318, China;
3. Department of Special Diagnosis, No. 904 Hospital of Joint Logistics Support Forces of PLA, Suzhou 215007, Jiangsu, China
近年来微波消融技术迅速发展,成为诸多甲状腺结节患者的首选治疗方法,微波消融术后疗效的评估也逐渐受到重视。微波消融疗效的随访评估高度依赖超声诊断,但由于部分超声医师对消融技术认识不足、不同超声医师的诊断水平参差不齐等,甲状腺结节消融区常被误诊为“恶性倾向”,甚至出现建议再次手术治疗等一系列有悖常理的问题。若任由此类现象频发,将会造成医患之间的误解甚或冲突,这不仅会割裂医患双方互信,还会影响甲状腺结节微波消融治疗技术的稳定发展,必须予以高度重视。
目前学者们积极探讨甲状腺结节微波消融治疗的规范和指南,且已有多部专家共识[1-2],然而各共识均未提及术后疗效评估的超声影像学特征,且大多数学者的关注点在于消融区体积缩小、造影剂灌注缺损、质地弹性降低等[3-5],鲜有对甲状腺结节微波消融术后二维声像图的改变及消融区的动态演变进行总结。笔者拟全面观察分析二维灰阶图像、彩色多普勒超声图像中甲状腺结节微波消融区的动态变化特征,以甲状腺乳头状癌(papillary thyroid carcinoma,PTC)的声像学特征作为对照,寻找甲状腺结节消融区被误判为恶性倾向的原因及鉴别方法,更好地发挥超声影像在甲状腺结节诊疗中的作用。
1 资料和方法 1.1 一般资料选择2015年1月至2018年12月因甲状腺结节在海军军医大学(第二军医大学)第二附属医院、上海国际医学中心就诊并接受超声引导下经皮穿刺微波消融术治疗的患者786例(856枚结节)。纳入标准:(1)术前经粗针组织学穿刺活检明确病理诊断(粗针活检时均对每枚结节内部及边缘区多次取材,确保包含肿瘤及包膜处组织结构),其中恶性结节患者仅纳入组织学病理诊断为PTC的患者且结节最大切面长径 < 10 mm,同时肿瘤周边未接近甲状腺包膜。(2)良性结节最大切面长径 < 30 mm,满足一次性微波消融条件;良性结节最大切面长径 < 10 mm,患者拒绝临床观察、强烈要求微波消融治疗。(3)结节性甲状腺肿患者结节边界相对清晰,未与其他病灶相融合。(4)实性且无囊性成分的结节。(5)结节外甲状腺组织回声均匀,无弥漫性改变。本研究通过海军军医大学(第二军医大学)第二附属医院医学伦理委员会审批。
1.2 研究分组根据消融前穿刺活检病理诊断将患者分为两组:良性结节消融组和恶性结节消融组。
1.3 仪器与设备超声诊断仪购自日本Hitachi公司(Preirus型,探头频率为5~13 MHz,具备高频和低频超声造影功能)。微波消融仪购自南京康友医疗科技有限公司(KY-2000型,匹配Thy-ablation型微波消融针)和维京九州医疗器械研发中心(MTC-3型,匹配MTC-3CA-Ⅲ型微波消融针)。组织学活检针为Presia 18G-HS型切割式活检针。
1.4 观察指标与检查方法(1)以消融后第1、3、6、12个月为随访节点,收集并记录两组消融区二维声像图特征,包括消融区的大小、形态、边界、内部回声、血供情况,重点描述其回声高低、内部有无“消融针道”、周边有无晕环、有无钙化、边界是否清晰、纵横比是否失调(>1)、内部及周边血供情况。(2)收集恶性结节消融组消融术前的二维超声图像特征。(3)以组织学穿刺活检病理诊断作为消融区评估金标准,所有消融区均在术后即刻及术后第6个月行粗针穿刺活检[6],获取组织学病理结果。
1.5 统计学处理应用SPSS 24.0软件进行统计学分析。正态分布的计量资料以x±s表示,计数资料以例(枚)数和百分数表示。对两组消融区内低回声区面积>1/2的结节占比、消融区边缘晕环完整度、消融区出现针道特征的结节占比、消融区出现钙化的结节占比、消融区出现血流信号的结节占比等计数资料采用χ2检验进行比较。检验水准(α)为0.05。
2 结果 2.1 一般资料共364例患者(434枚结节)入组,男77例(92枚结节)、女287例(342枚结节),年龄为13~87(48.6±20.3)岁。良性结节消融组286例(329枚结节),其中滤泡性腺瘤134例(145枚结节)、结节性甲状腺肿152例(184枚结节);恶性结节消融组78例(105枚结节)。两组所有结节消融区术后第6个月末均予粗针穿刺活检,组织学病理结果证实消融区均已完全坏死,无残存细胞。
2.2 甲状腺良、恶性结节消融区声像图特征比较及经时变化规律 2.2.1 消融区回声的经时变化两组消融区整体呈低回声(图 1),同一时间节点消融区回声的变化趋同,但随时间推移,消融区内低回声区面积>消融区面积1/2的结节占比逐渐降低,消融后1个月良性、恶性结节消融组分别为94.8%(312/329)、90.5%(95/105),消融后3个月分别为96.9%(277/286)、91.8%(90/98),消融后6个月分别为87.2%(212/243)、82.6%(76/92),消融后12个月分别为73.7%(123/167)、73.1%(49/67),各时间节点两组差异均无统计学意义(P均>0.05)。
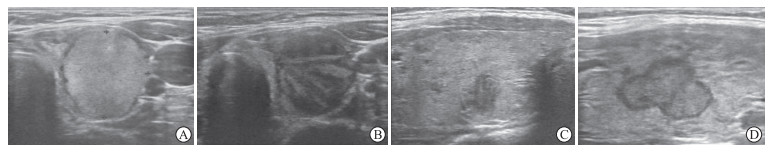
|
图 1 甲状腺良性、恶性结节消融前后回声的变化 Fig 1 Changes of echo before and after ablation of benign and malignant thyroid nodules A, B: Before ablation, benign thyroid nodule was isoechoic (A), and malignant nodule was hypoechoic (B); C, D: After ablation, benign (C) and malignant (D) nodules were hypoechoic. |
2.2.2 消融区边缘的经时变化
消融后1个月,良性结节消融组308枚(93.6%)、恶性结节消融组64枚(61.0%)结节的消融区周边出现更低回声晕环,但晕环多不完整、不清晰,边界较为毛糙;消融后3个月,晕环最为清晰、完整;消融后12个月,晕环特征与消融后1个月时相似。良性结节消融组消融后1、3、6、12个月时消融区边缘晕环完整的结节占比均高于恶性结节消融组(P均 < 0.01)。见图 2、表 1。
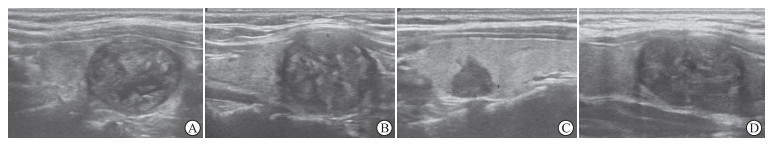
|
图 2 甲状腺结节消融后3个月消融区晕环的特征 Fig 2 Characteristics of acoustic halo in thyroid nodule ablation area 3 months after ablation A: The nodule was surrounded by a complete acoustic halo; B: The nodule was surrounded by a half acoustic halo; C: The nodule was surrounded by a 1/4 acoustic halo; D: There was no acoustic halo in the nodule. |
|
|
表 1 甲状腺良性、恶性结节消融组各随访时间点消融区边缘晕环特征的比较 Tab 1 Comparison of marginal acoustic halo characteristics in ablation area in thyroid between benign and malignant nodule ablation groups at each follow-up time point |
2.2.3 消融针道的变化特征
针道为甲状腺消融区的最典型特征,可分为强回声针道壁及低回声针道腔,在二维超声图像上表现为长轴切面呈长等号样,短轴切面呈环状(图 3)。消融后1个月良性、恶性结节消融组消融区可见针道回声的结节占比分别为97.9%(322/329)、96.2%(101/105),消融后3个月为99.0%(283/286)、91.8%(90/98),消融后6个月为95.5%(232/243)、88.0%(81/92),消融后12个月为82.6%(138/167)、83.6%(56/67),各时间节点两组差异均无统计学意义(P均>0.05)。消融后12个月,20枚结节消融针道已完全吸收。
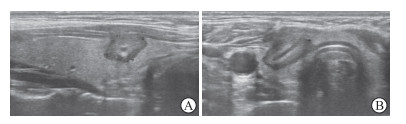
|
图 3 甲状腺结节消融区针道的特征 Fig 3 Characteristics of needle tract in thyroid nodule ablation area A: The needle track appeared as a long isocenter in the long axis view; B: The needle track was looped in the short axis view. |
2.2.4 消融区钙化情况及变化特征
良性结节消融组329枚结节中87枚合并粗大钙化,恶性结节消融组105枚结节中36枚合并散在微小钙化。消融后1个月,良性结节消融组87枚结节及恶性结节消融组36枚结节的钙化均依旧存在,均呈散在分布(图 4A);随时间推移两组钙化均逐渐发生向心性聚集,消融后3个月时良性、恶性结节消融组分别有22枚(25.3%)、5枚(13.9%)结节的钙化发生向心性聚集(图 4B),消融后6个月分别有44枚(50.6%)、11枚(30.6%)发生向心性聚集(图 4C),消融后12个月分别有84枚(96.6%)、35枚(97.2%)发生向心性聚集(图 4D),各时间节点两组差异均无统计学意义(P均>0.05)。
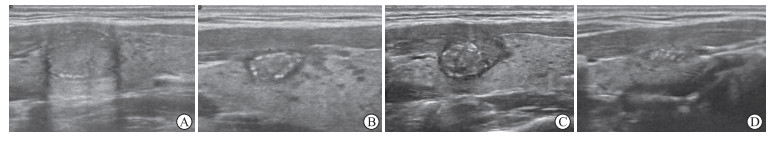
|
图 4 甲状腺结节消融区钙化的经时变化 Fig 4 Time-lapse changes of calcification in thyroid nodule ablation area A: 1 month after ablation; B: 3 months after ablation; C: 6 months after ablation; D: 12 months after ablation. |
2.2.5 甲状腺结节消融区血流灌注的变化
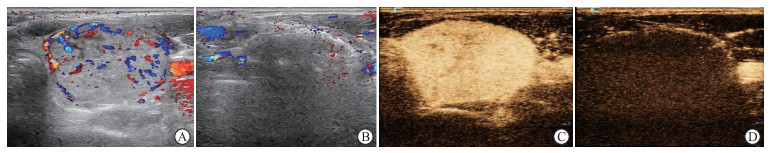
434枚结节消融术后即刻彩色多普勒血流成像(color Doppler flow imaging,CDFI)提示消融区内部及周边均未见血流信号,超声造影无增强(图 5),提示病灶已完全灭活。良性、恶性结节消融组消融区均在消融后3个月出现周边静脉血流信号,消融后3个月两组出现周边血流信号的结节占比分别为90.6%(259/286)、88.8%(87/98),消融后6个月为93.8%(228/243)、89.1%(82/92),消融后12个月为83.2%(139/167)、85.1%(57/67);各随访节点均未见消融区内部出现血流信号。同一时间节点两组消融区血流特征趋同(P均>0.05)。
|
图 5 甲状腺结节消融前后血供的变化 Fig 5 Changes of blood supply in thyroid nodules before and after ablation A: CDFI before ablation; B: CDFI immediately after ablation; C: CEUS before ablation; D: CEUS immediately after ablation. CDFI: Color Doppler flow imaging; CEUS: Contrast enhanced ultrasound. |
2.3 良性、恶性结节消融区声像学特征与恶性结节消融前比较
在消融前,恶性结节消融组105枚结节的主要超声表现为低回声(低回声区面积>结节面积1/2者103枚,98.1%)、周边无晕环(97枚,92.4%)或有不完整晕环(8枚,7.6%)、内部无针道(105枚,100.0%)、散在钙化(36枚,34.3%)、纵横比>1(54枚,51.4%),内部(94枚,89.5%)及周边(92枚,87.6%)可见血流信号。上述这些特征在消融后各时间节点良性、恶性结节消融组均可出现,但每个特征在不同时间节点具有差异性(表 2)。
|
|
表 2 甲状腺良性、恶性结节消融组结节消融区声像学特征与恶性结节消融前的比较 Tab 2 Ultrasonographic characteristics of thyroid benign and malignant nodules in ablation areas compared with those of malignant nodules before ablation |
2.4 甲状腺结节消融区病理表现
消融术后即刻消融区穿刺标本肉眼观可见不同程度的凝固性坏死区,光镜下见甲状腺滤泡结构、形态仍保持完好、细胞核完整(图 6A),与消融前病理形态一致;术后6个月消融区病理结果显示甲状腺滤泡结构消失、坏死组织形成(图 6B),晕环区的病理结果显示为大量胶原纤维组织增生(图 6C)。

|
图 6 甲状腺结节消融术后即刻和术后6个月消融区及周边晕环区组织病理表现 Fig 6 Histology of thyroid adenoma and acoustic halo immediately and 6 months after ablation A: Immediately after ablation, the structure and morphology of thyroid follicles remained intact and the nucleus was intact; B: At 6 months after ablation, the thyroid follicular structure was disappeared and the necrotic tissue was formed; C: The acoustic halo area showed some fibrous tissue hyperplasia 6 months after ablation. Hematoxylin-eosin staining (100×). |
3 讨论
微波消融是20世纪90年代肿瘤非手术治疗研究领域取得的重大进展,该技术凭借热效高、升温快、患者耐受性好等特征在肿瘤局部治疗中受到更多关注[6-7]。微波消融治疗可使瘤体发生原位灭活,且预后评估及消融灶的长期随访离不开超声影像的辅助。目前学者们热衷于运用三维容积成像、弹性成像、超声造影等超声新技术对消融灶的体积、质地及血供等进行评估,而消融坏死区的二维超声特征却鲜被提及[8]。在微波消融治疗后的随访中,消融区可表现出恶性肿瘤的某些特征,不了解微波消融技术的超声医师往往对此难以判断,从而导致误诊、误治频频发生,也阻碍了微波消融技术的发展。
本研究中良性、恶性甲状腺结节术后消融区均整体表现为低回声,笔者推测这可能与消融坏死区逐渐吸收、纤维成分减少、组织致密度减低有关[9],动态观察发现消融区低回声整体范围随时间延长逐渐缩小,其机制可能是吸收加速。消融针道为微波消融治疗独有的典型特征之一,组织学病理提示针道管壁区为致密的碳化组织成分,而针道腔则为微量的渗出液[10]。本研究434枚结节消融术后随访过程中,消融针道由清晰变为逐渐模糊至消失,消融后12个月20枚结节的针道已完全吸收,这与坏死区发生溶解吸收的病理过程相符。甲状腺结节无论良、恶性,其热消融治疗后消融区实为坏死灶[11-13],CDFI检查显示消融区内均无血流信号,但本研究中部分消融区周边出现静脉血流信号,这种现象可能与肉芽组织形成过程中毛细血管重建有关[14],静脉血流的形成也有利于坏死区的吸收。消融区的钙化成分始终不会消失,但随时间延长,钙化会发生向中心聚集的现象,以术后6、12个月更为明显,笔者认为这一现象为消融后吸收过程中钙化周围的组织受到瘢痕牵拉收缩所致。
晕环为消融组共同出现的特征,两组形成的晕环厚薄较均匀、一致,晕环区的组织学病理已被证实为增生的胶原纤维,在微波消融治疗过程中热场能量传播相对均衡、对称,导致消融区边缘形成较为均匀的热损伤过渡区,这与微波消融区边缘温度趋同效应一致[15],同时热损伤修复过程中产生大量淋巴细胞浸润,诱导间充质细胞大量分泌,间充质细胞进一步分化为成纤维细胞,从而形成胶原纤维,这是晕环形成的基础。本研究发现恶性结节消融组形成晕环的结节占比低于良性结节消融组,且恶性结节消融组形成的晕环多不完整,笔者针对这一现象提出肿瘤浸润淋巴细胞诱导晕环形成这一设想。肿瘤浸润淋巴细胞是一种机体对肿瘤细胞特异性的免疫反应,广泛分布于肿瘤组织中,由于PTC的生长模式为浸润性,肿瘤浸润淋巴细胞较为活跃且分布不均匀,其诱导分化的胶原纤维在一定程度上遏制了肿瘤的生长及能量的传播,从而限制了恶性结节消融组晕环的形成。
PTC是甲状腺恶性肿瘤中最常见的病理类型。本研究对105枚PTC消融前的声像学特征进行归纳,发现其低回声、边界不清、边缘毛糙、不完整晕环、钙化等恶性特征在消融组中均可出现,易引起误诊及误治。笔者总结了甲状腺结节消融区和PTC结节的鉴别要点:(1)消融针道为消融区特有的典型特征之一,而PTC无此特征。(2)消融区周边的低回声晕环在消融后3个月最为均匀、清晰、完整,但在消融后1、12个月时比较模糊、不完整,边缘毛糙;而部分PTC结节周边亦可出现晕环,这种晕环常不完整并且晕环厚薄不一,故消融后1、12个月消融区图像与PTC相似度最高,鉴别难度较大,但仍可通过晕环的细节特征加以甄别。(3)消融区实为坏死灶,后期表现为经时萎缩,最终会被吸收,而PTC往往瘤体长期保持不变或短期内有明显增大趋势。(4)伴钙化的结节消融后钙化依旧存在,并经时呈向心性聚拢,而PTC的钙化为无规律的散在分布。(5)CDFI提示术后消融区无血流信号,超声造影提示消融区无增强,在消融后3个月开始消融区周边可出现静脉血流,而PTC内部及周边均可出现血流信号,此为鉴别要点。
综上所述,甲状腺结节无论良、恶性,因其消融治疗后消融区发生热凝固坏死使声像学特征趋同,虽与PTC有相似之处,但也有诸多的鉴别要点。随着甲状腺结节热消融技术日趋成熟,术后准确、规范的疗效评估尤为重要,对甲状腺结节消融区的超声影像学表现进行分析、研究和总结有助于进一步丰富和完善甲状腺热消融治疗评价体系,对推动甲状腺热消融技术的开展具有重要意义。
| [1] |
中国医师协会介入医师分会超声介入专业委员会, 中国医师协会介入医师分会肿瘤消融治疗专业委员会, 中国抗癌协会肿瘤消融治疗专业委员会, 中国临床肿瘤学会肿瘤消融治疗专家委员会. 甲状腺良性结节解剖位置分类与热消融风险防控专家共识[J/CD]. 中华医学超声杂志(电子版), 2020, 17: 6-10.
|
| [2] |
中国医师协会甲状腺肿瘤消融治疗技术专家组, 中国抗癌协会甲状腺癌专业委员会, 中国医师协会介入医师分会超声介入专业委员会, 中国医师协会介入医师分会肿瘤消融专业委员会, 中国抗癌协会肿瘤介入专业委员会, 中国抗癌协会肿瘤微创治疗专业委员会. 甲状腺良性结节、微小癌及颈部转移性淋巴结热消融治疗专家共识(2018版)[J]. 中国肿瘤, 2018, 27: 768-773. DOI:10.11735/j.issn.1004-0242.2018.10.A006 |
| [3] |
徐斌, 张梅香, 章建全. 超声引导下甲状腺良性结节经皮热消融的临床研究[J]. 第二军医大学学报, 2011, 32: 1189-1192. XU B, ZHANG M X, ZHANG J Q. Ultrasoundguided percutaneous thermal ablation of benign thyroid nodules: a clinical study[J]. Acad J Sec Mil Med Univ, 2011, 32: 1189-1192. |
| [4] |
曲明, 尹惠生, 杨强, 沈英俊, 齐秀艳, 崔蓬, 等. 超声引导下微波消融治疗甲状腺良性结节[J]. 实用医药杂志, 2015, 32: 502-507. |
| [5] |
刁宗平, 章建全, 盛建国, 赵璐璐, 张航. 超声弹性成像在甲状腺良性结节射频消融中的应用价值及相关动态分析[J]. 第二军医大学学报, 2017, 38: 947-950. DIAO Z P, ZHANG J Q, SHENG J G, ZHAO L L, ZHANG H. Application value of ultrasound elastography in treatment of benign thyroid nodules with radiofrequency ablation and correlative dynamic analysis[J]. Acad J Sec Mil Med Univ, 2017, 38: 947-950. |
| [6] |
章建全, 闫磊, 陈红琼, 吴震中. 微波消融致甲状腺结节细胞活性的快速变化分析[J]. 中华医学杂志, 2018, 98: 3524-3527. DOI:10.3760/cma.j.issn.0376-2491.2018.43.012 |
| [7] |
AHMED M, SOLBIATI L, BRACE C L, BREEN D J, CALLSTROM M R, CHARBONEAU J W, et al. Imageguided tumor ablation: standardization of terminology and reporting criteria—a 10-year update[J]. Radiology, 2014, 273: 241-260. DOI:10.1148/radiol.14132958 |
| [8] |
章建全, 马娜, 徐斌, 刘灿, 宋家琳, 刁宗平. 超声引导监测下经皮射频消融甲状腺腺瘤的方法学研究[J]. 中华超声影像学杂志, 2010, 19: 861-865. |
| [9] |
王淑荣, 章建全, 徐庆玲, 于守君, 张永林, 王锡菊, 等. 甲状腺结节性病变经皮热消融治疗的近期疗效评价[J]. 第二军医大学学报, 2011, 32: 1316-1320. WANG S R, ZHANG J Q, XU Q L, YU S J, ZHANG Y L, WANG X J, et al. Percutaneous thermal ablation for nodular thyroid diseases: an assessment of short-term effects[J]. Acad J Sec Mil Med Univ, 2011, 32: 1316-1320. |
| [10] |
章建全, 刁宗平, 卢峰, 盛建国, 何金. 离体猪肝微波消融灶的弹性变化及其病理意义[J]. 中华超声影像学杂志, 2011, 20: 76-79. |
| [11] |
闫磊, 章建全, 曹昆昆, 吴震中, 盛建国, 张航. 微波消融改善甲状腺结节粗针穿刺活检的过程与结果[J]. 第二军医大学学报, 2017, 38: 1250-1255. YAN L, ZHANG J Q, CAO K K, WU Z Z, SHENG J G, ZHANG H. Microwave ablation improves the process and outcome of core needle biopsy in thyroid nodules[J]. Acad J Sec Mil Med Univ, 2017, 38: 1250-1255. |
| [12] |
FENG B, LIANG P, CHENG Z, YU X, YU J, HAN Z, et al. Ultrasound-guided percutaneous microwave ablation of benign thyroid nodules: experimental and clinical studies[J]. Eur J Endocrinol, 2012, 166: 1031-1037. DOI:10.1530/EJE-11-0966 |
| [13] |
YUE W W, WANG S R, WANG B, XU Q L, YU S J, ZHANG Y L, et al. Ultrasound guided percutaneous microwave ablation of benign thyroid nodules: safety and imaging follow-up in 222 patients[J/OL]. Eur J Radiol, 2013, 82: e11-e16. DOI: 10.1016/j.ejrad.2012.07.020.
|
| [14] |
LIANG P, DONG B, YU X, YU D, CHENG Z, SU L, et al. Computer-aided dynamic simulation of microwaveinduced thermal distribution in coagulation of liver cancer[J]. IEEE Trans Biomed Eng, 2001, 48: 821-829. |
| [15] |
章建全, 刁宗平, 卢峰, 盛建国. 离体猪肝微波消融区的弹性梯度与温度梯度研究[J]. 中华超声影像学杂志, 2012, 21: 799-802. |
 2022, Vol. 43
2022, Vol. 43


