2. 兰州大学第一医院生殖中心,兰州 730000
2. Reproductive Medicine Center, The First Hospital of Lanzhou University, Lanzhou 730000, Gansu, China
不孕症是一种生殖能力受损的状态,2018年的流行病学调查显示,我国不孕症患者占比已由20年前的约3%上升至12.5%~25%[1]。目前全球不孕症患者总人数已超过5 000万,且呈逐年上升趋势[2]。导致不孕症的因素很多,其中女性因素不孕占总数的50%~60%[3],常见的女性因素包括输卵管因素、排卵障碍、子宫内膜异位症、免疫因素及不明原因不孕等[4]。输卵管因素性不孕约占不孕症人群的40%[5]。多囊卵巢综合征(polycystic ovary syndrome,PCOS)是青春期与育龄期女性最常见的生殖内分泌疾病之一,全球育龄期女性PCOS患病率为5%~20%[6],我国PCOS患病率约为5.6%[7],其也是导致育龄期排卵障碍性不孕的重要原因之一。
研究表明,肠道微生态失衡不仅可致消化系统疾病、自身免疫病、肥胖、代谢综合征等[8],亦可直接或间接作用于下丘脑-垂体-卵巢轴,对女性生殖健康发挥着重要的调节作用[9]。肠道菌群可通过诱导患者的体内慢性炎症、增加胰岛素抵抗及高雄激素血症而影响生育能力。输卵管功能障碍多继发于盆腔炎性疾病,肠道菌群失调可改变盆腔环境,导致炎症的发生,从而引起输卵管功能障碍[10]。本研究采用16S rRNA高通量基因测序技术检测PCOS和输卵管阻塞不孕症患者的肠道菌群结构特征,以期寻找到特征性致病菌,为进一步探讨女性不孕症的发病机制及以肠道菌群为靶点进行的药物设计提供依据。
1 资料和方法 1.1 研究对象选择2020年9月至12月于兰州大学第一医院生殖中心就诊且符合纳入标准的30例不孕症患者为研究对象,分为PCOS不孕组(n=20)和输卵管阻塞不孕组(n=10),选择同期于兰州大学第一医院行备孕检查的健康育龄期女性作为健康对照组(n=10)。纳入标准:(1)PCOS不孕症参考2003年鹿特丹专家会议上推荐的诊断标准[11],即符合以下3条标准中任意2条:①稀发排卵和/或无排卵;②有雄激素过多症的临床和/或生物化学证据;③超声检查提示卵巢多囊样表现(一侧或双侧卵巢直径为2~9 mm的卵泡数≥12个和/或卵巢体积≥10 mL)。(2)输卵管阻塞不孕症患者有X线子宫输卵管造影输卵管阻塞表现,即推注造影剂时阻力极大,输卵管全程或部分不显影,盆腔内未见造影剂弥散,20 min后通过延迟片观察到显影部分管腔内有造影剂残留,盆腔无造影剂弥散。(3)研究对象在其居住地生活不少于5年。排除标准:(1)患有消化系统急、慢性疾病或有过胃肠道手术史。(2)近3个月使用过降糖调脂药物、微生态制剂或服用过抗生素或激素类药物持续3 d及以上。(3)患有严重精神障碍或智力低下等无法沟通。(4)合并其他系统器质性病变或肿瘤。本研究通过兰州大学第一医院伦理委员会审批(LDYYLL2019-17),所有研究对象均充分知情、自愿参与本研究,并签署知情同意书。
1.2 一般临床参数的收集与处理收集各研究对象的一般临床资料,包括年龄、身高、体重、腰围及臀围。计算BMI和腰臀比,BMI=体重(kg)/[身高(m)]2,腰臀比=腰围(cm)/臀围(cm)。
1.3 标本的采集与处理晨间采集各研究对象的新鲜中段粪便标本约5 g,迅速放入粪便收集盒中并立即密封,编号后在2 h内置于实验室-80 ℃冰箱内保存。月经第2天晨起空腹采集静脉血,检测以下指标:(1)激素指标,包括雌二醇、睾酮、黄体生成素(luteinizing hormone,LH)、卵泡刺激素(follicle-stimulating hormone,FSH);(2)脂代谢指标,包括总胆固醇、甘油三酯、低密度脂蛋白(low density lipoprotein,LDL)和高密度脂蛋白(high density lipoprotein,HDL);(3)糖代谢指标,包括空腹胰岛素、空腹血糖,并计算稳态模型胰岛素抵抗指数(homeostasis model assessment of insulin resistance,HOMA-IR),HOMA-IR=空腹血糖×空腹胰岛素/22.5。
1.4 肠道菌群16S rRNA基因测序(1)微生物基因组DNA的提取:使用基因组DNA提取试剂盒(货号DP712,北京天根生化科技有限公司)提取粪便标本DNA。(2)微生物菌群细菌16S RNA V3~V4片段扩增:使用338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GACTACHVGGGTWTCTAAT-3')引物(货号M0531S,美国New England Biolabs公司)对基因V3~V4可变区进行PCR扩增,获取PCR产物。(3)将相同体积的载体液(含SYB green)与PCR产物混合,采用2%琼脂糖凝胶电泳检测,使用胶回收试剂盒(货号DP214,美国Qiagen公司)对产物进行纯化回收。(4)数据库建立:使用TruSeq DNA PCR建库试剂盒(货号20015962,美国Illumina公司)构建Silva数据库。(5)高通量测序:高通量测序工作由天津诺禾致源科技有限公司采用Illumina NovaSeq 6000测序平台完成。
1.5 统计学处理应用SPSS 24.0软件进行统计学分析。呈正态分布的计量资料以x±s表示,3组间比较采用方差分析;呈偏态分布的计量资料以中位数(下四分位数,上四分位数)表示,3组间比较采用Kruskal-Wallis检验;两两比较采用Bonferroni校正检验。于NovoMagic云平台使用Qiime 1.7.0软件进行α多样性指数分析,组间群落结构差异性检验采用相似性分析(analysis of similarities,ANOSIM)方法,PCOS不孕组与输卵管阻塞不孕组人群肠道菌群与临床参数的相关性分析采用Spearman秩相关分析。检验水准(α)为0.05。
2 结果 2.1 一般资料比较共纳入研究对象40例,其中PCOS不孕组20例、输卵管阻塞不孕组10例、健康对照组10例,3组年龄、身高、臀围相比差异均无统计学意义(P均>0.05)。与健康对照组相比,PCOS不孕组体重、BMI、腰围、腰臀比、睾酮、LH、LH/FSH、空腹胰岛素、HOMA-IR、总胆固醇、甘油三酯、LDL均升高,而雌二醇、FSH、HDL均降低,差异均有统计学意义(P均<0.05)。与输卵管阻塞不孕组相比,PCOS不孕组体重、BMI、腰围、睾酮、LH、LH/FSH、空腹血糖、HOMA-IR、总胆固醇、甘油三酯均升高(P均<0.05)。见表 1。
|
|
表 1 3组研究对象一般资料及临床参数比较 Tab 1 Comparison of general data and clinical parameters among 3 groups |
2.2 肠道菌群特征分析
3组共获得操作分类单元(operational taxonomic unit,OTU)1 436个,其中PCOS不孕组特有OTU 316个、输卵管阻塞不孕组特有OTU 268个、健康对照组特有OTU 86个,PCOS不孕组分别与输卵管阻塞不孕组、健康对照组共有OTU 82个和56个,输卵管阻塞不孕组与健康对照组共有OTU 140个,3组共有的OTU 488个。α多样性分析显示,3组Observed-species指数、Shannon指数、Chao1指数差异均无统计学意义(P均>0.05,表 2)。基于OTU水平的稀释曲线趋于平稳,表明本次测序深度合理。
|
|
表 2 3组研究对象肠道菌群α多样性指数 Tab 2 Alpha diversity index of intestinal flora in 3 groups |
2.3 组间肠道菌群差异分析
基于OTU相对丰度表,组间群落结构差异性ANOSIM结果(图 1)显示3组组内差异小于组间差异,分组有统计学意义(r=0.220 4,P=0.015)。

|
图 1 3组研究对象肠道菌群组间群落结构差异性检验 Fig 1 Difference test in community structure of intestinal flora in 3 groups B: Between 3 groups; P: PCOS infertility group (n=20); H: Healthy control group (n=10); T: Tubal obstruction infertility group (n=10). PCOS: Polycystic ovary syndrome; OTU: Operational taxonomic unit. |
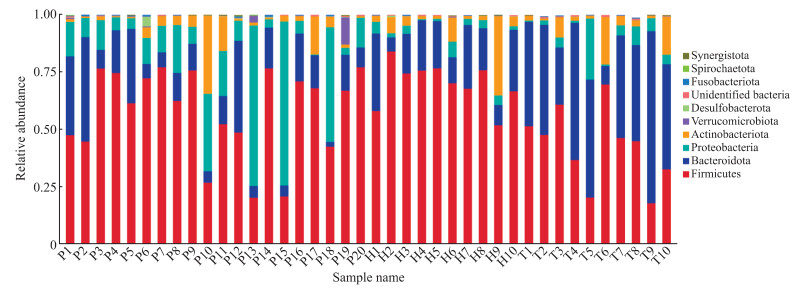
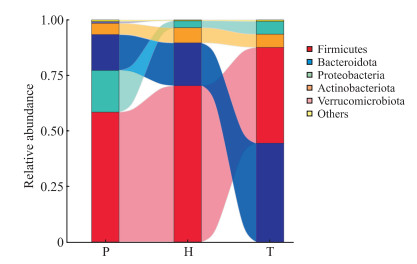
选取贡献率最大的物种,根据布雷柯蒂斯距离(Bray-Curtis distance)进行主坐标分析(principal coordinate analysis,PCoA),可见3组组内存在相似性(图 2)。根据物种注释结果,采用最大值排序法,在门水平选取各组总相对丰度排前10位的物种生成物种相对丰度柱形图(图 3),同法选取各组总相对丰度排前5位的物种生成桑葚图(图 4)。通过分析,各样本间主要优势菌群为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)、变形菌门(Proteobacteria)、放线菌门(Actinobacteriota),占总菌群的90%以上。与健康对照组相比,PCOS不孕组和输卵管阻塞不孕组厚壁菌门相对丰度均降低(P均<0.05),PCOS不孕组拟杆菌门、变形菌门相对丰度均升高(P均<0.05);与输卵管阻塞不孕组相比,PCOS不孕组厚壁菌门相对丰度降低、变形菌门相对丰度升高(P均<0.05,表 3)。

|
图 2 3组研究对象基于布雷柯蒂斯距离的PCoA图 Fig 2 PCoA mapping based on Bray-Curtis distance in 3 groups X and Y axes have no practical significance. P: PCOS infertility group (n=20); H: Healthy control group (n=10); T: Tubal obstruction infertility group (n=10). PCoA: Principal coordinate analysis; PC: Principal component; PCOS: Polycystic ovary syndrome. |
|
图 3 3组研究对象肠道菌群门水平相对丰度柱形图 Fig 3 Bar chart of relative abundance of intestinal flora at phylum level in 3 groups P: PCOS infertility group (n=20); H: Healthy control group (n=10); T: Tubal obstruction infertility group (n=10). PCOS: Polycystic ovary syndrome. |
|
图 4 3组研究对象肠道菌群门水平桑葚图 Fig 4 Sankey diagram of intestinal flora at phylum level in 3 groups P: PCOS infertility group (n=20); H: Healthy control group (n=10); T: Tubal obstruction infertility group (n=10). PCOS: Polycystic ovary syndrome. |
|
|
表 3 3组研究对象肠道菌群相对丰度比较 Tab 3 Comparison of relative abundance of intestinal flora in 3 groups |
2.4 肠道菌群与临床检验参数的Spearman相关分析
在PCOS不孕组,厚壁菌门与FSH呈正相关(r=0.482 7,P=0.031 1),与总胆固醇呈负相关(r=-0.637 0,P=0.002 5);拟杆菌门、变形菌门与总胆固醇呈正相关(r=0.494 6、0.518 2,P=0.043 4、0.019 2);放线菌门与总胆固醇、HOMA-IR呈正相关(r=0.544 6、0.503 0,P=0.013 0、0.023 8);脱硫杆菌门与空腹血糖呈负相关(r=-0.473 8,P=0.034 8);梭杆菌门与HOMA-IR呈负相关(r=-0.472 6,P=0.035 3)。在输卵管阻塞不孕组,弯曲菌门与HOMA-IR呈负相关(r=-0.226 4,P=0.029 5),与LH/FSH呈正相关(r=0.162 5,P=0.034 3);未分类菌门与甘油三酯呈正相关(r=0.251 3,P=0.009 2),与腰臀比呈负相关(r=-0.204 4,P=0.037 5);厚壁菌门与雌二醇呈正相关(r=0.358 8,P=0.047 9)。
3 讨论WHO预测不孕不育症将成为人类21世纪仅次于肿瘤和心血管的第三大疾病,并且在2015年将生殖健康纳入全球公共卫生问题[12]。随着社会经济的发展、人类生活方式的转变、环境污染的加剧,人类低生育力问题日益突出。人类生育力的降低不仅仅是简单的生殖健康问题,而且会带来各种社会、经济和家庭问题,研究显示全球每年约有1/3的不孕女性遭受到家庭暴力[13]。不孕症夫妇可寻求辅助生殖技术助孕,但治疗过程复杂、疗程漫长、费用昂贵,进一步增加了不孕症患者的心理和经济负担。因此寻找到不孕症患者的病因及发病机制是生殖科医师的工作重点。
肠道菌群是定植于人类消化道的所有微生物的总称,其种类繁多,数目庞大,功能复杂,据不完全统计肠道菌群种类超过5 000种,总数达100万亿个,是人体细胞数量的数10倍,约含330万个全基因组,被誉为“人体的第二基因组”[14-15]。随着二代基因测序技术的发展及应用,人们对肠道微生物有了更深入的认知,大量研究佐证了肠道菌群结构失调可通过人体神经内分泌、代谢免疫等多种途径促进疾病的发生与发展。PCOS是育龄期女性最常见的生殖内分泌疾病,占无排卵性不孕的80%[16]。文献报道PCOS患者与健康人群的肠道菌群结构存在明显差异,Torres等[17]研究发现卵巢多囊样改变的人群相较于健康人群肠道菌群多样性降低。Kelley等[18]在PCOS小鼠模型中的研究表明,小鼠肠道微生物细菌种类和丰度明显减少。本研究同样证实PCOS不孕症患者肠道菌群与健康对照组存在差异,主要表现为菌群数目增多,但多样性降低,菌群组成比例改变,具体表现在厚壁菌门、放线菌门相对丰度降低,拟杆菌门、变形菌门相对丰度升高。肠道菌群结构紊乱可损害肠道黏膜的完整性,使肠道屏障功能减退,引发全身慢性低度炎症,进而导致内分泌、代谢紊乱,加重PCOS患者的高雄激素血症、胰岛素抵抗、肥胖等临床症状。
既往研究证实肠道菌群失调将引起盆腔输卵管炎性疾病,导致输卵管形态改变、粘连、阻塞及其管腔蠕动、拾卵、定向运送受精卵至宫腔的功能障碍或丧失,从而引起输卵管性不孕[19]。本研究结果表明,输卵管阻塞性不孕的女性肠道菌群结构与健康对照组相比存在差异,表现为厚壁菌门、放线菌门相对丰度略有降低,拟杆菌门、变形菌门相对丰度略有升高,其中仅厚壁菌门相对丰度在两组间比较差异有统计学意义(P<0.05)。这可能与单地区、样本量较小有关,需要多地区、大样本研究进一步验证。
研究表明,在PCOS患者中肠道菌群拟杆菌门丰度升高与睾酮、BMI、炎症因子等呈正相关[20]。另有研究表明拟杆菌门与HOMA-IR、LH、LH/FSH、BMI、睾酮等呈正相关[21]。本研究结果也提示,PCOS不孕组患者肠道菌群与FSH、总胆固醇、HOMA-IR、雌二醇、空腹血糖相关,输卵管阻塞不孕组患者肠道菌群与HOMA-IR、空腹血糖、空腹胰岛素、LH/FSH、甘油三酯、腰臀比、雌二醇相关。肠道菌群结构处于稳态,产生的多种代谢产物如丁酸、丙酸、多糖等可保护肠道黏膜屏障,增加短链脂肪酸含量、促进结肠运动、调节炎症细胞的分化,辅助控制肠道炎症的发生与发展[22]。肠道微生态失调可使上述机制紊乱,激活宿主免疫系统,诱发输卵管慢性炎症,使长期处于慢性炎症状态的输卵管形态及功能受损,从而影响受孕。本研究结果提示,与健康育龄期女性相比,PCOS不孕与输卵管阻塞不孕患者的肠道菌群存在明显紊乱,这可能引起体内代谢产物的变化,促进全身糖脂代谢紊乱、内分泌紊乱和肠道、全身慢性炎症发生,进而导致女性生殖内分泌疾病,最终导致不孕。
目前肠道菌群失调与PCOS发病机制的相关性研究较多,但未得出统一结论,而且肠道菌群与输卵管功能障碍性不孕的相关性尚无研究涉及,地域、饮食、民族、文化等差异对肠道菌群结构组成的影响是相关研究开展较显著的干扰因素。尽管本研究中稀释曲线表明数据足够,结论也与既往相关研究一致,但样本量较小、局限于一个地区的研究结论可能不具有普遍性,这也是本研究的不足之处。2012年,美国国立卫生研究院诊断标准将成人PCOS分为4个亚型,且PCOS人群中有50%~70%存在胰岛素抵抗,而本研究未按表型、BMI、是否存在胰岛素抵抗等进行PCOS分类,也未将是否有盆腔侵入性操作史、将输卵管功能障碍患者分类,是本研究的另一个不足之处。开展大样本量、多地域联合研究及对研究对象进行更为精准的分类、分组是后续研究的方向。
尽管目前对PCOS不孕症患者肠道菌群结构改变无统一共识,但大量研究已证实PCOS患者的肠道菌群改变可促进体内慢性炎症的发生,使脂质、内分泌、能量代谢紊乱。开展更深层次的研究更为全面、系统地分析肠道菌与PCOS不孕症发病机制的关系及规律,找到特异菌群并以此为靶点进行药物设计以治疗PCOS十分迫切。输卵管功能障碍与肠道菌群相关性研究相对较少,后续研究将进行补充。
| [1] |
ZHOU Z, ZHENG D, WU H, LI R, XU S, KANG Y, et al. Epidemiology of infertility in China: a population-based study[J]. BJOG, 2018, 125: 432-441. DOI:10.1111/1471-0528.14966 |
| [2] |
MASCARENHAS M N, FLAXMAN S R, BOERMA T, VANDERPOEL S, STEVENS G A. National, regional, and global trends in infertility prevalence since 1990: a systematic analysis of 277 health surveys[J/OL]. PLoS Med, 2012, 9: e1001356. DOI: 10.1371/journal.pmed.1001356.
|
| [3] |
THOMA M E, MCLAIN A C, LOUIS J F, KING R B, TRUMBLE A C, SUNDARAM R, et al. Prevalence of infertility in the United States as estimated by the current duration approach and a traditional constructed approach[J/OL]. Fertil Steril, 2013, 99: 1324-1331. e1. DOI: 10.1016/j.fertnstert.2012.11.037.
|
| [4] |
钟群. 不孕症患者病因调查分析[D]. 长沙: 中南大学, 2007.
|
| [5] |
GRASPEUNTNER S, BOHLMANN M K, GILLMANN K, SPEER R, KUENZEL S, MARK H, et al. Microbiota-based analysis reveals specific bacterial traits and a novel strategy for the diagnosis of infectious infertility[J/OL]. PLoS One, 2018, 13: e0191047. DOI: 10.1371/journal.pone.0191047.
|
| [6] |
CHU W, HAN Q, XU J, WANG J, SUN Y, LI W, et al. Metagenomic analysis identified microbiome alterations and pathological association between intestinal microbiota and polycystic ovary syndrome[J/OL]. Fertil Steril, 2020, 113: 1286-1298. e4. DOI: 10.1016/j.fertnstert.2020.01.027.
|
| [7] |
LI R, ZHANG Q F, YANG D Z, LI S W, LU S L, WU X K, et al. Prevalence of polycystic ovary syndrome in women in China: a large community-based study[J]. Hum Reprod, 2013, 28: 2562-2569. DOI:10.1093/humrep/det262 |
| [8] |
SONNENBURG J L, BÄCKHED F. Diet-microbiota interactions as moderators of human metabolism[J]. Nature, 2016, 535: 56-64. DOI:10.1038/nature18846 |
| [9] |
LIU R, ZHANG C, SHI Y, ZHANG F, LI L, WANG X, et al. Dysbiosis of gut microbiota associated with clinical parameters in polycystic ovary syndrome[J/OL]. Front Microbiol, 2017, 8: 324. DOI: 10.3389/fmicb.2017.00324.
|
| [10] |
FLORES R, SHI J X, FUHRMAN B, XU X, VEENSTRA T D, GAIL M H, et al. Fecal microbial determinants of fecal and systemic estrogens and estrogen metabolites: a cross-sectional study[J/OL]. J Transl Med, 2012, 10: 253. DOI: 10.1186/1479-5876-10-253.
|
| [11] |
Rotterdam ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome[J]. Fertil Steril, 2004, 81: 19-25. |
| [12] |
朱彤宇, 李军. 不孕症患者的心理因素分析及其心理干预的研究进展[J]. 实用医药杂志, 2014, 31: 459-460. |
| [13] |
WANG Y Y, FU Y, GHAZI P, GAO Q, TIAN T, KONG F, et al. Prevalence of intimate partner violence against infertile women in low-income and middle-income countries: a systematic review and meta-analysis[J/OL]. Lancet Glob Health, 2022, 10: e820-e830. DOI: 10.1016/S2214-109X(22)00098-5.
|
| [14] |
HAGAN T, CORTESE M, ROUPHAEL N, BOUDREAU C, LINDE C, MADDUR M S, et al. Antibiotics-driven gut microbiome perturbation alters immunity to vaccines in humans[J/OL]. Cell, 2019, 178: 1313-1328. e13. DOI: 10.1016/j.cell.2019.08.010.
|
| [15] |
高惠民, 张婷婷, 刘瑞霞, 李天鹤, 阴赪宏. 肠道菌群和胆汁酸的相互作用与多囊卵巢综合征[J]. 生殖医学杂志, 2022, 31: 1617-1621. DOI:10.3969/j.issn.1004-3845.2022.11.025 |
| [16] |
STEEGERS-THEUNISSEN R P M, WIEGEL R E, JANSEN P W, LAVEN J S E, SINCLAIR K D. Polycystic ovary syndrome: a brain disorder characterized by eating problems originating during puberty and adolescence[J/OL]. Int J Mol Sci, 2020, 21: 8211. DOI: 10.3390/ijms21218211.
|
| [17] |
TORRES P J, SIAKOWSKA M, BANASZEWSKA B, PAWELCZYK L, DULEBA A J, KELLEY S T, et al. Gut microbial diversity in women with polycystic ovary syndrome correlates with hyperandrogenism[J]. J Clin Endocrinol Metab, 2018, 103: 1502-1511. DOI:10.1210/jc.2017-02153 |
| [18] |
KELLEY S T, SKARRA D V, RIVERA A J, THACKRAY V G. The gut microbiome is altered in a letrozole-induced mouse model of polycystic ovary syndrome[J/OL]. PLoS One, 2016, 11: e0146509. DOI: 10.1371/journal.pone.0146509.
|
| [19] |
Т.Ю.别斯特利科娃, И.В.尤拉索夫, Е.А.尤拉索娃, 刘岩. 肠道微生物菌群致盆腔炎性疾病及抗生素的敏感性研究[J]. 哈尔滨医科大学学报, 2013, 47: 561-562. |
| [20] |
乔杰, 齐新宇, 徐雅兰, 庞艳莉. 关注影响女性健康的重要生殖内分泌疾病多囊卵巢综合征[J]. 中国实用妇科与产科杂志, 2020, 36: 1-9. |
| [21] |
苑广慧, 郝翠芳, 李宁. 多囊卵巢综合征伴胰岛素抵抗患者肠道菌群分析[J]. 生殖医学杂志, 2021, 30: 354-361. DOI:10.3969/j.issn.1004-3845.2021.03.013 |
| [22] |
刘苗苗, 毕冉冉, 孙玉敬. 果蔬与肠道菌群互作及其健康功效研究进展[J]. 中国食品学报, 2022, 22: 387-407. |
 2022, Vol. 43
2022, Vol. 43


