2. 上海太平康复医院重症康复病区,上海 201315;
3. 上海中医药大学附属龙华医院重症医学科,上海 200032
2. Intensive Rehabilitation Ward, Shanghai Taiping Rehabilitation Hospital, Shanghai 201315, China;
3. Department of Critical Care Medicine, Longhua Hospital Affiliated to Shanghai University of Traditional Chinese Medicine, Shanghai 200032, China
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是以各种肺内外致病因素导致的急性弥漫性肺损伤和顽固性低氧血症为特征的临床综合征。截至目前,虽然已有众多关于ARDS发病机制的解释,但普遍认为ARDS是机体炎症反应紊乱的结果。研究表明,病原体入侵导致的炎症反应和肺部中性粒细胞异常且持续性活化可能与ARDS患者肺组织损伤有关[1-2]。在ARDS进展中,肺部会呈现出局部缺氧环境,低氧会提高中性粒细胞的存活效率,导致其数量增加,而中性粒细胞又会加剧炎症因子释放和炎症介质形成,因此中性粒细胞活化可能与ARDS患者肺部损伤的严重程度有正向关联[3-4]。IL-4及其受体α(interleukin 4 receptor α,IL-4Rα)组成的炎症因子抑制调控通路长期以来一直被认为是中性粒细胞炎性活化的重要途径。研究表明,在脂多糖诱导的体外炎症模型细胞及其他在体炎症模型组织中,IL-4与IL-4Rα表达均明显下调[5]。Harris等[6]发现在ARDS模型小鼠肺部,IL-4/IL-4Rα通路呈现明显的失活特征,应用通路抑制剂能够明显促进肺部中性粒细胞增殖、加重肺组织炎症损伤程度。因此,IL-4/IL-4Rα通路活化或能以中性粒细胞依赖的方式改善ARDS患者的肺部炎症损伤。
补阳还五汤源自清代著名医家王清任所著的《医林改错》,是我国传统中医药常用方剂,具有益气养血、活血通络的基础功效,常被应用于缺血性脑损伤、血管损伤及神经损伤的治疗[7]。研究表明,补阳还五汤能够改善微循环,改善血液流变学、动力学,并具有抗炎、抗氧化及调节免疫的效果[8]。中药发挥抗炎和调节免疫的功能与抑制炎症细胞活化密切相关。然而目前未见有关补阳还五汤改善ARDS患者肺部炎症损伤的报道。本研究探讨了补阳还五汤是否具有改善ARDS患者肺部损伤的作用,并分析其作用途径是否与肺部中性粒细胞活化调控有关。
1 材料和方法 1.1 试剂与仪器慢病毒包装细胞系293T(货号GNHu17)购于中国科学院典型培养物保藏委员会细胞库;DMEM高糖培养基(货号12430062)、RPMI 1640培养基(货号11875119)、FBS(货号10099141C)、0.25%胰蛋白酶(货号25200072)、无菌PBS(货号14175145)、Lipofectamine 3000转染试剂(货号L3000001)、RNA提取试剂TRIzol(货号15596026)、M-MLV反转录试剂盒(货号28025013)、TNFα ELISA试剂盒(货号KHC3013)、IL-1β ELISA试剂盒(货号BMS224-2)、IL-4 ELISA试剂盒(货号KAC1281)、IL-6 ELISA试剂盒(货号KAC1261)均购于美国ThermoFisher Scientific公司;荧光定量试剂盒(货号RR420A)购于宝生物工程(大连)有限公司;CCK-8细胞活性检测试剂盒(货号CK-04)购于日本同仁化学研究所;无内毒素质粒DNA制备试剂盒(货号12362)购于德国Qiagen公司;细胞凋亡检测试剂盒(货号559763)购于美国BD公司;慢病毒载体、包装及滴度测定试剂盒(货号CD511B-1、LV500A-1、LV960A-1)均购于美国Systembio公司;蛋白质初级抗体和二抗均购于英国Abcam公司;M-PER细胞总蛋白质提取定量试剂盒及ECL化学底物发光试剂盒均购于美国Pierce公司;中性粒细胞分离液(货号JH0050)购于北京百奥莱博科技有限公司;低温高速离心机购于美国Beckman公司;TP600型荧光定量检测仪购于日本TaKaRa公司;电泳仪、转膜仪均购于上海天能科技有限公司;酶标仪购于美国ThermoFisher Scientific公司;FACSCalibur型流式细胞仪购于美国BD公司。引物由生工生物工程(上海)股份有限公司合成。
1.2 ARDS患者支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)获取选择2020年10月至2021年10月于上海中医药大学附属龙华医院ICU就诊的符合中医气虚血瘀证的ARDS患者20例。纳入标准:(1)符合西医及中医ARDS诊断标准;(2)年龄为18~85岁;(3)患者或其法定代理人、监护人同意并签署知情同意书。排除标准:(1)合并恶性肿瘤者;(2)合并重要脏器严重疾病者;(3)妊娠或哺乳期妇女;(4)不能配合完成治疗者。西医ARDS诊断标准:参考柏林定义(2012年)[9]制定。(1)在已知诱因,或新出现或原有呼吸系统症状加重后1周内发病;(2)影像学检查显示双肺透光度减低,且不能完全用胸腔积液、肺不张或肺结节解释;(3)出现无法用心功能衰竭或液体负荷过多解释的呼吸衰竭;(4)氧合指数<300 mmHg(1 mmHg=0.133 kPa),且呼气末正压或持续气道正压≥5 cmH2O(1 cmH2O=98 Pa)。中医ARDS气虚血瘀证辨证标准:参考《中医内科学》(第九版)[10]制定。主症:喘促短气,张口抬肩,鼻翼翕动,稍动则咳喘欲绝,胸闷心悸,烦躁不安或神志恍惚、淡漠。次症:(1)面青唇紫,身倦乏力;(2)舌淡暗或有紫斑;(3)脉细弱或沉涩。确诊需具备主症和至少2项次症,并由临床经验丰富的中医主治及以上职称医师辨证确认。本研究通过上海中医药大学附属龙华医院医学伦理委员会审批及备案(2020LCSY065)。
将符合纳入标准的12例ARDS患者随机分为常规治疗组和补阳还五汤治疗组,各6例。常规治疗组患者予西医常规治疗(呼吸机辅助呼吸、液体管理、抗感染、营养支持治疗等)。补阳还五汤治疗组患者在西医常规治疗的基础上加用补阳还五汤,方药组成如下:生黄芪60 g,当归尾12 g,赤芍12 g,川芎12 g,桃仁12 g,红花12 g,地龙9 g;每日1剂,浓煎取100 mL顿服;疗程为1周。
治疗1周后对患者进行BALF采样。采样前先对患者进行局部麻醉和支气管镜检查,将电子支气管镜插入右肺中叶,顶端楔入支气管分支开口,经气管活检孔快速注入37 ℃灭菌生理盐水,每次25 mL,总量100 mL,每次注液后以80 mmHg负压吸出,收集于用硅油处理过的容器中,记录回收液量,回收率保持在30%~40%,初步收集后,若不足40 mL则使用室温无菌PBS统一补至40 mL。使用200目筛网过滤后,将每个样本分为两部分,其中30 mL用于中性粒细胞制备,10 mL用于炎症因子含量检测。
1.3 BALF来源中性粒细胞的分选与鉴定将30 mL新鲜BALF于室温5 000×g离心10 min,去上清,使用2 mL无菌PBS(pH=7.4)重悬沉淀。向悬液中加入2 mL中性粒细胞分离液,充分混匀后于4 ℃ 1 200×g离心10 min,溶液出现分层,用200 μL移液器小心吸取倒数第2层成分并转移至新的15 mL无菌离心管。向离心管中加入5 mL无菌PBS,4 ℃ 1 500×g离心10 min,收集沉淀。通过流式细胞术分析中性粒细胞纯度,目标细胞定义为CD15和CD11b双标阳性细胞群。提取细胞总蛋白,通过蛋白质印迹法检测IL-4Rα、低氧诱导因子1α(hypoxia-inducible factor 1α,HIF-1α)和caspase 3水解体的蛋白表达水平。
1.4 重组慢病毒制备选择与人IL-4Rα(U.S. National Center for Biotechnology Information,编号为NM_000418.4)基因编码区互补的siRNA(5'-GAATTGTCTTACCAAGCTC-3')序列,合成相应的短发夹RNA(short hairpin RNA,shRNA)寡核苷酸DNA,双链退火后克隆至shRNA表达载体pSIH1-H1构建重组载体pSIH1-shRNA-IL-4Rα。同时使用siRNA的无义序列(5'-AGGAT-CCTATCCAATTCTG-3')构建对照载体pSIH1-NC。载体经过序列分析后扩增转化菌株,然后进行无内毒素质粒DNA制备。将1×106个对数生长期的293T细胞接种于10 cm培养皿中,用含10% FBS的DMEM高糖培养基于37 ℃、5% CO2条件下过夜培养。将重组载体(pSIH1-shRNA-IL-4Rα或pSIH1-NC各2 μg)和10 μg重组慢病毒包装质粒混合物pPACK,用Lipofectamine 3000转染试剂共同转染至293T细胞。转染48 h后,收集上清液于4 ℃ 8 000×g离心10 min,收集上清经过0.45 µm孔径的一次性滤膜过滤后分装保存,重组慢病毒经梯度稀释法测定滴度后分别命名为Lv-shRNA-IL-4Rα和Lv-NC。将BALF来源的中性粒细胞接种于6孔细胞培养板,每孔1×106个,使用2 mL含10% FBS的RPMI 1640培养基,后按照病毒感染复数为20添加重组病毒液(Lv-shRNA-IL-4Rα或Lv-NC),同时设不加病毒的空白对照组。于37 ℃、5% CO2条件下培养72 h,通过检测GFP表达评价中性粒细胞的慢病毒感染效率,并收集细胞采用qPCR法分析IL-4Rα基因沉默效率。
1.5 补阳还五汤药物血清制备5只12周龄SD大鼠(雄性,体重180~190 g,清洁级)购于常州卡文斯实验动物有限公司[合格证号为202260568,实验动物生产许可证号为SCXK(苏)2021-0013],适应性饲养1周后用补阳还五汤以9 g/(kg·d)持续灌胃7 d。采血前大鼠禁食12 h,末次灌胃1 h后腹主动脉取血约3 mL,于4 000×g离心10 min;吸取最上层血清至2 mL无菌离心管,56 ℃恒温水浴30 min进行灭活处理,再用0.22 μm微孔滤器过滤除菌,-80 ℃保存待用。
1.6 补阳还五汤药物血清对BALF来源中性粒细胞的干预实验分组将BALF来源的中性粒细胞分为5组。(1)空白对照组:细胞不做任何处理。(2)脂多糖低氧诱导组:给予脂多糖及低氧诱导处理。(3)药物血清预处理组:同时给予补阳还五汤药物血清预处理和脂多糖及低氧诱导处理。(4)Lv-NC组:同时给予Lv-NC感染、补阳还五汤药物血清预处理和脂多糖及低氧诱导处理。(5)Lv-shRNA-IL-4Rα组:同时给予Lv-shRNA-IL-4Rα感染、补阳还五汤药物血清预处理和脂多糖及低氧诱导处理。ARDS体外细胞模型通过脂多糖诱导(质量浓度为10 μg/mL)及低氧(5% CO2、95% N2)培养48 h建立,补阳还五汤药物预处理则在脂多糖和低氧诱导前1 h通过向培养基加入体积分数为5%的药物血清完成,慢病毒感染在脂多糖及低氧诱导前72 h开始。经脂多糖和低氧诱导48 h后,收集细胞培养上清液和细胞用于实验。
1.7 炎症因子测定取ARDS患者BALF与各组细胞培养上清液分别于室温10 000×g离心10 min去除沉淀,然后通过ELISA检测BALF和细胞培养上清液中炎症因子TNFα、IL-1β、IL-4、IL-6的含量。检测过程和数据分析严格按照试剂盒说明书进行。
1.8 细胞增殖和凋亡检测各组细胞经脂多糖和低氧处理48 h后,采用苔酚蓝染色后经血小球计数板计数活细胞,用含10% FBS的RPMI 1640培养基调整细胞密度为1×105个/mL,接种到96孔细胞培养板,每孔100 μL细胞悬液,接种后在37 ℃和5% CO2条件下培养。对于细胞增殖实验,于细胞培养24、48及72 h时,每孔加入10 μL CCK-8试剂,置于37 ℃、5% CO2培养箱内继续培养4 h,用酶标仪测定波长450 nm处的光密度值。实验设3次生物学重复,每个样本设2个复孔。
对于细胞凋亡检测实验,于室温条件下3 000×g离心5 min收集每个处理组约1×106个细胞,严格按照细胞凋亡检测试剂盒说明书进行细胞染色及流式细胞术检测,并通过BD FACSuite软件分析细胞凋亡率。实验设置3次生物学重复。
1.9 qPCR检测IL-4Rα基因表达5 000×g离心5 min收集Lv-NC或Lv-shRNA-IL-4Rα感染后72 h和未经病毒感染的中性粒细胞各1×107个,每样本加入1 mL 4 ℃预冷的无菌PBS重悬细胞沉淀,之后再次1 000×g离心5 min收集细胞沉淀。去上清后,每孔加入1 mL 4 ℃预冷的TRIzol试剂,使用1 mL移液器反复吹打细胞,将裂解液转移至干净的1.5 mL无菌离心管,按照TRIzol试剂盒说明书提取细胞总RNA。采用琼脂糖凝胶电泳检测RNA条带完整性,采用紫外分光光度计检测RNA浓度,取1 μg RNA、使用通用型反转录引物进行反转录,获得cDNA。每个样本取2 μL cDNA作为模板,以β-肌动蛋白作为内参照,进行定量PCR扩增。IL-4Rα上游引物序列为5'-GCACCGA-GCTCCGCCTGTTGTA-3',下游引物序列为5'-AC-CCCGCGCCTCCGTTGTTCT-3';β-肌动蛋白上游引物序列为5'-CCTGTACGCCAACACAGTGC-3',下游引物序列为5'-ATACTCCTGCTTGCTGATCC-3'。PCR反应体系为20 μL:荧光定量试剂预混液10 μL,上下游引物(20 μmol/L)各0.2 μL,cDNA 2 μL,无菌水7.6 μL。PCR反应条件:95 ℃ 10 s,60 ℃ 20 s,72 ℃ 20 s,共40个循环。通过扩增曲线与阈值线的交点来计算每个样本的Ct值,目的基因相对于内参基因的表达量为2-ΔCt。
1.10 蛋白质印迹法检测蛋白表达离心收集各组细胞,经PBS洗涤2次后,向细胞沉淀中加入1 mL细胞M-PER裂解液,按照M-PER细胞总蛋白提取定量试剂盒说明书提取细胞总蛋白,采用BCA法检测总蛋白浓度。每个样本取11 μL进行10% SDS-PAGE,然后通过湿法转移至PVDF膜,用5%脱脂牛奶常温封闭2 h,加入TBST稀释后的IL-4Rα、HIF-1α、caspase 3水解体、caspase 3、β-肌动蛋白一抗(稀释比例分别为1∶500、1∶500、1∶500、1∶500、1∶1 000),4 ℃过夜,TBST洗膜3次;加入羊抗鼠二抗(稀释比例为1∶3 000)孵育2 h,TBST洗膜3次。添加ECL发光液反应底物后曝光,用TotalLab 1.10软件进行分析,目的蛋白相对表达量为目的条带光密度与内参照条带光密度的比值。
1.11 统计学处理应用SPSS 13.0软件进行统计学分析。数据以x±s表示,两组间比较采用独立样本t检验。检验水准(α)为0.05。
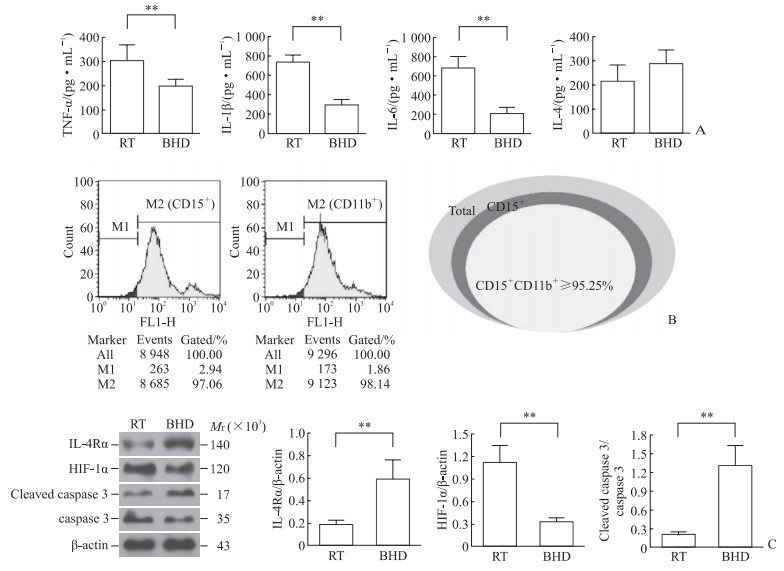
2 结果 2.1 补阳还五汤下调ARDS患者BALF中炎症因子含量、中性粒细胞中HIF-1α表达并上调中性粒细胞中IL-4Rα和caspase3水解体表达ELISA检测结果(图 1A)显示,与常规治疗组比较,经补阳还五汤治疗的ARDS患者BALF中炎症因子TNFα、IL-1β和IL-6含量均降低(P均<0.01),IL-4含量略有升高但差异无统计学意义(P>0.05)。流式细胞术检测结果(图 1B)显示,人BALF来源的中性粒细胞纯度≥95.25%。蛋白质印迹法检测结果(图 1C)显示,与常规治疗组比较,经补阳还五汤治疗的ARDS患者BALF来源中性粒细胞中IL-4Rα、caspase 3水解体蛋白表达水平均升高(P均<0.01),而HIF-1α蛋白表达水平下降(P<0.01)。
|
图 1 ARDS患者BALF中炎症因子含量、中性粒细胞纯度、中性粒细胞中IL-4Rα及其下游功能蛋白表达的检测 Fig 1 Detection of inflammatory factor content in BALF, purity identification of neutrophils and expression of IL-4Rα and its downstream functional proteins in neutrophils of ARDS patients A: The contents of inflammatory factors in BALF were detected by enzyme-linked immunosorbent assay; B: Purity identification of neutrophils from BALF by flow cytometry; C: Expression of IL-4Rα, HIF-1α and cleaved caspase 3 proteins in neutrophils was detected by Western blotting. **P < 0.01. n=3, x±s. M1: Negative peak; M2: Positive peak. ARDS: Acute respiratory distress syndrome; BALF: Bronchoalveolar lavage fluid; IL: Interleukin; IL-4Rα: Interleukin 4 receptor α; TNFα: Tumor necrosis factor α; HIF-1α: Hypoxia-inducible factor 1α; caspase: Cysteine aspartic acid specific protease; RT: Routine treament; BHD: Buyang Huanwu decoction. |
2.2 慢病毒感染有效沉默中性粒细胞IL-4Rα基因表达
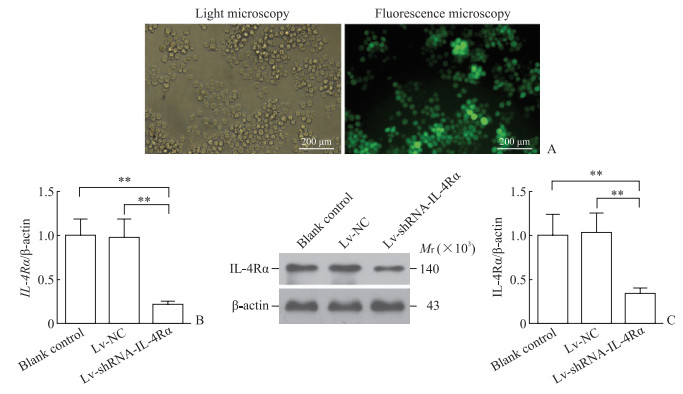
重组病毒持续感染中性粒细胞后72 h荧光标志物GFP表达检测结果显示中性粒细胞的慢病毒感染效率接近100%(图 2A)。qPCR检测结果(图 2B)显示,与空白对照组和Lv-NC组比较,Lv-shRNA-IL-4Rα组细胞中IL-4Rα mRNA表达量降低(P均<0.01),Lv-NC组细胞中IL-4Rα mRNA表达量与空白对照组相比无明显变化(P>0.05)。蛋白质印迹法检测结果(图 2C)显示,与空白对照组和Lv-NC组比较,Lv-shRNA-IL-4Rα组细胞中IL-4Rα蛋白表达降低(P均<0.01),Lv-NC组细胞中IL-4Rα蛋白表达与空白对照组相比无明显变化(P>0.05)。
|
图 2 中性粒细胞慢病毒感染效率及目的基因干预效率检测 Fig 2 Detection of infection efficiency of lentivirus and intervention efficiency of target gene in neutrophils A: Detection of lentivirus infection efficiency in neutrophils; B: The relative levels of IL-4Rα mRNA in neutrophils of each group 72 h after infection were detected by quantitative polymerase chain reaction; C: Expression of IL-4Rα protein in neutrophils of each group 72 h after infection was detected by Western blotting. **P < 0.01. n=3, x±s. Lv-NC: Lentivirus for siRNA-negative control; Lv-shRNA-IL-4Rα: Lentivirus for siRNA-IL-4Rα; IL-4Rα: Interleukin 4 receptor α; siRNA: Small interfering RNA; shRNA: Short hairpin RNA. |
2.3 补阳还五汤能够抑制ARDS患者BALF来源的中性粒细胞增殖、炎症因子分泌,并诱导细胞凋亡
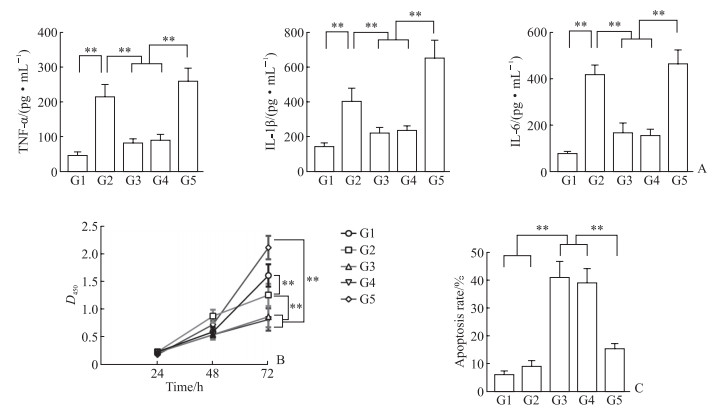
ELISA检测结果(图 3A)显示,与空白对照组比较,脂多糖和低氧诱导48h后BALF来源的中性粒细胞培养上清液中炎症因子TNFα、IL-1β和IL-6含量均增加(P均<0.01);补阳还五汤药物血清预处理能够抑制脂多糖和低氧诱导促进的炎症因子表达(P均<0.01);而IL-4Rα基因沉默能够逆转补阳还五汤药物血清的上述作用(P均<0.01)。CCK-8检测结果(图 3B)显示,在细胞培养48、72 h时,与空白对照组比较,脂多糖和低氧诱导条件下细胞增殖活性先增强后减弱,补阳还五汤药物血清预处理能够降低中性粒细胞的增殖活性,而IL-4Rα基因沉默能够逆转补阳还五汤药物血清的上述作用。流式细胞术检测结果(图 3C)显示,脂多糖和低氧诱导条件下中性粒细胞凋亡率与空白对照组相比差异无统计学意义(P>0.05),补阳还五汤药物血清预处理提高了细胞在脂多糖和低氧诱导条件下的凋亡率(P<0.01),而IL-4Rα基因沉默能够逆转补阳还五汤药物血清的上述作用(P均<0.01)。
|
图 3 不同处理条件下中性粒细胞炎症因子含量及细胞增殖、凋亡分析 Fig 3 Analysis of inflammatory factor content, proliferation and apoptosis in neutrophils of different treatment groups A: The contents of inflammatory factors in cell supernatant were detected by enzyme-linked immunosorbent assay; B: Cell proliferation activity was detected by cell counting kit 8; C: Apoptosis was detected by flow cytometry. **P < 0.01. n=3, x±s. G1: Blank control; G2: LPS+hypoxia; G3: Drug serum+LPS+hypoxia; G4: Lv-NC+drug serum+LPS+hypoxia; G5: Lv-shRNA-IL-4Rα+drug serum+LPS+hypoxia. LPS: Lipopolysaccharide; Lv-NC: Lentivirus for siRNA-negative control; Lv-shRNA-IL-4Rα: Lentivirus for siRNA-IL-4Rα; siRNA: Small interfering RNA; shRNA: Short hairpin RNA; IL-4Rα: Interleukin 4 receptor α; TNFα: Tumor necrosis factor α; IL: Interleukin. |
3 讨论
ARDS一般是由急性肺损伤快速进展导致的综合性肺损伤疾病,其会引起多种并发症,严重时甚至导致死亡[11]。在肺部损伤初期,中性粒细胞从血液中被招募而迁移至肺组织,在患者肺部低氧和炎性环境中进一步被诱导而活化,并释放多种炎症因子和毒素,从而加重炎症反应导致的肺组织损伤[12-13]。因此,有效阻断中性粒细胞活化被认为是ARDS肺部损伤防治的重要研究方向[14]。Eyal等[15]研究表明,肺部中性粒细胞的清除能够显著减轻大鼠肺水肿和呼吸机诱导的炎性肺损伤,原因为中性粒细胞数量的减少大大降低了肺部炎症因子和炎症介质的含量。Huang等[16]在脂多糖诱导的小鼠肺损伤模型中,同样通过抑制肺部中性粒细胞增殖获得了降低促炎细胞因子含量和改善肺组织损伤的效果。Harris等[6]研究表明,中性粒细胞中的IL-4信号通路可以调节缺氧诱导的中性粒细胞存活程序,体内实验结果提示IL-4表达能够以促进中性粒细胞凋亡的方式改善炎症反应。
有关中性粒细胞参与肺部炎性损伤的另一项证据为中性粒细胞外诱捕网(neutrophil extracellular trap,NET)的发现。2004年,Brinkmann等[17]应用佛波酯、IL-8和脂多糖共同刺激中性粒细胞,观察到一种细胞释放至包膜外由DNA组成的网状结构,即NET。而初步功能实验表明,通过NET抑制中性粒细胞向损伤部位的迁移具有明显改善病变部位炎症损伤的作用,因而NET被认为是脓毒症治疗及相关器官功能障碍的潜在靶标[18]。
补阳还五汤是在《金匮要略》黄芪桂枝五物汤基础上加减划裁而来,组方包括黄芪、当归尾、赤芍、川芎、桃仁、红花、地龙。方中重用黄芪大补元气,使气旺血行,为君药;当归尾活血化瘀,兼顾补血,活血而不伤血,为臣药;配以赤芍、川芎、桃仁、红花活血祛瘀,使瘀去而正气不伤;地龙清热平喘、通行经络,共为佐药。通观全方,有补气活血、扶正固本之效。多年来,补阳还五汤是中医治疗气虚血瘀证中风后遗症的常用方。《素问·调经论》曰:“血气不和,百病乃变化而生”,ARDS虽与中风后遗症病位、病症均不同,但两者基本病机相似,均是由各种病因导致机体元气亏虚,气虚则运血无力,从而导致瘀血内生,即气虚为本,血瘀为标,因虚致瘀。ARDS属于中医“喘证”“喘脱”“暴喘证”,中医认为喘为气亏不足以息所致,而《灵枢·刺节真邪篇》曰:“宗气不下,脉中之血,离凝而留止”,《医林改错·论抽风不是风》曰:“元气既虚,必不能达于血管,血管无气,必停留而瘀”,《临证指南医案》又曰:“凡经主气,络主血,久病血瘀”,说明肺气亏虚,宣发肃降失司,肺气上逆或气无所主致喘,而肺气不行则血脉不利,血停致瘀。由此可见,元气亏虚为ARDS发生、发展的内在因素及病理基础,由此导致的淤血内停为前者的病理产物及致病因素,两者又可相互影响,互为因果,最终导致疾病愈加深重,故可方选补阳还五汤中大量补气药与少量活血药,以补气活血之法治疗ARDS,以求标本兼治,事半功倍。
临床研究表明,补阳还五汤能够改善ARDS患者肺组织早期纤维化进展、肺功能及生活质量[19]。补阳还五汤重用的黄芪主要活性成分有黄芪甲苷和黄芪多糖,均具有提高机体免疫力、抗菌、保肝、降压和抗应激等作用[20]。弥散性血管内凝血是ARDS发生或加重的高危因素,补阳还五汤方中使用的少量活血药物当归能够通过扩张微血管、增加器官血流量、降低血液黏度及抗血小板聚集等机制,起到干预弥散性血管内凝血转归的效果[21],从而发挥未病先防、既病防变的作用,充分展示了中医药在治疗急危重症方面的优势及特长。
本研究首先对使用及未使用补阳还五汤治疗的ARDS患者BALF样本中的炎症因子含量进行检测,据此结果初步认为补阳还五汤有抗炎活性。与此同时,本研究对ARDS患者BALF来源的中性粒细胞中IL-4Rα、HIF-1α和caspase 3水解体表达进行了检测,结果显示补阳还五汤治疗组中性粒细胞中的IL-4Rα和caspase 3水解体表达均上调,提示补阳还五汤能够通过上调IL-4Rα的表达活化下游细胞凋亡通路。此外,结果还显示常规治疗与接受补阳还五汤治疗的ARDS患者来源的BALF样本之间IL-4含量差异无统计学意义,表明补阳还五汤对IL-4/IL-4Rα通路的活化或与IL-4关系不大,或更倾向通过上调IL-4Rα的表达影响该通路。本研究还通过脂多糖和低氧诱导的方法建立了ARDS体外中性粒细胞活化模型,结果显示经脂多糖和低氧诱导的中性粒细胞分泌炎症因子TNFα、IL-1β和IL-6的能力增强,细胞的增殖活性也增强,这符合中性粒细胞在ARDS患者病理条件下过度活化的特征。在该模型的基础上,使用补阳还五汤药物血清对细胞进行预处理,之后检测相同处理条件下中性粒细胞的活化指标,结果显示补阳还五汤药物血清预处理能够明显降低脂多糖和低氧诱导的细胞增殖活性、抑制炎症因子的分泌能力,并可诱导细胞凋亡。为了证实补阳还五汤抑制中性粒细胞炎性活化与IL-4/IL-4Rα途径有关,通过慢病毒感染的方法对IL-4Rα基因进行靶向沉默,观察到IL-4Rα基因沉默有效逆转了补阳还五汤药物血清的上述作用。
综上所述,补阳还五汤能够有效减少ARDS患者肺部炎症因子含量,作用机制与其通过上调IL-4Rα表达抑制ARDS病理条件下肺部中性粒细胞的增殖和诱导凋亡有关,即补阳还五汤抗ARDS肺损伤作用的发挥基于其对中性粒细胞活化的抑制。
| [1] |
ELTZSCHIG H K, CARMELIET P. Hypoxia and inflammation[J]. N Engl J Med, 2011, 364: 656-665. DOI:10.1056/NEJMra0910283 |
| [2] |
HARRIS A J, THOMPSON A R, WHYTE M K, WALMSLEY S R. HIF-mediated innate immune responses: cell signaling and therapeutic implications[J]. Hypoxia (Auckl), 2014, 2: 47-58. |
| [3] |
GALDIERO M R, BONAVITA E, BARAJON I, GARLANDA C, MANTOVANI A, JAILLON S. Tumor associated macrophages and neutrophils in cancer[J]. Immunobiology, 2013, 218: 1402-1410. DOI:10.1016/j.imbio.2013.06.003 |
| [4] |
HOENDERDOS K, CONDLIFFE A. The neutrophil in chronic obstructive pulmonary disease[J]. Am J Respir Cell Mol Biol, 2013, 48: 531-539. DOI:10.1165/rcmb.2012-0492TR |
| [5] |
WERMELING F, ANTHONY R M, BROMBACHER F, RAVETCH J V. Acute inflammation primes myeloid effector cells for anti-inflammatory STAT6 signaling[J]. Proc Natl Acad Sci USA, 2013, 110: 13487-13491. DOI:10.1073/pnas.1312525110 |
| [6] |
HARRIS A J, MIRCHANDANI A S, LYNCH R W, MURPHY F, DELANEY L, SMALL D, et al. IL4Rα signaling abrogates hypoxic neutrophil survival and limits acute lung injury responses in vivo[J]. Am J Respir Crit Care Med, 2019, 200: 235-246. DOI:10.1164/rccm.201808-1599OC |
| [7] |
刘俊娥, 张继平. 补阳还五汤药效物质基础的研究进展[J]. 中医药信息, 2012, 29: 117-119. |
| [8] |
高雅, 周欣欣, 马存根, 张红珍. 基于网络药理学分析补阳还五汤治疗动脉粥样硬化的作用机制[J]. 山西中医药大学学报, 2021, 22: 275-282. |
| [9] |
ARDS Definition Task Force; RANIERI V M, RUBENFELD G D, THOMPSON B T, FERGUSON N D, CALDWELL E, FAN E, et al. Acute respiratory distress syndrome: the Berlin definition[J]. JAMA, 2012, 307: 2526-2533. |
| [10] |
吴勉华, 王新月. 中医内科学[M]. 9版. 北京: 中国中医药出版社, 2012: 102-104.
|
| [11] |
BELLANI G, LAFFEY J G, PHAM T, FAN E, BROCHARD L, ESTEBAN A, et al. Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries[J]. JAMA, 2016, 315: 788-800. DOI:10.1001/jama.2016.0291 |
| [12] |
HOTH J J, WELLS J D, HILTBOLD E M, MCCALL C E, YOZA B K. Mechanism of neutrophil recruitment to the lung after pulmonary contusion[J]. Shock, 2011, 35: 604-609. DOI:10.1097/SHK.0b013e3182144a50 |
| [13] |
AULAKH G K. Neutrophils in the lung: "the first responders"[J]. Cell Tissue Res, 2018, 371: 577-588. DOI:10.1007/s00441-017-2748-z |
| [14] |
LIN W C, LIN C F, CHEN C L, CHEN C W, LIN Y S. Inhibition of neutrophil apoptosis via sphingolipid signaling in acute lung injury[J]. J Pharmacol Exp Ther, 2011, 339: 45-53. DOI:10.1124/jpet.111.181560 |
| [15] |
EYAL F G, HAMM C R, PARKER J C. Reduction in alveolar macrophages attenuates acute ventilator induced lung injury in rats[J]. Intensive Care Med, 2007, 33: 1212-1218. DOI:10.1007/s00134-007-0651-x |
| [16] |
HUANG X F, XIU H Q, ZHANG S F, ZHANG G S. The role of macrophages in the pathogenesis of ALI/ARDS[J/OL]. Mediators Inflamm, 2018, 2018: 1264913. DOI: 10.1155/2018/1264913.
|
| [17] |
BRINKMANN V, REICHARD U, GOOSMANN C, FAULER B, UHLEMANN Y, WEISS D S, et al. Neutrophil extracellular traps kill bacteria[J]. Science, 2004, 303: 1532-1535. DOI:10.1126/science.1092385 |
| [18] |
BOELTZ S, AMINI P, ANDERS H J, ANDRADE F, BILYY R, CHATFIELD S, et al. To NET or not to NET: current opinions and state of the science regarding the formation of neutrophil extracellular traps[J]. Cell Death Differ, 2019, 26: 395-408. |
| [19] |
高卫星. 补阳还五汤联合泼尼松对肺间质纤维化患者血浆TNFα、IL-1β水平的影响[J]. 现代中西医结合杂志, 2016, 25: 1328-1330, 1359. |
| [20] |
ZHANG W, LIU M, YANG L, HUANG F, LAN Y Y, LI H L, et al. P-glycoprotein inhibitor tariquidar potentiates efficacy of astragaloside Ⅳ in experimental autoimmune encephalomyelitis mice[J/OL]. Molecules, 2019, 24: E561. DOI: 10.3390/molecules.24030561.
|
| [21] |
魏会平, 刘圣君, 刘艳凯, 姜华. 当归注射液对大鼠实验性弥散性血管内凝血血液动力学的影响[J]. 时珍国医国药, 2008, 19: 1606-1607. |
 2022, Vol. 43
2022, Vol. 43


