2. 中国人民解放军海军971医院烧伤整形科,青岛 266071
2. Department of Burn and Plastic Surgery, No. 971 Hospital of PLA Navy, Qingdao 266071, Shandong, China
现代战争中大量现代化常规武器和特殊武器的投入致使战创伤伤势呈现出损伤部位多、创伤面积大、晚期并发症多的多元化趋势,救护难度明显增加[1]。目前,平时和战时特大面积深度烧伤患者的救治仍是临床医师面临的重大挑战[2]。及时修复创面是提高救治成功率的关键之一,如果大面积深度烧伤患者无法在早期封闭创面,则将为后续治疗带来极大困难。因此,如何利用有限的供皮区修复大面积的深度创面,并且保证移植物的存活率,是危重烧伤患者救治中亟待解决的难题[3]。
现有的植皮方法按皮片形态可分为拉网植皮术、邮票植皮术、微粒植皮术等,各种技术均需利用专用设备进行皮片的采集与制备[4]。拉网植皮术需用到拉网植皮机,该术式的特点是皮片移植后瘢痕挛缩症状较轻,皮片成活率较高,但移植扩展比例有限且需要大张完整皮片,不适用于大面积烧伤供皮区十分有限的患者[5]。邮票植皮术中代表性的米克(Meek)植皮术需用到Meek植皮机,操作人员需经专门培训,其清洗消毒程序复杂,且刀片昂贵,多次消毒和重复利用会导致刀刃变钝而影响切割效果[6]。Meek植皮机的皮片移植扩展比例一般在4~9倍,不能满足特大面积深度烧伤创面的修复需要。常规的微粒皮(厚约0.3~0.5 mm,表面大小约1 mm×1 mm)移植是我国首创的植皮技术[7],切取小面积的正常断层皮片,通过手术剪反复手工剪切或用电力驱动的碎皮机反复旋切,将断层皮片制备成表面大小约1 mm×1 mm的皮粒,然后经生理盐水漂浮转移至异体或异种皮再覆盖创面,或直接将微粒皮涂抹、喷洒于创面,再以异体或异种皮等覆盖。微粒皮移植后表皮爬行、扩展,最终融合成片,异体或异种皮逐步脱落,从而实现创面修复[8]。微粒皮移植的皮粒总周长越长,移植后在异体或异种皮的覆盖保护下扩展率越大,因此微粒皮移植可修复10~20倍供皮区面积大小的创面,从而充分利用有限的自体皮源,尽快修复大面积深度创面,是国内救治大面积危重烧伤患者的重要技术保障之一[9]。但手工切割无法精确控制皮粒大小,制备的微粒皮不但大小不均,而且反复无序的切割会造成不可逆的机械损伤,为移植后皮粒在创面的存活带来诸多不可控因素。为此,我们研制了电脑控制的自动切割仪用于微粒皮制备,本研究旨在探讨自主研发的自动切割仪切割微粒皮的效率和效果,以及切割的微粒皮对大鼠全层皮肤缺损创面修复的疗效。
1 材料和方法 1.1 微粒皮自动切割仪的设计与特点本单位自主研发了一种皮片切割设备(专利号:ZL110788906A),由切割模块、三维移动模块、操作面板和刻度垫板4部分组成[10]。三维移动模块包括X、Y、Z轴移动组件,可以沿彼此正交的3个轴移动。将取下的皮片润湿后平铺在刻度垫板上,再将刀片移动到切割起始坐标;设置切割范围与大小,启动后圆形特制刀片开始滚动切割制备微粒皮。该设备适用范围广,操作简便,切割时间短,皮片切割大小规格可调,最大可切割皮片面积为9 cm×9 cm,最大面积切割时间约8.5 min,切割粒径大小可控且均一度高,制备的微粒皮表面大小为0.2 mm×0.2 mm~0.8 mm×0.8 mm,尤其适于在各种皮肤移植术中使用。
1.2 创面准备30只6周龄雄性SD大鼠由海军军医大学(第二军医大学)实验动物中心提供[实验动物生产许可证号:SCXK(沪)2020-0006;使用许可证号:SYXK(沪)2020-0033],体重(190±5)g,随机分为微粒皮手工剪切组(对照组)、微粒皮机械切割组(实验组)和空白非移植组(空白组),每组10只。大鼠采用异氟烷吸入麻醉(流量约600 mL/min),剃毛、脱毛、消毒后于背部脊柱两侧各剪1个直径20 mm的圆形全层皮肤缺损创面,直达筋膜层,然后在创周缝合固定动物移植舱。动物移植舱主要由抗挛缩环和敷料罩两部分组成,抗挛缩环由刻有若干缝线槽的环形侧壁和从侧壁径向凸出的裙边组成,敷料罩由带有若干网孔的镂空顶壁和与抗挛缩环相扣合的侧面把手组成[11]。应用时,将抗挛缩环裙边伸入创周,缝线穿过线槽将抗挛缩环固定于创周皮肤,微型皮移植创面后将敷料罩紧扣于抗挛缩环上。
1.3 微粒皮制备用轮轴取皮刀削取0.3 mm厚的大鼠皮肤,大小约10 mm×10 mm,经过洗必泰与生理盐水冲洗后置于无菌纱布上,将其展开、翻转,表面无明显水渍后,置于自动化皮片切割仪的切割垫板上。设定皮粒切割大小,运行切割程序。切割完成后,用无菌刮铲将微粒皮从切割垫板上转入一次性无菌换药碗中备用。对照组将取下的皮片浸泡于生理盐水中,用组织剪反复剪切20 min,得到粒径约1.0 mm的皮粒。
1.4 微粒皮切割与体外活性评价用最佳切割温度(optimal cutting temperature,OCT)包埋胶将自动切割仪切割与手工剪切后的微粒皮充分浸润于包埋盒中,液氮速冻后行冰冻切片,H-E染色后观察切割效果。
SD大鼠背部取皮(厚约0.3 mm),将皮片切割成0.5 cm×0.5 cm大小的皮片约40片,随机编号后逐一称重。将1~10号皮片用自动切割仪切割成0.6 mm×0.6 mm大小的微粒皮(实验组),11~20号皮片用手工组织剪剪切(对照组),21~30号皮片不进行切割(阳性对照组),31~40号皮片用沸水煮沸15 min(阴性对照组);分别收集于24孔板中,吸尽生理盐水后每孔添加450 µL DMEM和50 µL CCK-8试剂(日本同仁化学研究所),置于37 ℃、5% CO2培养箱中培养2 h;吸取各孔上清,采用德国Molecular Devices多功能酶标仪检测450 nm处的光密度(D)值。每组皮片活性指数(单位质量的微粒皮组织活性)=D值/质量(mg)[12]。
1.5 微粒皮移植动物移植舱内径为20 mm,内环所局限的创面面积为314 mm2,以1∶20的移植比例移植实验组微粒皮(大小0.6 mm×0.6 mm,面积0.36 mm2),移植数量约为43粒。用眼科镊小心夹取微粒皮,将其均匀随机(不选择方向)铺在创面上,外层覆盖凡士林纱布,填塞无菌棉球,使其压力适中,扣紧敷料罩。对照组移植方法同上,空白组仅覆盖凡士林油纱。
1.6 移植疗效观察移植术后第0、5、9、12、15、24天换药,观察记录创面愈合情况。创面愈合后收集标本,用甲醛溶液充分固定,行石蜡包埋、切片(厚3 μm),常规脱蜡至水,苏木精染料染20 s,过盐酸后水洗返蓝。Masson复合染料(丽春红0.7 g、酸性复红0.3 g、冰醋酸1 mL、蒸馏水99 mL)滴染约2 min,0.2%醋酸溶液冲洗,1%磷钼酸溶液分化。亮绿染料(亮绿SF 0.1 g、1%醋酸溶液100 mL)滴染5 min后用0.2%醋酸溶液冲洗,最后浸入无水乙醇快速脱水,二甲苯透明后中性树脂封片。镜下观察创面上皮化及肉芽组织生长情况,用ImageJ软件计算创面上皮化率,创面上皮化率(%)=(第0天创面面积-第n天创面面积)/第0天创面面积×100%。
另取石蜡标本3 μm厚切片,常规脱蜡至水,EDTA修复液高温高压修复2 min。3%过氧化氢溶液封闭10 min,滴加Ki-67一抗(英国Abcam公司)工作液后4 ℃孵育过夜,次日孵育HRP标记的二抗并行DAB显色,苏木精复染核后观察创面细胞增殖情况;滴加Ⅳ型胶原一抗(英国Abcam公司)工作液后4 ℃孵育过夜,次日孵育荧光标记的二抗,以DAPI复染核后镜下观察创面基底膜形成情况。
1.7 统计学处理应用SPSS 25.0软件进行数据分析。符合正态分布的计量资料以x±s表示,两组间比较行独立样本t检验,两组间多个时间点比较采用重复测量方差分析。检验水准(α)为0.05。
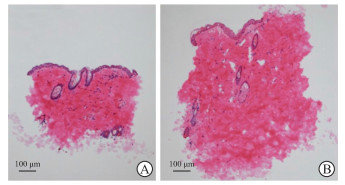
2 结果 2.1 微粒皮自动切割仪的切割效率与效果切割2 cm×3 cm的皮片,使用自动切割仪所需时间为5 min,而使用组织剪手工剪切所需时间约为40 min,结果表明使用自动切割仪可以显著缩短切割时间,省时、省工。自动切割仪切割的皮粒呈小立方体状、粒径均一、形状完整,而手工剪切的皮粒形状不一、大小不均,并且底部有较多皮浆沉淀(图 1)。H-E染色结果显示自动切割仪切割的皮粒包含真皮层和表皮层,结构保留完好,而手工剪切的皮粒表皮层损伤严重,结构保留不完整(图 2)。

|
图 1 自动切割仪切割的微粒皮(大小约0.6 mm×0.6 mm,A)与手工剪切的微粒皮(B) Fig 1 Microskins cut by automatic cutting machine (about 0.6 mm×0.6 mm, A) and microskins cut by hand (B) |
|
图 2 微粒皮的H-E染色结果 Fig 2 H-E staining of microskins A: Microskins cut by automatic cutting machine; B: Microskins cut by hand. H-E: Hematoxylin-eosin. |
2.2 微粒皮体外活性比较CCK-8法检测发现,未切割的阳性对照皮片活性指数为(0.077
654±0.004 074)mg-1,高于手工剪切皮片[(0.045 168±0.002 698)mg-1]和自动切割皮片[(0.067 981±0.004 467)mg-1],自动切割皮片的活性指数高于手工剪切皮片,差异均有统计学意义(P均<0.01),说明不管手工切割还是自动切割仪切割,都会对皮片造成损伤使其活性降低。但与手工切割相比,自动切割对皮片的损伤更小,切割后皮粒活性保存更好。
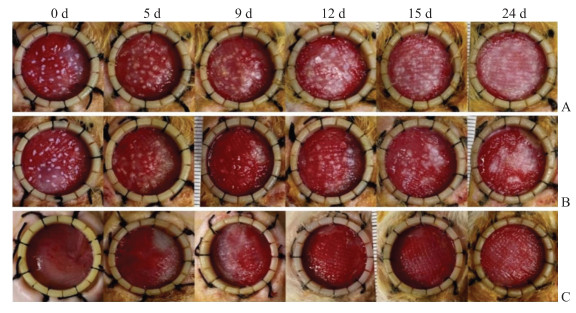
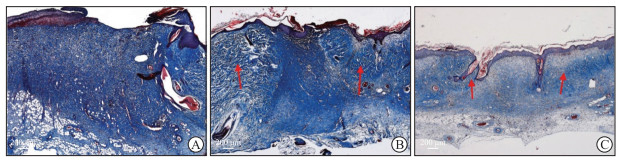
2.3 自动切割微粒皮与手工剪切微粒皮修复创面效果比较在移植术后第0、5、9、12、15、24天换药,观察记录创面愈合情况。在第24天,实验组创面已基本愈合(图 3),通过ImageJ软件分析,创面上皮化率达到(78.6±2.3)%,高于对照组[(27.2±1.9)%],差异有统计学意义(P<0.01),说明相比手工切割的微粒皮,自动切割仪制备的微粒皮在移植到创面后有更大的扩展比例,能够在更短的时间内修复创面。取创面标本进行Masson染色,观察到空白组肉芽组织增生明显,胶原排布紊乱不规则,创面无上皮化;对照组部分创面已上皮化,肉芽组织较厚,胶原排列致密紊乱;实验组肉芽组织无明显增生,胶原排列疏松且规则,与正常皮肤结构类似(图 4)。
|
图 3 微粒皮移植术后不同时间点各组大鼠创面愈合情况大体观 Fig 3 General view of wound healing of rats in each group at different time points after microskins transplantation A: Experimental group. Microskins (about 0.6 mm×0.6 mm) were cut by automatic cutting machine and were transplanted at a ratio of 1∶20. B: Control group. Microskins (about 1.0 mm×1.0 mm) were cut by hand and were transplanted at a ratio of 1∶20. C: Blank group. |
|
图 4 微粒皮移植术后各组大鼠创面Masson染色结果 Fig 4 Masson staining results of rat wounds in each group after microskins transplantation A: Blank group; B: Control group; C: Experimental group. Arrows indicate the collagen arrangement of the grafted microskins, and the collagen arrangement is more regular in the experimental group than in the control group. |
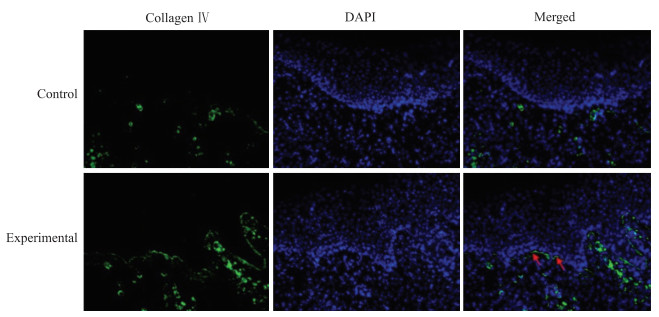
进一步行Ⅳ型胶原免疫荧光染色检测创面基底膜形成情况,发现实验组创面比对照组更早形成连续的基底膜,表皮与真皮间的连接更加牢固(图 5)。创面标本Ki-67免疫组织化学染色检测结果(图 6)显示,实验组创面基底层阳性细胞数目明显多于对照组,说明自动切割微粒皮能促进创面细胞增殖,加速修复进程。
|
图 5 微粒皮移植术后大鼠创面基底膜Ⅳ型胶原免疫荧光染色结果(200×) Fig 5 Results of immunofluorescence staining of collagen Ⅳ in basement membrane of rat wounds after microskins transplantation (200×) Arrows refer to the continuous basement membrane. DAPI: 4', 6-diamidino-2-phenylindole. |

|
图 6 微粒皮移植术后大鼠创面Ki-67免疫组织化学染色结果(400×) Fig 6 Ki-67 immunohistochemical staining results of rat wounds after microskins transplantation (400×) A: Control group; B: Experimental group. |
3 讨论
微粒皮移植具有所需供体面积小、扩展比例高的明显优势[13]。传统微粒皮移植尽管在国内已应用40余年,为修复大面积深度创面提供了中国原创的方法,但其制备过程烦琐,不管是手工切割还是碎皮机切割都难以控制切割的精度,且反复的剪切或旋切会导致微粒皮活性损失严重,从而限制了微粒皮移植技术的发展与应用。本单位自主研发的自动切割设备制备能将断层皮片精准切割成大小均一的超小型皮粒,厚约0.3 mm,表面大小最小可达0.2 mm×0.2 mm,在0.2 mm×0.2 mm~0.8 mm×0.8 mm范围内可任意精确切割成大小均一的皮粒。这为评价微粒皮的切割、移植效果提供了可控的质量保证,尤其是对于单一的微粒皮仅通过切割仪的纵横二次切割即可制备,避免了常规制备方法中反复无序剪切(旋切)对皮粒的机械损伤,有利于维持其生物学活性、提高移植存活率。本研究结果显示,与手工切割的微粒皮相比,自动切割仪制备的大小0.6 mm×0.6 mm的大鼠微粒皮的皮片结构更完整,体外活性更高,移植到大鼠全层皮肤缺损创面后能获得更大的扩展比例,上皮化速度更快,展现出与传统意义上的微粒皮明显不同的理化特征,在制备效率、切割粒径均一性、活性保留、移植扩展比例等方面较现有方法均有明显优势,具有良好的移植效果和应用前景。
传统方法仅能制备大小约为1 mm×1 mm的微粒皮,移植时需考虑皮粒的方向性(真皮面朝下皮片才能存活),故随机涂抹只有约50%的存活率[14]。国外研究发现当微粒皮粒径小于0.8 mm时,移植到创面时可以不考虑皮粒的方向性(真皮面朝上或朝下均能存活)[15]。在本研究中,我们也发现0.6 mm粒径的微粒皮移植到创面后存活良好,故可采取注射的方式或涂抹于创面,不需要进行移植前方向的选择,使微粒皮移植过程更加方便快捷并缩短了移植时间,且移植扩展比例可达到1∶20,高于传统微粒皮1∶10的扩展比例[16]。这使得微粒皮移植更加精准化、微创化,为今后慢性创面修复、瘢痕整复等多种临床应用提供了技术支持。
微粒皮修复大面积全层皮肤缺损创面的机制尚有待深入探讨。首先,微粒皮能在良好覆盖物的保护下存活,表皮爬行、融合,从而使创面上皮化,达到以较小的供皮区修复10倍以上面积的深度创面[17]。本研究制备的0.6 mm粒径的微粒皮能为创面提供更多的上皮化单位,且移植后皮粒存活率更高,故能以更大扩展比例、更短的时间修复创面。其次,有许多研究证明微粒皮本身具有高度生物学活性,通过可能的机制调控创面局部微环境而诱导组织修复重塑。Pertusi等[18]将手工剪碎后的皮片与未剪碎的皮片分别进行体外培养,发现剪碎的样本表达更高水平的血小板源性生长因子(platelet-derived growth factor,PDGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor,b-FGF)、TNFα、IL-1α等因子,而IL-6、单核细胞趋化蛋白1(monocyte chemotactic protein 1,MCP-1)、生长调节致癌基因α(growth-related oncogene α,GROα)、血管内皮生长因子(vascular endothelial growth factor,VEGF)等因子表达更低。高水平的PDGF、b-FGF有助于促进创面愈合、真皮重建,而更低的IL-6、MCP-1、GROα表明炎症反应更弱。Osborne等[19]发现体外培养的表皮微粒(1.8 mm×1.8 mm)能主动分泌VEGF、肝细胞生长因子(hepatocyte growth factor,HGF)、粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)、PDGF、TGFα等多种能调控创面愈合的关键生长因子。另外,Jimi等[20]也发现微粒皮能促进TGF-β1表达,从而加速创面再上皮化。上述研究表明,微粒皮不仅通过表皮爬行使创面上皮化,而且自身具有高度生物学活性,亦可能通过调控创面局部微环境而诱导组织修复。这将为应用微粒皮修复创面提供新的理论依据,未来仍需要进一步的实验研究来探索其机制。
| [1] |
周丽娟. 战创伤急救器材及急救技术的研究进展[J]. 解放军护理杂志, 2010, 27: 1789-1792. DOI:10.3969/j.issn.1008-9993.2010.23.010 |
| [2] |
张高飞, 刘文军, 王迪, 段建兴, 李晓庆. 微粒皮和Meek微型皮片移植修复大面积深度烧伤创面临床效果的荟萃分析[J]. 中华烧伤杂志, 2020, 36: 560-567. DOI:10.3760/cma.j.cn501120-20190521-00249 |
| [3] |
徐建军, 林才. 微型皮片移植方法在大面积深度烧伤中的应用[J/CD]. 中华损伤与修复杂志(电子版), 2011, 6: 111-117.
|
| [4] |
栗申, 郭素娟. 邮票皮、meek微型皮与微粒皮三种植皮方式在修复大面积皮肤缺损创面中的疗效对比研究[J]. 四川解剖学杂志, 2018, 26: 81-83. |
| [5] |
郭振荣, 张淑兰, 宁淑华. 网状植皮的临床应用及13年的随诊观察[J]. 实用外科杂志, 1991, 11: 44-46. |
| [6] |
李峰, 王宏伟, 尹会男, 迟云飞, 胡泉, 刘伟, 等. 削痂后Ⅱ期于脂肪组织层行Meek植皮治疗大面积深度烧伤的临床效果及机制[J]. 中华烧伤杂志, 2019, 35: 446-450. DOI:10.3760/cma.j.issn.1009-2587.2019.06.009 |
| [7] |
张明良. 碎皮机在微皮移植术中的应用[J]. 中华整形烧伤外科杂志, 1990, 6: 65-66. |
| [8] |
张明良. 微粒皮移植术的回顾及展望[J]. 中华烧伤杂志, 2008, 24: 343-345. DOI:10.3760/cma.j.issn.1009-2587.2008.05.009 |
| [9] |
张明良, 周光峰, 张普柱, 徐军, 张国安, 陈旭. 大面积烧伤的微皮移植术[J]. 中华外科杂志, 2001, 39: 708-710. |
| [10] |
肖仕初, 帅超群, 夏照帆, 纪世召, 郑勇军, 贲道锋, 等. 皮片切割设备: CN208714095U[P]. 2019-04-09.
|
| [11] |
帅超群, 姜耀男, 肖仕初, 郑勇军, 吴琼, 王雨翔. 用于医学动物实验的创缘固定套件: CN110279482A[P]. 2019-09-27.
|
| [12] |
GAUCHER S, JARRAYA M. Technical note: comparison of the Presto Blue and LDH release assays with the MTT assay for skin viability assessment[J]. Cell Tissue Bank, 2015, 16: 325-329. DOI:10.1007/s10561-014-9478-1 |
| [13] |
王泽京, 李海航, 贲驰, 路昊, 朱世辉. 微型皮片移植技术的应用研究进展[J]. 中华烧伤杂志, 2021, 37: 93-96. |
| [14] |
郑小鹏. 微粒皮方向性对移植存活率的影响及改进方法[D]. 上海: 第二军医大学, 2016.
|
| [15] |
SINGH M, NUUTILA K, KRUSE C, DERMIETZEL A, CATERSON E J, ERIKSSON E. Pixel grafting: an evolution of mincing for transplantation of full-thickness wounds[J/OL]. Plast Reconstr Surg, 2016, 137: 92e-99e. DOI: 10.1097/PRS.0000000000001871.
|
| [16] |
陈旭, 覃凤均, 于东宁, 孙永华. 微粒皮肤移植术的历史、现状和未来[J/CD]. 中华损伤与修复杂志(电子版), 2019, 14: 9-12.
|
| [17] |
BAIRAGI A, GRIFFIN B, TYACK Z, VAGENAS D, MCPHAIL S M, KIMBLE R. Comparative effectiveness of Biobrane®, RECELL® autologous skin cell suspension and silver dressings in partial thickness paediatric burns: BRACS randomised trial protocol[J/OL]. Burns Trauma, 2019, 7: 33. DOI: 10.1186/s41038-019-0165-0.
|
| [18] |
PERTUSI G, TIBERIO R, GRAZIOLA F, BOGGIO P, COLOMBO E, BOZZO C. Selective release of cytokines, chemokines, and growth factors by minced skin in vitro supports the effectiveness of autologous minced micrografts technique for chronic ulcer repair[J]. Wound Repair Regen, 2012, 20: 178-184. |
| [19] |
OSBORNE S N, SCHMIDT M A, DERRICK K, HARPER J R. Epidermal micrografts produced via an automated and minimally invasive tool form at the dermal/epidermal junction and contain proliferative cells that secrete wound healing growth factors[J]. Adv Skin Wound Care, 2015, 28: 397-405. |
| [20] |
JIMI S, KIMURA M, DE FRANCESCO F, RICCIO M, HARA S, OHJIMI H. Acceleration mechanisms of skin wound healing by autologous micrograft in mice[J/OL]. Int J Mol Sci, 2017, 18: 1675. DOI: 10.3390/ijms18081675.
|
 2022, Vol. 43
2022, Vol. 43


