2. 陕西中医药大学药学院,西安 712046;
3. 长春中医药大学药学院,长春 130117;
4. 中国中医科学院研究生院,北京 100700;
5. 清华德人西安幸福制药有限公司,西安 710043
2. College of Pharmacy, Shaanxi University of Chinese Medicine, Xi'an 712046, Shaanxi, China;
3. College of Pharmacy, Changchun University of Chinese Medicine, Changchun 130117, Jilin, China;
4. Graduate School, China Academy of Traditional Chinese Medicine, Beijing 100700, China;
5. Tsinghua Deren Xi'an Happiness Pharmaceutical Co., Ltd., Xi'an 710043, Shaanxi, China
肝纤维化是我国常见的慢性肝病,也是肝硬化、肝癌发展的必经阶段,其早期干预对于肝硬化、肝癌的防治具有重要意义。目前尚无有效防治肝纤维化的药物,中药具有多功能、多靶点的作用特点,用于防治肝纤维化具有显著优势。五灵胶囊由丹参、柴胡、五味子、灵芝4味药材组成,已收录于《中华人民共和国药典》(2020版),具有疏肝、健脾、活血之功效[1],可用于肝炎、肝纤维化、肝硬化等肝脏疾病的治疗[2-5]。五灵胶囊原工艺中的五味子和丹参使用乙醇回流提取3次,根据本课题组前期指纹图谱和含量测定结果,表明多糖、丹参酸B和五味子醇甲等成分未被充分提取[6]。为提升五灵胶囊的疗效,在原工艺的基础上优化提取工艺,以增加水溶性成分的提取率。本实验旨在比较五灵胶囊工艺优化前后对大鼠肝纤维化的保护作用,为其工艺变更和临床应用提供实验依据。
1 材料和方法 1.1 实验动物、药品与试剂90只SPF级雄性SD大鼠,体质量(180±20)g,6~8周龄,由成都达硕实验动物有限公司提供,动物生产许可证号为SCXK(川)2020-030。自由摄食及饮水,饲养温度(21±3)℃,湿度(50±5)%,照明时间为12 h,大鼠适应性饲养1周。
五灵胶囊(新工艺,批号21031;原工艺,批号210304)由清华德人西安幸福制药有限公司提供,水飞蓟素(批号C16D10H105984)购于上海源叶生物科技有限公司。
四氯化碳(CCl4,货号20210102)购于天津市天力化学品试剂有限公司;碱性磷酸酶(alkaline phosphatase,ALP;货号140320011)、丙氨酸转氨酶(alanine aminotransferase,ALT;货号140120014)、天冬氨酸转氨酶(aspartate aminotransferase,AST;货号140220008)、总胆汁酸(total bile acid,TBA;货号143221002)、总蛋白(total protein,TP;货号140820005)和白蛋白(albumin,ALB;货号148320009)检测试剂盒均购于深圳迈瑞生物医疗电子股份有限公司;超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒(货号20210722)购于南京建成生物工程研究所;大鼠IL-6(货号R210723-003a)、IL-1β(货号R210730-007a)和TNF-α(货号R210708-102a)ELISA检测试剂盒均购于深圳欣博盛生物科技有限公司。α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)抗体(货号GB13044)由武汉赛维尔生物科技有限公司提供。
1.2 实验仪器BS-330E全自动生化分析仪(深圳迈瑞生物医疗电子股份有限公司),Synergy H1全功能酶标仪(美国BioTek公司),Sorvall LegendTM Micro 17R高速冷冻离心机(美国Thermo Scientific公司),qTOWER2.2实时荧光定量PCR仪(德国Analytik Jena公司)。
1.3 五灵胶囊提取工艺五灵胶囊原工艺参照2020版《中华人民共和国药典》[1]。五灵胶囊新工艺中的柴胡、灵芝、丹参和五味子的配比与原工艺一样。新工艺[6]中,柴胡粗粉和灵芝加75%乙醇回流提取后,增加了50%乙醇回流提取;丹参和五味子乙醇回流提取2次后,增加了50%乙醇回流提取。
1.4 分组、造模及给药SD大鼠随机分为9组:对照组、模型组、水飞蓟素阳性药组(0.1 g/kg)、五灵胶囊新工艺(五新)低剂量组(0.25 g/kg)、五新中剂量组(0.5 g/kg)、五新高剂量组(1.0 g/kg)、五灵胶囊原工艺(五原)低剂量组(0.25 g/kg)、五原中剂量组(0.5 g/kg)和五原高剂量组(1.0 g/kg),每组10只。五灵胶囊临床使用剂量为5(粒)×0.35(g/粒)×3(次/d)/60(kg,成人平均体重)=0.087 5(g/kg),换算为大鼠用药剂量:0.087 5(g/kg)×6.25≈0.5(g/kg),故在本实验中选择0.25、0.5和1.0 g/kg分别作为五灵胶囊低、中、高剂量。
分别取五新和五原粉末适量,加水配成25、50、100 mg/mL混悬液,分别用作五新和五原低、中、高剂量组的灌胃药物。取水飞蓟素粉末适量,加水配成10 mg/mL混悬液,用于水飞蓟素阳性药组的灌胃药物,每组按10 mL/kg的体积灌胃给药。
模型组和给药组大鼠分别腹腔注射40% CCl4(CCl4与橄榄油的体积比为2∶3,剂量为2 mL/kg)[7],对照组大鼠腹腔注射等量的橄榄油,每周2次(周二、周五),每次注射前称大鼠体重,计算注射体积,共8周。给药组第2周开始灌胃给药,每天1次,对照组和模型组大鼠给予等量生理盐水,连续6周。实验期间大鼠自由摄食饮水,每周记录大鼠体重。大鼠末次给药后,禁食不禁水12 h,0.3%戊巴比妥钠(10 mL/kg)腹腔注射麻醉大鼠,腹主动脉采血,1 200×g离心10 min分离血清,取部分血清用于生化指标测定,剩余血清于-80 ℃保存。采集血样后,完整取出肝脏和脾脏,用生理盐水清洗后滤纸拭干,称取湿重,按公式计算脏器指数:脏器指数(%)=脏器质量/体质量×100%。取肝脏左叶中部浸泡于10%多聚甲醛溶液中,剩余肝脏组织放于-80 ℃冰箱保存。
1.5 指标检测 1.5.1 肝功能指标用全自动生化分析仪检测大鼠血清ALP、ALT、AST、TP、ALB和TBA水平。
1.5.2 肝组织病理学剪取大鼠肝组织左叶,以4%多聚甲醛溶液固定,石蜡包埋,连续切片,厚5 μm,分别进行H-E染色和Masson染色,于光学显微镜下观察肝组织病理变化。成像完成后应用Image-Pro Plus 6.0软件对Masson染色结果进行半定量分析,分别测量每个视野的胶原纤维面积及对应视野的组织面积,胶原纤维面积百分比(%)=胶原纤维面积/组织面积×100%。
1.5.3 免疫组织化学染色检测肝组织中α-SMA的表达大鼠肝组织切片脱蜡后以3% H2O2去除内源性过氧化物酶,用0.01 mol/L枸橼酸抗原修复液对组织抗原进行微波修复,冷却到室温,加一抗α-SMA封闭过夜后滴加二抗(IgG-HRP多聚体抗体),室温孵育1~2 h。PBS冲洗后,DAB显色,中性树胶封片,于光镜下观察。成像完成后应用Image-Pro Plus 6.0软件对免疫组织化学染色结果进行半定量分析,分别测量每个视野的阳性染色面积及对应视野的组织面积,阳性表达面积比例(%)=阳性面积/组织面积×100%。
1.5.4 血清SOD活性检测按照血清SOD检测试剂盒说明书测定。
1.5.5 ELISA测定血清中IL-6、IL-1β和TNF-α的含量按照ELISA试剂盒说明书操作。
1.5.6 qPCR检测采用TRIzol(货号T9424,美国Sigma公司)法提取大鼠肝脏总RNA,采用NanoDrop One检测RNA浓度和纯度。采用PrimeScriptTM RT Master Mix反转录试剂盒(货号RR036A,日本TaKaRa公司)将RNA反转录为cDNA,采用qTOWER2.2实时荧光定量PCR仪和SYBR® Premix Ex TaqTM Ⅱ试剂盒(货号RR820A,日本TaKaRa公司)进行qPCR扩增。反应体系20 μL,内参为β-肌动蛋白,根据2-ΔΔCt计算胶原蛋白(collagen,COL)Ⅰ、COL Ⅲ、COL Ⅳ和NF-κB mRNA的相对表达量。引物序列如下:COL Ⅰ上游引物序列为5'-TCCTGGCAATCGTGGT-TCAA-3',下游引物序列为5'-ACCAGCTGGGCC-AACATTTC-3';COL Ⅲ上游引物序列为5'-TGG-ACAGATCGTGGTGCTGAG-3',下游引物序列为5'-GAAGGCCAGCTGTACATCAAGGA-3';COL Ⅳ上游引物序列为5'-GTCCTGTCTGGAAGAGTT-TA-3',下游引物序列为5'-AGCTGTAAGCATTCG-CGTAG-3';NF-κB上游引物序列为5'-ACGATC-TGTTTCCCCTCATCT-3',下游引物序列为5'-TGC-TTCTCTCCCCAGGAATA-3';β-肌动蛋白上游引物序列为5'-TCAGGTCATCACTATCGGCAAT-3',下游引物序列为5'-AAAGAAAGGGTGTAAAACGCA-3'。
1.6 统计学处理应用SPSS 19.0软件进行统计学分析,符合正态分布的计量资料以x±s表示,两组间比较用t检验,多组间比较采用单因素方差分析。检验水准(α)为0.05。
2 结果 2.1 五灵胶囊对CCl4诱导的肝纤维化大鼠脏器指数的影响结果见表 1。与对照组相比,模型组大鼠的肝脏指数和脾脏指数均升高(P均<0.01)。与模型组相比,水飞蓟素及五新和五原低、中剂量组大鼠的肝脏指数均降低(P<0.05,P<0.01),脾脏指数组间差异无统计学意义(P均>0.05)。五新和五原高剂量组大鼠的肝脏指数均高于水飞蓟素组(P均<0.01),五新中、高剂量组大鼠的脾脏指数均低于水飞蓟素组(P均<0.05)。五新和五原各剂量组间肝脏指数和脾脏指数差异均无统计学意义(P均>0.05)。
|
|
表 1 五灵胶囊对CCl4诱导的肝纤维化大鼠脏器指数的影响 Tab 1 Effects of Wuling capsule on viscera indexes of CCl4-induced hepatic fibrosis rats |
2.2 五灵胶囊对CCl4诱导的肝纤维化大鼠血清生化指标的影响
结果见表 2。与对照组相比,模型组大鼠血清的ALT、AST、ALP和TBA含量均升高(P均<0.01)、ALB含量下降(P<0.01)。与模型组相比,五新3个剂量组大鼠血清ALT、AST和TBA的含量均降低(P<0.05,P<0.01)、ALB含量升高(P<0.01),高剂量组ALP含量降低(P<0.05)。与模型组相比,五原低、高剂量组大鼠血清ALT含量均降低(P均<0.05)、ALB含量升高(P<0.05,P<0.01),高剂量组AST含量降低(P<0.05),中、高剂量组ALP和TBA含量均降低(P均<0.05)。与模型组相比,水飞蓟素组的ALT和TBA含量均降低(P均<0.05)、ALB含量升高(P<0.05)。五新高剂量组大鼠血清ALP含量低于水飞蓟素组(P<0.05)。
|
|
表 2 五灵胶囊对CCl4诱导的肝纤维化大鼠血清生化指标的影响 Tab 2 Effects of Wuling capsule on serum biochemical indexes of CCl4-induced hepatic fibrosis rats |
五新中剂量组大鼠血清ALT、AST、ALB和五新低剂量组的TBA等指标与模型组相比差异均有统计学意义(P<0.05,P<0.01),而相应剂量的五原组差异无统计学意义(P均>0.05);与五原高剂量组相比,五新高剂量组大鼠血清TBA含量降低(P<0.05)。
2.3 肝组织病理学检查大鼠肝脏组织H-E染色结果(图 1)显示,对照组大鼠肝小叶结构正常,肝细胞排列整齐,中央静脉血管壁清晰可见;模型组大鼠肝小叶结构紊乱,不同静脉间大量结缔组织增生并互相连接,形成假小叶结构,伴有炎症细胞浸润,并可见胆管增生、较多的肝细胞脂肪变性,细胞质内可见微小的圆形空泡;水飞蓟素组及五新和五原低、中、高剂量组的肝脏病变程度均轻于模型组。

|
图 1 大鼠肝脏组织H-E染色病理学图片(200×) Fig 1 Representative pathological images of rat liver tissues by H-E staining (200×) WLC-N-L, WLC-N-M and WLC-N-H indicate Wuling capsule new process low-dose, middle-dose and high-dose group, respectively. WLC-O-L, WLC-O-M and WLC-O-H indicate Wuling capsule original process low-dose, middle-dose and high-dose group, respectively. H-E: Hematoxylin-eosin. |
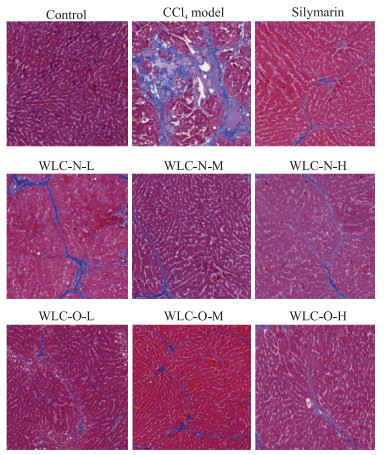
大鼠肝脏组织Masson染色结果(图 2)显示,对照组未见明显胶原纤维增生;模型组大鼠肝小叶均受到不同程度的破坏,肝细胞排列紊乱,汇管区、中央静脉、门静脉可见大量胶原纤维增生。与对照组相比,模型组肝脏胶原纤维面积百分比增加[(17.2±7.6)% vs(1.1±0.4)%,P<0.01],提示肝纤维化造模成功。各给药组的胶原纤维增生程度较模型组改善,水飞蓟素组,五新低、中、高剂量组,以及五原低、中、高剂量组的肝脏胶原纤维面积百分比分别为(6.8±4.6)%、(8.7±4.7)%、(3.1±1.0)%、(6.5±4.9)%、(7.7±6.2)%、(7.7±6.2)%和(6.0±5.8)%,较模型组减少(P<0.05,P<0.01)。水飞蓟素、五新和五原各剂量组间的肝脏胶原纤维面积百分比差异无统计学意义(P均>0.05)。
|
图 2 大鼠肝脏组织Masson染色病理学图片(200×) Fig 2 Representative pathological images of rat liver tissues by Masson staining (200×) WLC-N-L, WLC-N-M and WLC-N-H indicate Wuling capsule new process low-dose, middle-dose and high-dose group, respectively. WLC-O-L, WLC-O-M and WLC-O-H indicate Wuling capsule original process low-dose, middle-dose and high-dose group, respectively. |
2.4 五灵胶囊对肝纤维化大鼠肝脏组织中α-SMA表达的影响
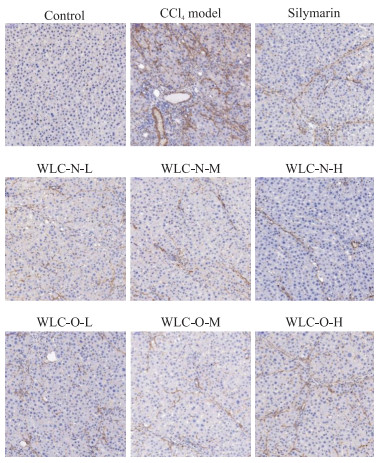
免疫组织化学染色结果(图 3)显示,对照组大鼠肝脏组织中仅见少量棕黄色染色斑点,α-SMA阳性表达面积比例仅为(0.6±0.4)%。与对照组相比,模型组大鼠肝脏组织中棕黄色区域面积增加,颜色加深,α-SMA阳性表达面积比例[(12.5±4.0)%]增加(P<0.01)。与模型组比较,各给药组大鼠肝脏组织中棕黄色区域面积减少,颜色减轻。水飞蓟素组,五新低、中、高剂量组,以及五原低、中、高剂量组的α-SMA阳性表达面积比例分别为(5.7±2.7)%、(3.4±3.2)%、(3.5±1.2)%、(1.8±0.5)%、(2.8±1.5)%、(4.6±3.0)%和(6.9±2.5)%,与模型组相比均减少(P<0.05,P<0.01)。与五原高剂量组相比,五新高剂量组的α-SMA阳性表达面积比例减少(P<0.01)。
|
图 3 大鼠肝脏组织中α-SMA表达的免疫组织化学染色图片(200×) Fig 3 Representative immunohistochemical images of α-SMA expression in rat liver tissues (200×) WLC-N-L, WLC-N-M and WLC-N-H indicate Wuling capsule new process low-dose, middle-dose and high-dose group, respectively. WLC-O-L, WLC-O-M and WLC-O-H indicate Wuling capsule original process low-dose, middle-dose and high-dose group, respectively. α-SMA: α-smooth muscle actin. |
2.5 五灵胶囊对CCl4诱导的肝纤维化大鼠血清SOD活性的影响
对照组大鼠血清SOD活性为(121.2±8.8)U/mL;与对照组相比,模型组大鼠血清SOD活性[(108.8±6.3)U/mL]降低(P<0.01);与模型组相比,水飞蓟素组,五新低、中、高剂量组,以及五原低、中、高剂量组的大鼠血清SOD活性均升高(P<0.05,P<0.01),分别为(119.3±5.2)、(121.0±2.8)、(121.9±4.1)、(120.4±10.0)、(119.3±6.7)、(117.6±3.8)、(121.8±4.8)U/mL。水飞蓟素组、五新和五原各剂量组间的血清SOD活性差异无统计学意义(P>0.05)。
2.6 五灵胶囊对CCl4诱导的肝纤维化大鼠血清IL-6、IL-1β和TNF-α表达的影响结果见表 3。与对照组相比,模型组大鼠血清中IL-6、IL-1β和TNF-α的含量均升高(P<0.05,P<0.01)。与模型组相比,水飞蓟素组大鼠血清中IL-1β含量降低(P<0.05);五新各剂量组大鼠血清中IL-6和IL-1β含量均降低(P均<0.05),五新中、高剂量组的TNF-α含量均降低(P<0.05,P<0.01);五原各剂量组大鼠血清中IL-6和TNF-α含量均降低(P均<0.05),五原低、中剂量组的IL-1β含量均降低(P均<0.05)。五原高剂量组大鼠血清中IL-6含量及五新中、高剂量组和五原各剂量组的TNF-α含量均低于水飞蓟素组(P<0.05,P<0.01)。五新和五原各剂量组间大鼠血清IL-6、IL-1β和TNF-α的含量差异无统计学意义(P均>0.05)。
|
|
表 3 五灵胶囊对CCl4诱导的肝纤维化大鼠血清IL-6、IL-1β和TNF-α表达的影响 Tab 3 Effects of Wuling capsule on expression of serum IL-6, IL-1β and TNF-α in CCl4-induced hepatic fibrosis rats |
2.7 五灵胶囊对CCl4诱导的肝纤维化大鼠肝脏COL Ⅰ、COL Ⅲ和COL Ⅳ mRNA表达的影响
结果见表 4。与对照组相比,模型组大鼠肝脏中COL Ⅰ、COL Ⅲ和COL Ⅳ mRNA的相对表达量均升高(P均<0.05)。与模型组相比,水飞蓟素组大鼠肝脏中COL Ⅰ和 COL Ⅳ mRNA相对表达量均降低(P均<0.05);五新各剂量组大鼠肝脏中COL Ⅰ、COL Ⅲ和COL Ⅳ mRNA相对表达量均降低(P<0.05,P<0.01);五原各剂量组的COL Ⅰ mRNA相对表达量均降低(P<0.05,P<0.01),五原中剂量组的COL Ⅲ mRNA相对表达量降低(P<0.05),五原中、高剂量组的COL Ⅳ mRNA相对表达量均降低(P<0.05,P<0.01)。五新中、高剂量组的COL Ⅲ mRNA相对表达量均低于水飞蓟素组(P均<0.05),五原低剂量组的COL Ⅳ mRNA相对表达量高于水飞蓟素组(P<0.05)。五新低剂量组的COL Ⅲ mRNA相对表达量低于五原低剂量组(P<0.05)。
|
|
表 4 五灵胶囊对CCl4诱导的肝纤维化大鼠肝脏COL Ⅰ、COL Ⅲ和COL Ⅳ mRNA表达的影响 Tab 4 Effects of Wuling capsule on mRNA expression of COL Ⅰ, COL Ⅲ and COL Ⅳ in the liver of CCl4-induced hepatic fibrosis rats |
2.8 五灵胶囊对CCl4诱导的肝纤维化大鼠肝脏NF-κB mRNA表达的影响
对照组大鼠肝脏中NF-κBmRNA的相对表达量为0.82±0.59,与对照组相比,模型组大鼠肝脏中NF-κB mRNA的相对表达量上调(3.00±2.02;P<0.05,P<0.01)。与模型组相比,水飞蓟素组,五新低、中、高剂量组,以及五原低、中、高剂量组大鼠肝脏中NF-κB mRNA相对表达量均降低(P<0.05,P<0.01),分别为1.18±0.68、0.88±0.35、0.37±0.40、0.34±0.21、1.15±0.84、0.32±0.16和0.54±0.37。与水飞蓟素组相比,五新中、高剂量组和五原中剂量组大鼠肝脏中NF-κB mRNA相对表达量降低(P均<0.01)。五新和五原各剂量组间NF-κB mRNA相对表达量差异无统计学意义(P>0.05)。
3 讨论CCl4可诱导肝损伤模型,单剂量给予CCl4可导致脂肪变性、肝细胞损伤,长期给药可导致肝纤维化、肝硬化和肝癌。CCl4诱导的肝纤维化动物模型具有耗时短、成模率高及其病理组织学变化与人类肝纤维化相似等特点,已被广泛用于抗肝纤维化天然药物的研究[8]。本实验采用腹腔注射40% CCl4制作肝纤维化大鼠模型,表现为肝脏结构破坏,肝组织胶原纤维量增加,ALT、AST、ALP和TBA等释放入血,血清含量升高,ALB含量和SOD活性下降,IL-1β、IL-6及TNF-α等炎症因子含量升高。本实验中五灵胶囊新工艺和原工艺均可改善模型大鼠肝脏病理改变,降低肝纤维化程度和模型大鼠血清中的ALT、AST、ALP和TBA含量及IL-6、IL-1β和TNF-α等炎症因子含量,升高模型大鼠血清中的ALB含量和SOD活性,说明五灵胶囊新工艺和原工艺均对肝纤维化有保护作用。
肝纤维化的本质是肝脏对各种慢性刺激进行损伤修复时,以胶原蛋白为主要组分的细胞外基质(extracellular matrix,ECM)在肝内大量沉积的病理过程[9]。肝星状细胞(hepatic stellate cell,HSC)激活和增殖被认为是肝纤维化的本质与核心步骤,其活化可促进COL Ⅰ、COL Ⅲ、COL Ⅳ等ECM的产生[10],抑制HSC活化及增殖、诱导HSC凋亡、减少ECM沉积均可逆转肝纤维化的发展。α-SMA是HSC激活的标志物,与HSC增殖及肝纤维化程度呈正相关[11]。本实验肝纤维化模型大鼠的肝脏结构被破坏,汇管区、中央静脉、门静脉均有不同程度的纤维组织增生,肝脏组织中α-SMA阳性表达面积增加,COL Ⅰ、COL Ⅲ和COL Ⅳ mRNA表达水平升高。五灵胶囊新工艺和原工艺干预后,α-SMA的阳性表达面积较模型组降低,COL Ⅰ、COL Ⅲ和COL Ⅳ mRNA表达水平降低,说明五灵胶囊新工艺和原工艺均可通过抑制HSC活化和减少ECM沉积症改善肝纤维化。
肝脏受到CCl4慢性刺激后出现肝功能障碍,肝脏代谢功能降低,IL-1β、IL-6及TNF-α炎症因子释放增多,长期的炎症刺激是导致肝脏纤维化的重要原因。研究发现,肝纤维化的形成过程与通路下游的NF-κB信号转导因子有关[7, 12]。当受到上游刺激信号脂多糖、TNF-α、IL-1β及IL-6等作用时,NF-κB被激活进入核内启动基因转录,产生并释放细胞因子,使炎症反应级联放大。本实验考察了五灵胶囊对肝损伤大鼠肝脏NF-κB的影响,发现五灵胶囊优化工艺前后均可下调NF-κB mRNA的表达,说明抑制NF-κB信号通路可能为五灵胶囊抗肝纤维化的作用机制。
本实验结果证明五灵胶囊新工艺和原工艺均具有抗肝纤维化活性,其保护作用可能与降低炎症、抑制HSC活化和减少ECM沉积等有关。本实验中,五灵胶囊的抗纤维化作用未出现明显剂量关系,如五新和五原低、中剂量组的肝脏指数低于高剂量组,可能原因为肝脏是主要的药物代谢器官,高剂量能够有效调控肝纤维化相关基因表达的同时也因成分复杂加重了肝脏负担。从本实验结果看出,五新组ALP、IL-6、TNF-α、COL Ⅲ、NF-κB等指标低于水飞蓟素组,说明五灵胶囊新工艺在肝保护、抗炎等方面优于水飞蓟素阳性药组。五灵胶囊新工艺低、中、高剂量对血清ALT、AST、TBA、ALB、IL-1β、COL Ⅲ、COL Ⅳ等指标均有改善作用,而五灵胶囊原工艺仅部分剂量对上述指标有改善作用,说明五新组的作用效果优于五原组。另外,五新组血清TBA含量、肝脏α-SMA阳性表达面积比例以及肝脏COL Ⅲ mRNA表达量等指标均低于五原组,也说明新工艺的药效优于原工艺,提示实际生产中可以考虑用新工艺代替原工艺。
| [1] |
中华人民共和国国家药典委员会. 中华人民共和国药典[S]. 一部. 北京: 中国医药科技出版社, 2020: 644.
|
| [2] |
江艳艳, 王胜春, 蒋永培, 贺雪梅, 刘明义. 五灵胶囊对大鼠实验性肝纤维化的治疗作用[J]. 第四军医大学学报, 2001, 265-267. |
| [3] |
周晓元, 罗润齐, 万蕾, 王俊洁, 张宿荣, 许晓明, 等. 五灵胶囊联合恩替卡韦治疗慢性乙型肝炎的临床疗效[J]. 实用医学杂志, 2021, 37: 2939-2945. |
| [4] |
赵辉平, 王胜春, 胡咏武. 五灵胶囊对肝纤维化大鼠肝组织TGF-β/Smad及Ras/ERK信号通路蛋白的影响[J]. 胃肠病学和肝病学杂志, 2009, 18: 392-396. |
| [5] |
蒋永培, 田卫斌, 刘明义, 李剑峰. 五灵胶囊对实验性肝硬化大鼠的影响[J]. 中国药房, 2001, 12: 19-20. |
| [6] |
惠玉晶, 于金高, 唐志书, 王梅, 宋忠兴, 刘红娜, 等. 不同制备工艺条件下五灵胶囊对肝郁脾虚挟瘀证大鼠的治疗作用比较研究[J]. 中国中药杂志, 2022, 47: 6380-6390. |
| [7] |
ABDELGHFFAR E A, OBAID W A, ALAMOUDI M O, MOHAMMEDSALEH Z M, ANNAZ H, ABDELFATTAH M A O, et al. Thymus fontanesii attenuates CCl4-induced oxidative stress and inflammation in mild liver fibrosis[J/OL]. Biomed Pharmacother, 2022, 148: 112738. DOI: 10.1016/j.biopha.2022.112738.
|
| [8] |
GE H, WANG A, SU Y, YU C L, GAO L, LI Y X. Ameliorative effects of Qingganjiuwei powder, a traditional Mongolian medicine, against CCl4-induced liver fibrosis in rats[J/OL]. J Ethnopharmacol, 2021, 264: 113226. DOI: 10.1016/j.jep.2020.113226.
|
| [9] |
ACHARYA P, CHOUHAN K, WEISKIRCHEN S, WEISKIRCHEN R. Cellular mechanisms of liver fibrosis[J/OL]. Front Pharmacol, 2021, 12: 671640. DOI: 10.3389/fphar.2021.671640.
|
| [10] |
KISSELEVA T, BRENNER D. Molecular and cellular mechanisms of liver fibrosis and its regression[J]. Nat Rev Gastroenterol Hepatol, 2021, 18: 151-166. |
| [11] |
DENG X, XIE S, ZOU Y. Downregulation of syndecan1 expression induces activation of hepatic stellate cells via the TGFβ1/Smad3 signaling pathway[J]. Mol Med Rep, 2019, 20: 368-374. |
| [12] |
LUEDDE T, SCHWABE R F. NF-κB in the liver—linking injury, fibrosis and hepatocellular carcinoma[J]. Nat Rev Gastroenterol Hepatol, 2011, 8: 108-118. |
 2022, Vol. 43
2022, Vol. 43


