2. 海军军医大学(第二军医大学)基础医学院生物化学与分子生物学教研室,上海 200433
2. Department of Biochemistry and Molecular Biology, College of Basic Medical Sciences, Naval Medical University (Second Military Medical University), Shanghai 200433, China
岩沙海葵毒素(palytoxin,PLTX)是已知毒性最强、结构最复杂的非肽类天然生物毒素之一,对小鼠的半数致死剂量为150 ng/kg[1],仅次于刺尾鱼毒素。其分子式为C129H223N3O54,分子量为2 660~2 680[2],由若干不饱和脂肪链和环醚单元构成,含有64个手性中心。1971年,Moore和Scheuer[3]首次从一种夏威夷软珊瑚中分离出PLTX,但直到1994年才首次被化学合成[4]。
PLTX主要在软珊瑚(Palythoa和Zoanthus)、甲藻(Ostreopsis)及蓝藻(Trichodesmium)等体内产生,并通过食物链富集到鱼类、甲壳类、棘皮类(海胆、海星类)和软体动物(腹足类、双壳类和头足类)等海洋生物体内[5]。PLTX中毒事件通常有4种接触途径:口服接触、皮肤接触、吸入接触和眼部接触。至今,在热带和亚热带地区已经报道了多起因食用受PLTX污染的鱼或蟹而致命的食物中毒事件[6-10]。在温带地区,浮游植物可能在海洋沿岸水域发生具有季节性、区域性和物种特异性的水华,其间吸入海洋气溶胶或皮肤暴露于海水可导致沿海人群发生PLTX中毒[11-12]。此外,水族馆管理员或珊瑚爱好者在处理或接触珊瑚的过程中,PLTX可以通过气溶胶或皮肤接触等形式被人体吸收导致呼吸系统疾病或皮炎[13-14]。受污染的液体、气溶胶、灰尘或皮肤等可以通过接触眼部进入人体,导致角膜损伤甚至角膜穿孔[15]。
目前研究表明,PLTX作用靶点主要是钠钾泵,其通过将钠钾泵转化为单价阳离子的非特异性离子通道,允许离子的被动流动,改变细胞内外的离子浓度而发挥强大的生物活性[16]。PLTX也作用于肌质网钙泵,可增加细胞内钙浓度并降低细胞内的酸碱度,同时钙离子是重要的第二信使,干扰钙离子的正常转运可能会影响细胞骨架的正常功能,导致肌动蛋白微丝扭曲,诱发细胞的程序性死亡[17]。此外,PLTX是一种强有力的肿瘤促进剂,可引发非程序性细胞死亡,呈现许多癌性坏死的特征[17]。
近年来,科学家发现单链DNA或RNA寡核苷酸能够折叠成特定三维结构,高特异性、高亲和力地结合靶分子,这些寡核苷酸称为核酸适配体。核酸适配体是通过指数富集的配体系统进化技术(systematic evolution of ligands by exponential enrichment,SELEX)从单链DNA或RNA寡核苷酸文库中筛选出的能够特异性地与靶分子结合的功能性核苷酸序列。适配体类似于抗体,能够结合不同靶分子,与抗体相比具有如下优势[18-19]:(1)具有更高的亲和力和特异性;(2)于体外合成而不经过动物实验,且合成迅速便捷,价格低廉,生产批次差异小;(3)分子量小(12 000~30 000),免疫原性低,不易引发免疫反应;(4)结合靶分子范围广,包括整个细胞、大分子的蛋白质复合物和小分子的无机物及有机物等,最低可与分子量约为60的靶分子结合;(5)可进行多种化学修饰,使半衰期延长、具有核酸酶抗性和改善药代动力学等,以提升适配体体内稳定性和生物多样性;(6)体外稳定性高,对温度和pH不敏感,可被核酸酶降解,便于保存并用以制作各类试剂及试纸。以上这些特性使适配体成为广泛应用的理想候选物,如疾病诊断与治疗、生物传感器设计、纳米治疗、分子成像,以及从复杂混合物中纯化特定目标分子等。
研究显示,PLTX可以通过强的氢键和静电作用在DNA模型的S型槽顶稳定结合,这为核酸适配体在PLTX检测中的应用奠定了基础[20],同时也表明适配体在治疗PLTX引发的中毒事件中可能具有潜在价值。为探究适配体在PLTX治疗和防护领域的应用价值,本研究利用细胞毒性实验比较了PLTX对小鼠胚胎成纤维细胞株NIH-3T3、仓鼠卵巢细胞亚株CHO-K1及人永生化角质形成细胞株HaCaT的毒性作用及适配体对PLTX细胞毒性的拮抗作用,此外利用红细胞溶血实验检测PLTX对绵羊红细胞的溶血作用及适配体对PLTX溶血活性的抑制作用。
1 材料和方法 1.1 研究对象NIH-3T3细胞、CHO-K1细胞和HaCaT细胞均购于武汉大学中国典型培养物保藏中心。
1.2 适配体、试剂与仪器在基于SELEX筛选得到序列(5'-ACCGACCGTGCTGGACTCA-N42-ACTATGAGCGAGCCTGGCG-3')[21-22]的基础上进行优化,获得的适配体13-S3委托生工生物工程(上海)股份有限公司合成。细胞活性与增殖检测试剂盒购自上海和元生物技术股份有限公司,F-12K培养基、FBS、胰蛋白酶购自美国Gibco公司,DMEM培养基购自美国HyClone公司,改良型RPMI 1640培养基购自美国Thermo公司。PLTX(批号1908YA1)购自日本富士胶片和光纯药株式会社。Multiskan FC酶标仪购自美国Thermo公司。
1.3 细胞培养NIH-3T3细胞培养在含10% FBS的DMEM培养基中,CHO-K1细胞培养在含10% FBS的F-12K培养基中,HaCaT细胞培养在含10% FBS的改良型RPMI 1640培养基中,细胞培养条件均为37 ℃、5% CO2。
1.4 PLTX对不同细胞的细胞毒性实验在96孔板中加入100 μL细胞悬液(5 000个/100 μL)。将培养板置于培养箱中预培养24 h,向培养板各孔中加入PLTX至终浓度分别为9.3×10-4、9.3×10-3、9.3×10-2、9.3×10-1、9.3、93.3 nmol/L,再将培养板置于培养箱中孵育24 h;每孔加入20 μL CCK-8溶液(此时每孔溶液200 μL),将培养板置于培养箱中孵育1~2 h。用酶标仪测定450 nm处的光密度值。
1.5 适配体对细胞毒性的拮抗作用实验适配体13-S3的预处理:将所使用的适配体13-S3用筛选缓冲液溶解,-20 ℃冻存。使用时配制成相应浓度,95 ℃变性15 min,骤冷10 min。室温下溶解后按照1∶1的比例与相应浓度的PLTX溶液混合,涡旋振荡后孵育15 min备用。向96孔板中加入100 μL细胞悬液(5 000个/100 μL),将培养板置于培养箱中预培养24 h,向培养板各孔中加入不同浓度的PLTX+适配体13-S3混合液,将培养板置于培养箱中孵育24 h;每孔加入20 μL CCK-8溶液(此时每孔溶液200 μL),再将培养板置于培养箱中孵育1~2 h。用酶标仪测定450 nm处的光密度值。
1.6 PLTX的红细胞溶血实验用移液器取2%绵羊红细胞(上海语纯生物科技有限公司)350 µL分装到1.5 mL EP管中,3 000×g离心5 min,弃上清,加入筛选缓冲液吹打混匀,3 000×g离心5 min,反复洗涤3次,最后用筛选缓冲液定容至350 µL(红细胞密度约为1×106个/mL)。控制组加入筛选缓冲液,阳性组加入Triton X-100溶液,实验组加入终浓度分别为5、10、15、20、25 nmol/L的PLTX溶液,分别定容至700 µL,吹打混匀,25 ℃旋转孵育6 h。将孵育液3 000×g离心5 min,取200 µL上清液于96孔板中,用酶标仪测定578 nm处的光密度值,计算红细胞溶血率。
1.7 适配体对PLTX红细胞溶血活性的抑制实验用移液器取2%绵羊红细胞350 µL分装到1.5 mL EP管中,3 000×g离心5 min,弃上清;加入筛选缓冲液吹打混匀,3 000×g离心5 min,反复洗涤3次,最后用筛选缓冲液定容至350 µL(红细胞密度约为1×106个/mL)。以节球藻毒素-R(nodularin-R,NOD-R)特异作用的适配体N7-T[23]做对照,检测适配体13-S3对PLTX是否具有特异性抑制溶血作用。取适配体溶液,95 ℃变性15 min,骤冷10 min,将PLTX、适配体混合物按1∶1比例配制,在旋转混匀仪上孵育15 min。控制组加入筛选缓冲液,阳性组加入Triton X-100溶液,PLTX对照组加入终浓度为12.5 nmol/L的PLTX溶液,适配体对照组加入终浓度为12.5 nmol/L的PLTX+适配体N7-T混合液,实验组加入终浓度为12.5 nmol/L的PLTX+适配体13-S3混合液,分别定容至700 µL,吹打混匀,25 ℃旋转孵育6 h。将孵育液3 000×g离心5 min,取200 µL上清至96孔板中,用酶标仪测定578 nm处的光密度值,计算红细胞溶血率。
1.8 统计学处理应用SPSS 25软件进行统计学分析。计量资料以x±s表示,不同PLTX浓度下PLTX组与PLTX+适配体混合液组的数据比较采用配对t检验。检验水准(α)为0.05。
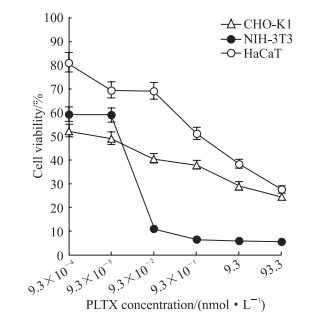
2 结果 2.1 PLTX对不同细胞的细胞毒性作用镜下观察可见,PLTX抑制了细胞增殖,诱导细胞皱缩变圆(图 1)。结果(图 2)表明,CHO-K1细胞的IC50约为(3.95±0.78)×10-3 nmol/L,NIH-3T3细胞的IC50约为(5.18±1.92)×10-3 nmol/L,HaCaT细胞的IC50约为(1.24±0.93)nmol/L。在9.3×10-4~93.3 nmol/L浓度范围的PLTX中,HaCaT细胞存活率随着PLTX浓度的变化具有较好的梯度响应,因此选用HaCaT细胞进行后续适配体保护实验。

|
图 1 PLTX对CHO-K1细胞、NIH-3T3细胞和HaCaT细胞的作用(40×) Fig 1 Effects of PLTX on CHO-K1 cells, NIH-3T3 cells, and HaCaT cells (40×) PLTX: Palytoxin. |
|
图 2 PLTX对CHO-K1细胞、NIH-3T3细胞、HaCaT细胞的细胞毒性作用 Fig 2 Cytotoxicity of PLTX on CHO-K1 cells, NIH-3T3 cells, and HaCaT cells n=3, x±s. PLTX: Palytoxin. |
2.2 适配体对PLTX致HaCaT细胞损伤的抑制作用
由图 3可见,与PLTX对照组相比,各浓度PLTX+适配体13-S3组HaCaT细胞存活率均升高(P均<0.05),表明适配体13-S3对PLTX作用于HaCaT细胞的毒性作用具有拮抗作用,可以抑制PLTX所致的HaCaT细胞损伤。

|
图 3 适配体对PLTX作用于HaCaT细胞细胞毒性的拮抗作用 Fig 3 Antagonistic effect of aptamer against cytotoxicity of PLTX on HaCaT cells *P < 0.05 vs PLTX control group. n=3, x±s. PLTX: Palytoxin. |
2.3 PLTX对红细胞具有溶血作用
溶血实验结果显示5、10、15、20、25 nmol/L浓度的PLTX对绵羊红细胞作用6 h后的溶血率分别为(82.55±2.10)%、(88.19±2.31)%、(88.22±1.02)%、(90.37±3.50)%、(91.21±0.87)%,表明PLTX具有明显的溶血活性,且其溶血作用随PLTX浓度的升高而增大。
2.4 适配体对PLTX溶血活性的抑制作用PLTX对照组溶血率为(91.09±0.23)%,而PLTX+适配体13-S3组溶血率为(4.53±0.08)%,PLTX+适配体N7-T组溶血率为(8.66±0.16)%,其中PLTX+适配体13-S3组溶血率下降更明显(P<0.05),表明适配体13-S3能够特异性抑制PLTX的溶血活性。
3 讨论人类大多数PLTX中毒事件是由于食用有毒海鲜引起的,还可以通过吸入和皮肤途径引起中毒反应。目前,PLTX中毒缺乏特异性治疗的药物,严重时可导致死亡,通常采用对症治疗和支持治疗:口服中毒者用洗胃、利尿、人工呼吸和补液等方法治疗;吸入或皮肤接触中毒者用皮质类固醇、非甾体抗炎药、组胺拮抗剂、雾化β-激动剂和/或氧气疗法来缓解症状[24]。PLTX是一种极强的冠状动脉收缩剂,可导致进行性心肌缺血、心室颤动或心脏骤停,尽管动物实验表明血管扩张剂如罂粟碱和硝酸异山梨酯可以用作解毒剂,但只有中毒后立即注射入心脏才能发挥解毒作用[25]。因此,对PLTX中毒事件的预防和治疗非常重要。
欧洲食品安全署建议PLTX在贝类中的含量上限为30 mg/kg,目前PLTX主要的检测方法包括小鼠生物检测法、细胞毒性实验和酶联免疫法等,急需特异度和灵敏度更好的检测方法。核酸适配体技术是一项新兴的检测技术,已被广泛用于生物医学领域。适配体介导的分子识别具有高特异性,能区分细微的分子差异,如急性髓系白血病细胞体外诊断[26]。2017年,Gao等[22]将PLTX固定在生物传感器表面,用HRP标记的核酸适配体作为生物识别受体与PLTX竞争性结合,并利用生物膜干涉技术进行检测。该方法具有实时、灵敏、快速的特点,为定量、定性检测食物中的PLTX提供了新方向。
此外,核酸适配体本身也已经被开发作为治疗剂,例如哌加他尼(pegaptanib)是一种对血管内皮生长因子(vascular endothelial growth factor,VEGF)165亚型具有特异性的RNA适配体,可以抑制VEGF促进血管生成、增加血管渗透性及刺激炎症反应等,用于治疗与眼部新生血管相关的年龄相关性黄斑变性和糖尿病性黄斑水肿[27-28]。为探究核酸适配体在PLTX治疗和防护领域的应用价值,本实验参考既往研究选取了NIH-3T3细胞、CHO-K1细胞、HaCaT细胞进行PLTX细胞毒性实验和核酸适配体保护实验。
本研究使用的核酸适配体13-S3与PLTX有较高的亲和力,基于适配体与PLTX能够特异性结合,适配体能够抑制PLTX对HaCaT细胞的细胞毒性作用。原因可能由于HaCaT细胞对9.3×10-4~93.3 nmol/L浓度梯度的PLTX响应性较好,也可能由于HaCaT细胞是角质形成细胞,在PLTX刺激下释放促炎介质(1×10-2 nmol/L)[29]影响了适配体的活性,此外基因表观遗传学的修饰也可能影响HaCaT细胞对PLTX的反应性。
由于PLTX的溶血活性,分光光度溶血实验被广泛用于检测不同基质中的PLTX[30],本研究利用PLTX对绵羊红细胞的溶血作用评价细胞水平适配体对PLTX的拮抗作用。在抑制PLTX对绵羊红细胞溶血的实验中,对核酸适配体进行高温水浴后快速冷却,淬火后适配体呈一定二级结构,更有利于适配体与PLTX结合,实验结果表明在12.5 nmol/L浓度PLTX+适配体(浓度比例为1∶1)处理6 h的条件下适配体能够有效抑制PLTX对绵羊红细胞的溶血活性,起到细胞保护作用。
| [1] |
PATOCKA J, GUPTA R C, WU Q H, KUCA K. Toxicpotential of palytoxin[J]. J Huazhong Univ Sci Technolog Med Sci, 2015, 35: 773-780. DOI:10.1007/s11596-015-1506-3 |
| [2] |
MOORE R E. Structure of palytoxin[J]. Fortschr Chem Org Naturst, 1985, 48: 81-202. |
| [3] |
MOORE R E, SCHEUER P J. Palytoxin: a new marine toxin from a coelenterate[J]. Science, 1971, 172: 495-498. DOI:10.1126/science.172.3982.495 |
| [4] |
SUH E M, KISHI Y. Synthesis of palytoxin from palytoxin carboxylic acid[J]. J Am Chem Soc, 1994, 116: 11205-11206. DOI:10.1021/ja00103a065 |
| [5] |
ALIGIZAKI K, KATIKOU P, MILANDRI A, DIOGÈNE J. Occurrence of palytoxin-group toxins in seafood and future strategies to complement the present state of the art[J]. Toxicon, 2011, 57: 390-399. DOI:10.1016/j.toxicon.2010.11.014 |
| [6] |
WU M L, YANG C C, DENG J F, WANG K Y. Hyperkalemia, hyperphosphatemia, acute kidney injury, and fatal dysrhythmias after consumption of palytoxin-contaminated goldspot herring[J]. Ann Emerg Med, 2014, 64: 633-636. DOI:10.1016/j.annemergmed.2014.06.001 |
| [7] |
NOGUCHI T, HWANG D F, ARAKAWA O, DAIGO K, SATO S, OZAKI H, et al. Palytoxin as the causative agent in the parrotfish poisoning[J/OL]. Toxicon, 1988, 26: 34. DOI: 10.1016/0041-0101(88)90083-9.
|
| [8] |
ALCALA A C, ALCALA L C, GARTH J S, YASUMURA D, YASUMOTO T. Human fatality due to ingestion of the crab Demania reynaudii that contained a palytoxin-like toxin[J]. Toxicon, 1988, 26: 105-107. DOI:10.1016/0041-0101(88)90142-0 |
| [9] |
ONUMA Y, SATAKE M, UKENA T, ROUX J, CHANTEAU S, RASOLOFONIRINA N, et al. Identification of putative palytoxin as the cause of clupeotoxism[J]. Toxicon, 1999, 37: 55-65. DOI:10.1016/S0041-0101(98)00133-0 |
| [10] |
TANIYAMA S, MAHMUD Y, TERADA M, TAKATANI T, ARAKAWA O, NOGUCHI T. Occurrence of a food poisoning incident by palytoxin from a serranid Epinephelus sp. in Japan[J]. J Nat Toxins, 2002, 11: 277-282. |
| [11] |
SILVA M, PRATHEEPA V K, BOTANA L M, VASCONCELOS V. Emergent toxins in North Atlantic temperate waters: a challenge for monitoring programs and legislation[J]. Toxins (Bsel), 2015, 7: 859-885. DOI:10.3390/toxins7030859 |
| [12] |
CIMINIELLO P, DELL'AVERSANO C, FATTORUSSO E, FORINO M, MAGNO G S, TARTAGLIONE L, et al. The Genoa 2005 outbreak. Determination of putative palytoxin in mediterranean Ostreopsis ovata by a new liquid chromatography tandem mass spectrometry method[J]. Anal Chem, 2006, 78: 6153-6159. DOI:10.1021/ac060250j |
| [13] |
CHANG E, DEEDS J, SPAETH K. A case of long-term neurological and respiratory sequelae of inhalational exposure to palytoxin[J]. Toxicon, 2020, 186: 1-3. DOI:10.1016/j.toxicon.2020.07.018 |
| [14] |
HAMADE A K, DEGLIN S E, MCLAUGHLIN J B, DEEDS J R, HANDY S M, KNOLHOFF A M. Suspected palytoxin inhalation exposures associated with zoanthid corals in aquarium shops and homes—Alaska, 2012-2014[J]. MMWR Morb Mortal Wkly Rep, 2015, 64: 852-855. DOI:10.15585/mmwr.mm6431a4 |
| [15] |
BARRETT R T, HASTINGS J P, RONQUILLO Y C, HOOPES P C, MOSHIRFAR M. Coral keratitis: case report and review of mechanisms of action, clinical management and prognosis of ocular exposure to palytoxin[J]. Clin Ophthalmol, 2021, 15: 141-156. DOI:10.2147/OPTH.S290455 |
| [16] |
WU C H. Palytoxin: membrane mechanisms of action[J]. Toxicon, 2009, 54: 1183-1189. DOI:10.1016/j.toxicon.2009.02.030 |
| [17] |
LOUZAO M C, ARES I R, CAGIDE E, ESPIÑA B, VILARIÑO N, ALFONSO A, et al. Palytoxins and cytoskeleton: an overview[J]. Toxicon, 2011, 57: 460-469. DOI:10.1016/j.toxicon.2010.09.017 |
| [18] |
ALI M H, ELSHERBINY M E, EMARA M. Updates on aptamer research[J/OL]. Int J Mol Sci, 2019, 20: E2511. DOI: 10.3390/ijms20102511.
|
| [19] |
BANERJEE J, NILSEN-HAMILTON M. Aptamers: multifunctional molecules for biomedical research[J]. J Mol Med (Berl), 2013, 91: 1333-1342. DOI:10.1007/s00109-013-1085-2 |
| [20] |
HU B, ZHOU R, LI Z G, OUYANG S Q, LI Z, HU W, et al. Study of the binding mechanism of aptamer to palytoxin by docking and molecular simulation[J]. Sci Rep, 2019, 9: 15494. DOI:10.1038/s41598-019-52066-z |
| [21] |
高顺祥, 郑欣, 胡波, 刘德婧, 孙铭娟, 焦炳华, 等. 与岩沙海葵毒素特异性结合的高亲和力适配体及其应用: 105647931B[P]. 2019-02-01.
|
| [22] |
GAO S X, ZHENG X, HU B, SUN M J, WU J H, JIAO B H, et al. Enzyme-linked, aptamer-based, competitive biolayer interferometry biosensor for palytoxin[J]. Biosens Bioelectron, 2017, 89(Pt 2): 952-958. |
| [23] |
OUYANG S Q, HU B, ZHOU R, LIU D J, PENG D F, LI Z G, et al. Rapid and sensitive detection of nodularin-R in water by a label-free BLI aptasensor[J]. Analyst, 2018, 143: 4316-4322. DOI:10.1039/C8AN00567B |
| [24] |
TUBARO A, SOSA S, HUNGERFORD J. Toxicology and diversity of marine toxins[M]. Amsterdam: Elsevier, 2012: 896-934.
|
| [25] |
VICK J A, WILES J S. The mechanism of action and treatment of palytoxin poisoning[J]. Toxicol Appl Pharmacol, 1975, 34: 214-223. DOI:10.1016/0041-008X(75)90026-5 |
| [26] |
徐康力, 马亚妮, 王筱金, 苗彦彦, 韩达, 谭蔚泓. 核酸适配体sgc8在急性白血病诊断中的应用研究[J]. 上海交通大学学报(医学版), 2020, 40: 1158-1167, 1157. |
| [27] |
NG E W M, ADAMIS A P. Anti-VEGF aptamer (pegaptanib)therapy for ocular vascular diseases[J]. Ann N Y Acad Sci, 2006, 1082: 151-171. DOI:10.1196/annals.1348.062 |
| [28] |
ZHU G Z, CHEN X Y. Aptamer-based targeted therapy[J]. Adv Drug Deliv Rev, 2018, 134: 65-78. |
| [29] |
PELIN M, FLORIO C, PONTI C, LUCAFÒ M, GIBELLINI D, TUBARO A, et al. Pro-inflammatory effects of palytoxin: an in vitro study on human keratinocytes and inflammatory cells[J]. Toxicol Res (Camb), 2016, 5: 1172-1181. |
| [30] |
BROVEDANI V, SOSA S, POLI M, FORINO M, VARELLO K, TUBARO A, et al. A revisited hemolytic assay for palytoxin detection: limitations for its quantitation in mussels[J]. Toxicon, 2016, 119: 225-233. |
 2022, Vol. 43
2022, Vol. 43


