2. 福建省血液病研究所,福建医科大学附属协和医院血液科,福州 350001;
3. 广东医科大学基础医学院解剖学教研室,东莞 523808
2. Fujian Institute of Hematology, Department of Hematology, Fujian Medical University Union Hospital, Fuzhou 350001, Fujian, China;
3. Department of Anatomy, School of Basic Medicine, Guangdong Medical University, Dongguan 523808, Guangdong, China
多毛细胞白血病(hairy cell leukemia,HCL)是一种临床罕见的惰性B淋巴细胞增殖性肿瘤,约占所有淋系白血病的2%,其典型特征是全血细胞减少症伴脾肿大。HCL最早由Bouroncle等[1]于1958年首次报道。HCL常见于中老年男性,中位发病年龄为55~60岁,男女比例约为(4~5)∶1; HCL细胞常表达CD11c、CD22、CD20、CD25、CD103等抗原,且表达特异性抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TRAP)及膜联蛋白A1(annexin A1); 此外,B-Raf原癌基因丝氨酸/苏氨酸蛋白激酶V600E突变型(B-Raf proto-oncogene,serine/threonine kinase V600E mutant type,BRAFV600E)突变是HCL的典型分子标志物,但HCL的致病机制目前仍尚未明确[2]。本研究回顾性分析了福建医科大学附属协和医院近5年收治的11例HCL患者的临床资料及预后转归情况,以期为HCL的诊治提供借鉴与参考。
1 资料和方法 1.1 临床资料回顾性分析2016年1月至2021年2月福建医科大学附属协和医院收治的11例HCL患者的临床资料,患者均根据美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)HCL诊疗指南[3]予以诊断,均在院完善骨髓常规(或外周血)流式细胞术免疫分型、病理免疫组织化学染色等检查。纳入标准:(1)临床表现符合惰性B淋巴细胞白血病,且为入院后新诊断的HCL,未在外院接受过任何临床干预手段治疗; (2)经外周血涂片、骨髓常规(细胞化学染色)、骨髓病理活检、流式细胞术免疫分型及分子生物学检查等血液病经典诊断手段予以明确的初诊HCL。排除标准:(1)仅经门诊骨髓穿刺术后初步考虑为HCL并未收治入院者; (2)由其他恶性血液疾病转化的HCL; (3)既往合并其他恶性肿瘤病史(复合癌或多重癌); (4)复发HCL; (5)治疗相关(化疗后或移植后)HCL; (6)临床病史资料严重缺失的HCL患者。
1.2 治疗方案纳入研究的11例患者中,除1例患者采用FC方案(氟达拉滨50 mg第1~3天; 环磷酰胺0.3 g第1~3天)及1例患者第1个疗程采用R-CVP方案(利妥昔单抗500 mg第1天; 环磷酰胺1.1 g第2天; 长春地辛4 mg第2天; 地塞米松15 mg第1~5天)后改为克拉屈滨以外,其余9例患者均接受克拉屈滨单药(1.4 mg/kg,每天1次,持续24 h输注,第1~5天)治疗。患者化疗周期内2~3 d复查1次血常规、肝肾功能等,若出现发热等感染症状,第一时间完善病原学检测及胸部CT等检查,根据临床症状及辅助检查结果积极予输血、粒细胞集落刺激因子升白细胞、抗感染、改善循环等对症支持治疗。
1.3 疗效评价参考最新HCL国际诊疗指南[3],在患者接受治疗6个月后进行疗效评价,疗效分为完全缓解(complete remission,CR)、部分缓解(partial remission,PR)、病情稳定(stable disease,SD)、病情进展(progressive disease,PD)及复发。CR标准:(1)血常规各项指标接近正常,血红蛋白(hemoglobin,HGB)>110 g/L(不输血前提下),血小板计数(platelet count,PLT)>100×109/L,绝对中性粒细胞计数(absolute neutrophil count,ANC)>1.5×109/L; (2)脾脏缩小至正常大小; (3)外周血及骨髓中均未见毛细胞。PR标准:(1)血常规各项指标接近正常; (2)脾脏缩小至少50%; (3)骨髓检查毛细胞浸润至少改善50%。SD标准:各项指标未达到CR、PR标准。PD标准:与治疗前相比,脾脏体积继续增大或血细胞三系(HGB和/或PLT和/或ANC)下降25%,需排除化疗后骨髓抑制。复发通常是指外周血和/或骨髓检查再次出现毛细胞但无血液学复发证据。血液学复发则为血细胞三系再次低于CR或PR标准下限。最后,临床未确定的CR和PR则是未复查骨髓检查但血常规恢复正常范围、符合CR和PR的其余疗效标准。
1.4 预后随访采用电子住院病历系统跟进患者最近返院复查的指标及住院治疗情况,同时以电话联络的方式进行随访,随访截至日期为2021年7月1日。总生存期(overall survival,OS)定义为从患者确诊之日起至患者发生死亡或失访(随访终点)的间隔时间; 无进展生存期(progression-free survival,PFS)定义为患者开始进行标准方案治疗之日起至任何因素所致疾病进展或发生死亡的间隔时间。
1.5 统计学处理应用SPSS 20.0软件进行数据处理。计量资料以中位数(范围)表示,计数资料以例数和百分数表示。
2 结果 2.1 HCL患者的临床特征本研究纳入的11例HCL患者中男7例、女4例,确诊时中位年龄为57(30~81)岁,从出现临床症状或体征到诊断的中位时间为5.0(0.5~26.0)个月。均为初诊患者,均未行脾切除或干扰素治疗。诊断时临床表现为乏力6例,出血(牙龈出血、皮肤黏膜出血等)4例,伴有感染症状7例(均为肺部感染),出现淋巴瘤B症状(即发热、盗汗、体重减低)6例,淋巴结肿大3例。所有患者均伴有不同程度的脾肿大,其中轻度脾大3例、中度脾大2例、巨脾6例。见表 1。
|
|
表 1 11例HCL患者的临床特征 |
2.2 HCL实验室检查
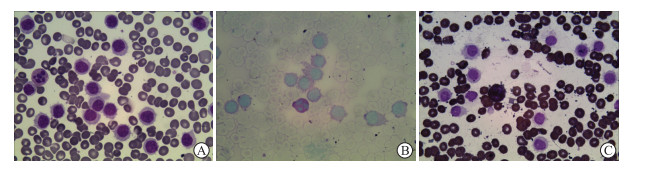
11例患者外周血常规示两系减少4例(36.36%),三系减少7例(63.64%),单核细胞减少9例(81.82%)。所有患者均完善骨髓形态学检查,镜下可见典型毛细胞(图 1),此类毛细胞体积较正常淋巴细胞略大,细胞质丰富呈淡蓝色,边缘可见呈纤毛样、伪足样凸起。骨髓纤维化程度:0级4例、1级6例、2级1例。11例患者均行一代或二代基因测序检测,BRAFV600E突变阳性率为81.82%(9/11)。
|
图 1 HCL骨髓细胞形态学检查(400×) A:瑞氏-吉姆萨染色,可见典型毛发样凸起的毛细胞; B:高碘酸-希夫染色; C:过氧化物酶染色.HCL:多毛细胞白血病. |
2.3 流式细胞术免疫分型结果
5例患者行外周血流式细胞术检测,中位HCL细胞比例为23.21%(11.39%~33.24%); 另6例患者行骨髓细胞流式细胞术检测,中位HCL细胞比例为36.43%(13.22%~61.67%)。11例HCL患者流式细胞术免疫分型特征见表 2。
|
|
表 2 11例HCL患者流式细胞术免疫分型表达特征 |
2.4 治疗反应及疗效
11例患者中,1例患者采用FC方案治疗1个疗程后即获得CR,10例患者中采用克拉屈滨单疗程治疗7例、2个疗程治疗3例。4例患者在克拉屈滨治疗后1~3个月疗效评估为PR,其余6例患者4~12个月疗效评估达CR,这10例患者对克拉屈滨治疗的总体反应率为100.00%。
2.5 不良反应10例采用克拉屈滨治疗的患者在治疗后出现2~4级血液学不良反应,其中7例(63.64%,7/11)发生ANC减少,6例(54.55%,6/11)发生PLT减少,4例(36.36%,4/11)发生中性粒细胞缺乏伴发热,3例(27.27%,3/11)发生肺部感染或上呼吸道感染,伴随感染症状患者经抗感染及支持治疗后好转。除血液学不良反应外,无其他不良反应发生。
2.6 随访及预后分析11例HCL患者中位随访时间为14(3~61)个月; 中位OS与PFS均未达到; 随访期间,无患者发生PD、复发或死亡。
3 讨论HCL是一种源于成熟B细胞且临床罕见的慢性B细胞白血病/淋巴瘤,目前WHO将HCL归类为B细胞非霍奇金淋巴瘤[4-5]。HCL常见于中老年男性,大多数患者有不同程度的血细胞减少和脾脏肿大并伴有感染、出血等症状,HCL在形态学上具有典型特征[6]:HCL细胞中等大小,呈肾形核,具有中等丰富的淡蓝色细胞质,染色质开放,核仁缺失以及伴有特征性锯齿状细胞质边界,呈现“毛发样”凸起。本研究所有患者均已完善骨髓形态学检查,镜下可观察到典型的HCL形态学特征,对于患者后续诊疗提供了确切证据。
早在2008年,WHO根据免疫表型、分子生物学特征等将HCL分为经典型HCL(classic hairy cell leukemia,cHCL)和变异型HCL(hairy cell leukemia variant,HCLv)。一般而言,外周血提示单核细胞减少是cHCL的特异表现[7],且相关研究表明,cHCL患者易出现骨髓穿刺术难度增大(如骨髓“干抽”)情况[8],而纳入本研究的所有患者入院时均已完善骨髓穿刺术,其中7例患者进行骨髓穿刺术时出现骨髓“干抽”情况,查阅相关病史资料,上述7例患者外周血单核细胞计数均低于正常下限且伴BRAFV600E突变,为cHCL患者,与既往研究[7-8]结论基本一致。cHCL细胞免疫表型常表达CD19、CD20、CD11c、CD25、CD103、CD123及CD200,而CD27为阴性[9]。对于不表达CD5、CD10、CD25、CD123及Annexin A1的HCL,其为HCLv,通过抗原检测CD23、CD25、CD103、CD200及Annexin A1可有助于区分cHCL与HCLv。值得关注的是,HCLv是脾脏B细胞淋巴瘤/白血病下的一个独特实体,不能将其归类于脾脏弥漫性红髓小B细胞淋巴瘤[10]。绝大多数cHCL患者中存在特定突变BRAFV600E,而HCLv中不存在这种突变,当然,为避免出现假阴性结果,应优先选择高灵敏度的检测技术(如等位基因特异性聚合酶链反应或二代测序)予以鉴别。与cHCL相比,HCLv的CD103通常为阳性,其缺失提示脾边缘区淋巴瘤[9]。与此同时,HCLv常伴细胞遗传学异常,如肿瘤蛋白P53(tumor protein P53,TP53)突变、7q缺失及5号染色体扩增等,故HCLv具有高侵袭性、预后不良,对嘌呤类似物的敏感性低,复发率高于cHCL[11]。本研究中仅有2例患者BRAFV600E突变阴性,通过二代测序检出BRAFV600E突变阳性率为81.82%(9/11),与相关研究[12]的结论基本一致。
在明确诊断后,尽管绝大多数HCL患者需采取治疗手段,但仍有约10%的患者需等待有治疗指征时再予以治疗,此类患者过早采取治疗手段并未显现任何治疗性优势[13]。当然,亦有研究表明,为保证治疗的安全性和有效性,当HCL患者出现以下至少1项参数指标:HGB<110 g/L、PLT<100×109/L、ANC<1.0×109/L、严重感染伴全血细胞减少及中、重度脾肿大伴不适时,应及时给予嘌呤核苷类似物治疗,而对于一些轻、中度无症状,仅全血细胞减少的HCL患者可能无需治疗即可保持多年HCL疾病无进展[6]。通常,HCL对嘌呤核苷类似物(克拉屈滨和喷司他丁)敏感,已取代既往脾切除或干扰素等治疗手段,其单药或与抗CD20单克隆抗体(利妥昔单抗)联用可使临床疗效稳定并更易获得CR[14]。本研究中有7例患者入院时伴严重感染,且所有患者均伴有脾脏肿大不适等症状,故本研究中的11例患者都符合治疗指征。
本研究中有1例患者第1个疗程采用R-CVP方案(利妥昔单抗500 mg第1天; 环磷酰胺1.1 g第2天; 长春地辛4 mg第2天; 地塞米松15 mg第1~5天)治疗结束后改为克拉屈滨治疗,另有2例患者确诊HCL后因家庭经济或对疾病认知等因素未及时行克拉屈滨治疗,但后续返院接受治疗后亦获得满意的疗效。10例接受克拉屈滨单药治疗的患者对克拉屈滨治疗总体反应率为100.00%,表明HCL疾病进展较为缓慢且对克拉屈滨有较好的治疗反应。值得一提的是,氟达拉滨作为一种经典抗代谢类氟化嘌呤核苷类似物,其对慢性B淋巴细胞白血病已显现出良好的疗效,而HCL作为慢性小B细胞淋巴瘤的一种亚型,近年来国内外相关研究表明氟达拉滨单药或联合其他化疗药亦可使HCL患者获得缓解和长期生存[15-17]。本研究中1例患者采用FC方案(氟达拉滨50 mg第1~3天; 环磷酰胺0.3 g第1~3天)化疗1个疗程,除出现化疗后骨髓抑制所致感染等情况,余无特殊异常,后续多次返院复查骨髓评估为CR,表明FC方案亦对HCL患者有效。
现如今,新型抗重组免疫毒素——帕克莫单抗(moxetumomab pasudotox)对于复发难治HCL能够实现可检测残留病(measurable residual disease,MRD)阴性的CR,且无化疗毒性,并于2018年被美国FDA批准为鲁磨西替(lumoxiti)[18-19]。另外,口服非化疗手段的临床研究还包括靶向BRAFV600E±MAPK/ERK激酶的维罗非尼(vemurafenib)、达拉非尼(dabrafenib)或曲美替尼(trametinib),以及靶向布鲁顿酪氨酸激酶的依鲁替尼等[20],上述治疗手段或靶点可能为今后HCL疗效及预后带来新的希望。当然,对于HCL治疗评估而言,其包括血常规、查体(如评估脾脏大小)及骨髓常规与病理活检等。国外研究者认为,采用克拉屈滨治疗的HCL患者,其骨髓正常造血功能需要数个月时间才能恢复,故常建议患者骨髓活检复查应在治疗后的4~6个月进行[6],而国内学者则建议在克拉屈滨治疗后1年再评估患者治疗是否达疗效平台期[13]。目前,HCL应用克拉屈滨的疗效尚可,不良反应可控,可作为HCL理想的一线选择方案。
诚然,HCL是目前仍无法治愈的恶性血液肿瘤,但患者可在规范诊疗后达到病情稳定或长期生存。HCL患者在CR阶段的外周血细胞计数应接近正常值,即HGB>110 g/L(无输血),PLT>100×109/L和ANC>1.5×109/L。此外,通过查体或影像学手段检查脾脏肿大是否较前缩小或消退亦是长期预后的重要评估指标。当然,在疗程结束后超过3年时间,如形态学评估骨髓中的HCL特征性毛细胞消失,说明患者获得无MRD的CR。Paillassa等[21]开展了一项针对279例HCL患者的队列分析研究,该研究中位随访时间为10年,患者中位OS为27年,中位无复发生存期为11年,累计10年复发率为39%; 尽管HCL患者具有良好的长期预后,但并发第二肿瘤的风险相对增加。总之,本研究的HCL患者对克拉屈滨的治疗反应良好,未出现严重不良反应、死亡等不良事件,但其预后仍需长期随访及更为深入的研究。
| [1] |
BOURONCLE B A, WISEMAN B K, DOAN C A. Leukemic reticuloendotheliosis[J]. Blood, 1958, 13: 609-630. DOI:10.1182/blood.V13.7.609.609 |
| [2] |
KREITMAN R J. Hairy cell leukemia: present and future directions[J]. Leuk Lymphoma, 2019, 60: 2869-2879. DOI:10.1080/10428194.2019.1608536 |
| [3] |
WIERDA W G, BYRD J C, ABRAMSON J S, BHAT S, BOCIEK G, BRANDER D, et al. Hairy cell leukemia, Version 2.2018, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2017, 15: 1414-1427. DOI:10.6004/jnccn.2017.0165 |
| [4] |
KREITMAN R J, PASTAN I. Development of recombinant immunotoxins for hairy cell leukemia[J/OL]. Biomolecules, 2020, 10: 1140. DOI: 10.3390/biom10081140.
|
| [5] |
TROUSSARD X, CORNET E. Hairy cell leukemia 2018: update on diagnosis, risk-stratification, and treatment[J]. Am J Hematol, 2017, 2: 1382-1390. |
| [6] |
GREVER M R, ABDEL-WAHAB O, ANDRITSOS L A, BANERJI V, BARRIENTOS J, BLACHLY J S, et al. Consensus guidelines for the diagnosis and management of patients with classic hairy cell leukemia[J]. Blood, 2017, 129: 553-560. DOI:10.1182/blood-2016-01-689422 |
| [7] |
BIGORRA L, LARRIBA I, GUTIÉRREZ-GALLEGO R. The hairy cell leukaemia oxymoron: monocytotic monocytopenia[J/OL]. Clin Chem Lab Med, 2020, 59: e111-e115. DOI: 10.1515/cclm-2020-0253.
|
| [8] |
SAVEN A, BURIAN C, KOZIOL J A, PIRO L D. Long-term follow-up of patients with hairy cell leukemia after cladribine treatment[J]. Blood, 1998, 92: 1918-1926. DOI:10.1182/blood.V92.6.1918 |
| [9] |
KREITMAN R J, ARONS E. Update on hairy cell leukemia[J]. Clin Adv Hematol Oncol, 2018, 16: 205-215. |
| [10] |
SWERDLOW S H, CAMPO E, PILERI S A, HARRIS N L, STEIN H, SIEBERT R, et al. The 2016 revision of the World Health Organization classification of lymphoid neoplasms[J]. Blood, 2016, 127: 2375-2390. DOI:10.1182/blood-2016-01-643569 |
| [11] |
LIU Q, HARRIS N, EPPERLA N, ANDRITSOS L A. Current and emerging therapeutic options for hairy cell leukemia variant[J]. Onco Targets Ther, 2021, 14: 1797-1805. DOI:10.2147/OTT.S242247 |
| [12] |
SALAM L, ABDEL-WAHAB O. Hairy cell leukemia: update and current therapeutic approach[J]. Curr Opin Hematol, 2015, 22: 355-361. DOI:10.1097/MOH.0000000000000154 |
| [13] |
王婷玉, 李增军, 吕瑞, 傅明伟, 隋伟薇, 黄文阳, 等. 克拉屈滨治疗毛细胞白血病24例临床分析[J]. 中华血液学杂志, 2018, 39: 491-495. DOI:10.3760/cma.j.issn.0253-2727.2018.06.011 |
| [14] |
CHIHARA D, KANTARJIAN H, O'BRIEN S, JORGENSEN J, PIERCE S, FADERL S, et al. Long-term durable remission by cladribine followed by rituximab in patients with hairy cell leukaemia: update of a phase Ⅱ trial[J]. Br J Haematol, 2016, 174: 760-766. DOI:10.1111/bjh.14129 |
| [15] |
朱海霞, 李淑晨, 燕玮, 李旸, 张嵘, 姚鲲, 等. 福达拉滨联合环磷酰胺治疗多毛细胞白血病1例并文献复习[J]. 现代肿瘤医学, 2015, 23: 1451-1453. DOI:10.3969/j.issn.1672-4992.2015.10.38 |
| [16] |
GERRIE A S, ZYPCHEN L N, CONNORS J M. Fludarabine and rituximab for relapsed or refractory hairy cell leukemia[J]. Blood, 2012, 119: 1988-1991. DOI:10.1182/blood-2011-08-371989 |
| [17] |
潘登, 李艳. 氟达拉滨治疗初治多毛细胞白血病13例临床观察[J]. 疑难病杂志, 2013, 12: 149-150. |
| [18] |
ROBAK T, WOLSKA A, ROBAK P. Potential breakthroughs with investigational drugs for hairy cell leukemia[J]. Expert Opin Investig Drugs, 2015, 24: 1419-1431. DOI:10.1517/13543784.2015.1081895 |
| [19] |
KREITMAN R J, DEARDEN C, ZINZANI P L, DELGADO J, KARLIN L, ROBAK T, et al. Moxetumomab pasudotox in relapsed/refractory hairy cell leukemia[J]. Leukemia, 2018, 32: 1768-1777. DOI:10.1038/s41375-018-0210-1 |
| [20] |
TIACCI E, PARK J H, DE CAROLIS L, CHUNG S S, BROCCOLI A, SCOTT S, et al. Targeting mutant BRAF in relapsed or refractory hairy-cell leukemia[J]. N Engl J Med, 2015, 373: 1733-1747. DOI:10.1056/NEJMoa1506583 |
| [21] |
PAILLASSA J, CORNET E, NOEL S, TOMOWIAK C, LEPRETRE S, VAUDAUX S, et al. Analysis of a cohort of 279 patients with hairy-cell leukemia (HCL): 10 years of follow-up[J/OL]. Blood Cancer J, 2020, 10: 62. DOI: 10.1038/s41408-020-0328-z.
|
 2022, Vol. 43
2022, Vol. 43


