由严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)感染引起的新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)目前仍是全球面临的重大公共卫生挑战。SARS-CoV-2具有高度变异性,奥密克戎(omicron)变异株自2021年11月首次由南非报告后迅速取代德尔塔变异株成为全球主要流行毒株,其潜伏期缩短、传播能力大幅增强,但致病力有所减弱[1]。鼻咽拭子SARS-CoV-2核酸检测是COVID-19患者出院和解除隔离的重要判别标准,但临床实践发现不同病例、同一病例不同部位标本核酸阴转时间存在差异,部分病例解除隔离后出现复阳。既往研究发现,COVID-19患者多个部位标本中均可检测到SARS-CoV-2,其中下呼吸道标本如支气管肺泡灌洗液、深部咳痰标本检出率最高,粪便或肛拭子也可检测到存活SARS-CoV-2[2]。不同部位标本病毒清除差异的流行病学意义不同,对于军队、高校等人员聚集性场所,需要制定更严格的解除隔离标准以避免疫情扩散。目前关于奥密克戎变异株在不同部位标本中的存续时间研究较少,本研究采用实时荧光PCR对217例奥密克戎BA.2变异株感染患者的鼻咽拭子、痰液、肛拭子进行了1 159例次SARS-CoV-2核酸检测,拟分析不同部位标本的核酸阴转时间及其影响因素,从而为疫情防控策略的制订提供更充足的依据。
1 资料和方法 1.1 研究对象序贯入组2022年3月27日至6月7日海军军医大学(第二军医大学)第一附属医院收治的SARS-CoV-2奥密克戎BA.2变异株感染患者217例。纳入标准:(1)年龄≥18岁;(2)诊断标准、临床分型及解除隔离标准严格参照国家卫生健康委员会颁布的《新型冠状病毒肺炎诊疗方案(试行第九版)》[3]执行;(3)病毒株经基因测序确认为奥密克戎BA.2变异株;(4)同意进行多样本病毒核酸采样。排除标准:(1)SARS-CoV-2核酸复阳患者;(2)服用免疫抑制剂的患者。本研究通过海军军医大学(第二军医大学)第一附属医院伦理委员会审批(CHEC2022-055)。
1.2 临床资料收集收集所有研究对象的性别、年龄、身高、体重、既往病史、临床症状、诊断分型、治疗药物等人口学资料和临床资料。核酸阴转时间定义为首次SARS-CoV-2核酸阳性至首次出现连续2次阴性或SARS-CoV-2基因组中开放阅读框1ab(open reading frame 1ab,ORF1ab)和核衣壳蛋白(nucleocapsid protein,N)基因的循环阈值数(cycle threshold,Ct值)均≥35(实时荧光PCR法)的间隔时间,2次采样间隔时间≥24 h。
1.3 标本采集与SARS-CoV-2核酸Ct值测定采集患者标本,包括鼻咽拭子、痰液、肛拭子。鼻咽拭子包含口咽拭子,置于同一标本采集管内;痰液标本为2 mL 3%氯化钠溶液雾化吸入后深部咳痰标本。
所有标本使用专用试管采集,用磁珠分离试剂盒(货号Z-ME-0092-96A,上海之江生物科技股份有限公司)和核酸自动提取仪(型号EX3600,上海之江生物科技股份有限公司)抽提核酸,然后采用SARS-CoV-2核酸检测试剂盒(货号Z-RR-0479-02-50,上海之江生物科技股份有限公司)在荧光定量PCR仪(型号LightCycler 480 Ⅱ,瑞士Roche公司)上进行扩增、鉴定,操作流程严格按照核酸检测试剂盒说明书进行。设ORF1ab/N基因的Ct值界限值为40。
1.4 统计学处理应用SPSS 26.0软件进行统计学分析。符合正态分布的计量资料以x±s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析;不符合正态分布的计量资料以中位数(下四分位数,上四分位数)表示,两组间比较采用Mann-Whitney U检验,多组间比较采用Kruskal-Wallis H检验;计数资料以例数和百分数表示,组间比较采用χ2检验或Fisher确切概率法。对单因素分析中差异有统计学意义的变量进行多元线性回归或简单线性回归分析。绘制Kaplan-Meier生存曲线观察不同样本的病毒累积清除率,采用log-rank法比较组间差异。检验水准(α)为0.05。
2 结果 2.1 一般资料共纳入SARS-CoV-2奥密克戎BA.2变异株感染患者217例,其中男128例(59.0%)、女89例(41.0%),年龄为32.0(24.0,50.5)岁。47例(21.7%)COVID-19患者合并1种及以上基础疾病,其中患病率排名前3位的基础合并症为高血压(34例,15.7%)、冠状动脉疾病(12例,5.5%)、糖尿病(9例,4.1%)。COVID-19起病症状主要包括发热(80例,36.9%)、咳嗽(140例,64.5%)、咽部不适(108例,49.8%),其他症状包括咳痰(42例,19.4%)、头痛(15例,6.9%)、乏力(10例,4.6%)、嗅觉及味觉减退(5例,2.3%)、腹泻(4例,1.8%)等;诊断分型以轻型最多,共184例(84.8%),另有无症状感染者8例(3.7%)、普通型21例(9.7%)、重型3例(1.4%)、危重型1例(0.5%);70例(32.3%)患者接受了莫努匹韦(molnupiravir)抗病毒治疗。
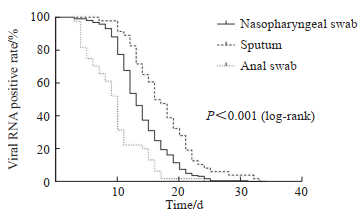
2.2 不同部位标本核酸阴转时间比较217例患者住院期间均严密监测鼻咽拭子SARS-CoV-2核酸Ct值,其中46例同时完成了痰液SARS-CoV-2核酸Ct值的监测,44例同时完成了肛拭子SARS-CoV-2核酸Ct值的监测,共累计完成1 159例次核酸检测;鼻咽拭子、痰液、肛拭子的核酸中位阴转时间分别是13.0(11.0,17.0)、16.5(13.0,21.0)、10.0(5.3,11.0)d,两两比较差异均有统计学意义(P均<0.001)。进一步绘制Kaplan-Meier生存曲线观察不同时间点、不同样本的病毒清除率,用log-rank法比较组间差异,结果(图 1)显示肛拭子的累积病毒清除率最高,鼻咽拭子次之,痰液最低(P<0.001)。
|
图 1 Kaplan-Meier生存曲线分析不同部位标本的SARS-CoV-2病毒清除率 Fig 1 Kaplan-Meier survival curve analysis of SARS-CoV-2 viral clearance rates in samples from different sources SARS-CoV-2: Severe acute respiratory syndrome coronavirus 2. |
2.3 鼻咽拭子SARS-CoV-2核酸阴转时间影响因素
分层分析(表 1)显示,与对照组相比,年龄≥60岁组、合并基础疾病组患者的鼻咽拭子SARS-CoV-2核酸阴转时间均延长(P均<0.05);按照基础疾病种类分组分析,合并高血压、冠状动脉疾病或神经系统疾病组患者的鼻咽拭子核酸阴转时间均较未合并组延长(P均<0.05),而合并糖尿病或慢性肺疾病对于鼻咽拭子核酸阴转无显著影响(P均>0.05);普通型患者相较于轻型患者鼻咽拭子核酸阴转时间延长(P<0.05)。以核酸阴转时间为因变量,将上述差异具有统计学意义的因素作为自变量进行多元线性回归分析,结果显示回归模型有统计学意义(F=2.778,P<0.05),临床分型为危重型是COVID-19患者鼻咽拭子SARS-CoV-2核酸阴转时间延长的独立危险因素[偏回归系数(partial regression coefficient,B)=11.072,标准误(standard error,SE)=4.605,标准化回归系数(standardized regression coefficient,β)=0.163,t=2.404,P=0.017]。
|
|
表 1 SARS-CoV-2奥密克戎BA.2变异株感染者鼻咽拭子病毒核酸阴转时间的影响因素分析 Tab 1 Analysis of influencing factors of viral shedding time in nasopharyngeal swabs of patients infected with SARS-CoV-2 omicron BA.2 variant |
2.4 痰液SARS-CoV-2核酸阴转时间影响因素
分层分析结果如表 2所示,男性、合并基础疾病是痰液SARS-CoV-2核酸阴转延长的危险因素(P<0.05),而年龄、BMI、诊断分型、是否抗病毒治疗对痰液核酸阴转时间无显著影响(P均>0.05)。多元线性回归分析显示,回归模型有统计学意义(F=8.869,P<0.05),男性和合并基础疾病均是痰液SARS-CoV-2核酸阴转时间延长的独立危险因素(B=6.286、4.060,SE=1.975、1.663,β=0.410、0.315,t=3.183、2.441,P=0.003、0.019)。
|
|
表 2 SARS-CoV-2奥密克戎BA.2变异株感染者痰液病毒核酸阴转时间的影响因素分析 Tab 2 Analysis of influencing factors of viral shedding time in sputum of patients infected with SARS-CoV-2 omicron BA.2 variant |
2.5 肛拭子SARS-CoV-2核酸阴转时间影响因素
由表 3可见,男性COVID-19患者肛拭子SARS-CoV-2核酸阴转时间长于女性(P<0.05),年龄、BMI、是否合并基础疾病、诊断分型、是否抗病毒治疗对肛拭子SARS-CoV-2核酸阴转时间无显著影响(P均>0.05)。简单线性回归分析显示,男性肛拭子核酸阴转时间比女性延长2.74 d(F=4.102,P<0.05)。
|
|
表 3 SARS-CoV-2奥密克戎BA.2变异株感染者肛拭子病毒核酸阴转时间的影响因素分析 Tab 3 Analysis of influencing factors of viral shedding time in anal swabs of patients infected with SARS-CoV-2 omicron BA.2 variant |
3 讨论
有研究认为SARS-CoV-2核酸阴转时间并不等同于具有传染性的时间[4],需要进一步完善病毒培养以明确,但病毒培养操作可行性低,所以口鼻咽部分泌物的病毒核酸检测始终是我国制订COVID-19患者出院和解除隔离标准的重要依据。SARS-CoV-2在其他部位标本中的存续时间仍待进一步探索。有研究提示下呼吸道标本中的SARS-CoV-2核酸阳性持续时间更久,也有研究指出呼吸道病毒清除后8~20 d仍可在粪便中检测到SARS-CoV-2[2, 5]。因此,了解不同部位标本中病毒核酸阴转时间及其影响因素,有助于优化当前的COVID-19疫情防控策略。
本研究结果显示,奥密克戎BA.2变异株感染患者鼻咽拭子、痰液、肛拭子3个部位标本的病毒核酸阴转时间存在差异,其中痰液中病毒核酸阴转时间最长,肛拭子阴转时间最短。SARS-CoV-2在肺部的高病毒载量可能是痰液中核酸阴转时间较长的原因之一,《新型冠状病毒肺炎防控方案(第九版)》也指出重型病例应优先采集下呼吸道标本,其中就包括深咳痰液[1]。虽然没有确切证据表明SARS-CoV-2可以通过粪-口途径传播,但是既往研究提示COVID-19患者粪便或肛拭子中可检测到病毒核酸。SARS-CoV-2主要借助血管紧张素转换酶2(angiotensin-converting enzyme 2,ACE2)进入宿主细胞,消化道中亦存在这些受体,病毒逃脱免疫防御后可直接感染肠道细胞并导致病毒脱落,粪便核酸阴转时间平均为14~21 d[5];徐采云等[6]研究发现2次咽拭子核酸阴性后仍可检测到一定比例的肛拭子核酸阳性,但本研究中肛拭子的核酸阴转时间最短。本研究中仅有4例(1.8%)确诊患者出现腹泻等消化道症状;2022年上海市COVID-19疫情数据显示患者的消化道症状罕见[7];英国一项纳入6万余例奥密克戎变异株感染患者的前瞻性观察研究亦发现,患者的胃肠道不适症状较少见[8];Miyakawa等[9]研究表明在肠道模型中,奥密克戎变异株的增殖效率较低,这可能是肛拭子核酸时间较短的原因。
本研究单因素分析结果显示,年龄≥60岁、合并基础疾病、患有高血压或冠状动脉疾病或神经系统疾病、临床分型为普通型可能延长鼻咽拭子核酸阴转时间。临床上老年患者合并基础疾病的可能性更高,Chen等[10]的研究同样指出高血压是COVID-19患者核酸阴转时间延长的重要危险因素,可能原因是高血压患者ACE2的高表达有助于SARS-CoV-2进入呼吸系统的靶细胞中[11]。Xue等[12]则指出除了高血压这一因素,年龄增长本身也会导致病毒清除时间的延长。本研究多元线性回归分析得出临床分型为危重型与鼻咽拭子核酸阴转时间延长有关,考虑危重型患者免疫功能受到抑制、体内病毒载量高,从而导致病毒清除时间延长。然而由于奥密克戎变异株的轻症化特点,本研究中危重型病例较少,后续如有可能应扩大样本量进一步验证。
本研究得出男性、合并基础疾病的患者痰液核酸阴转时间更长,这与既往研究结果一致[13]。同时,男性患者的肛拭子病毒核酸阴转时间也较女性延长。Motoc等[14]也报道了男性COVID-19患者的病毒存续时间明显比女性长;刘军等[15]研究发现,男性患者更容易出现急性呼吸窘迫综合征,进而发展成重型、危重型病例,这似乎与激素水平相关,但仍需进一步研究。
本研究结果还显示,莫努匹韦抗病毒治疗对鼻咽拭子、痰液、肛拭子3种样本核酸阴转时间均无显著影响。Xue等[12]根据病毒清除时间是否超过20 d将48例COVID-19患者分为两组(延长组与正常组),同样发现抗病毒治疗在两组间差异无统计学意义。但Liu等[16]发现对于60岁以上老年患者,早期使用莫努匹韦可以更快地清除病毒及缩短住院时间,提示对于老年COVID-19患者,莫努匹韦仍是一种可以选择的治疗药物。
综上所述,COVID-19患者痰液中SARS-CoV-2核酸阴转时间最长、肛拭子阴转时间最短,男性、合并基础疾病患者更容易出现痰液中核酸阴转时间延长。目前鼻咽拭子SARS-CoV-2核酸检测仍是疫情防控的主要评判标准,对于遏制我国的疫情贡献颇多,但对有上述危险因素的患者,在疫情防控要求较高的环境如军队、高校等,可以选择痰液核酸检测作为出院与解除隔离的标准,以最大程度地巩固疫情防控成果。
| [1] |
国家卫生健康委员会办公厅. 新型冠状病毒肺炎防控方案(第九版)[EB/OL]. (2022-06-27)[2022-08-25]. http://www.gov.cn/xinwen/2022-06/28/5698168/files/9585944023424f45a4b4d522b5f5c034.pdf.
|
| [2] |
WANG W, XU Y, GAO R, LU R, HAN K, WU G, et al. Detection of SARS-CoV-2 in different types of clinical specimens[J]. JAMA, 2020, 323: 1843-1844. |
| [3] |
国家卫生健康委员会办公厅, 国家中医药管理局办公室. 新型冠状病毒肺炎诊疗方案(试行第九版)[EB/OL]. (2022-03-14)[2022-08-25]. http://www.nhc.gov.cn/yzygj/s7653p/202203/74ade1ba4494583805a3d2e40093d88.shtml.
|
| [4] |
KIM M C, CUI C G, SHIN K R, BAE J Y, KWEON O J, LEE M K, et al. Duration of culturable SARS-CoV-2 in hospitalized patients with COVID-19[J]. N Engl J Med, 2021, 384: 671-673. DOI:10.1056/NEJMc2027040 |
| [5] |
LAVANIA M, JOSHI M S, RANSHING S S, POTDAR V A, SHINDE M, CHAVAN N, et al. Prolonged shedding of SARS-CoV-2 in feces of COVID-19 positive patients: trends in genomic variation in first and second wave[J/OL]. Front Med (Lausanne), 2022, 9: 835168. DOI: 10.3389/fmed.2022.835168.
|
| [6] |
徐采云, 宋甲富, 刘素霞, 郑慧, 康秀文, 李勇, 等. 不同严重程度新型冠状病毒肺炎患者肛拭子核酸检测阳性率及临床特点分析[J]. 中华危重病急救医学, 2020, 32: 1171-1173. DOI:10.3760/cma.j.cn121430-20200611-00631 |
| [7] |
AO Y Y, LI J J, WEI Z Q, WANG Z L, TIAN H, QIU Y, et al. Clinical and virological characteristics of SARS-CoV-2 omicron BA.2.2 variant outbreaks during April to May, 2022, Shanghai, China[J]. J Infect, 2022, 85: 573-607. |
| [8] |
MENNI C, VALDES A M, POLIDORI L, ANTONELLI M, PENAMAKURI S, NOGAL A, et al. Symptom prevalence, duration, and risk of hospital admission in individuals infected with SARS-CoV-2 during periods of omicron and delta variant dominance: a prospective observational study from the ZOE COVID Study[J]. Lancet, 2022, 399: 1618-1624. DOI:10.1016/S0140-6736(22)00327-0 |
| [9] |
MIYAKAWA K, MACHIDA M, KAWASAKI T, NISHI M, AKUTSU H, RYO A. Reduced replication efficacy of severe acute respiratory syndrome coronavirus 2 omicron variant in "mini-gut" organoids[J]. Gastroenterology, 2022, 163: 514-516. DOI:10.1053/j.gastro.2022.04.043 |
| [10] |
CHEN X P, HU MT W, YANG M, LING J X, ZHANG Y X, DENG L P, et al. Risk factors for the delayed viral clearance in COVID-19 patients[J]. J Clin Hypertens (Greenwich), 2021, 23: 1483-1489. DOI:10.1111/jch.14308 |
| [11] |
FANG L, KARAKIULAKIS G, ROTH M. Are patients with hypertension and diabetes mellitus at increased risk for COVID-19 infection?[J/OL]. Lancet Respir Med, 2020, 8: e21. DOI: 10.1016/S2213-2600(20)30116-8.
|
| [12] |
XUE J, ZHENG J, SHANG X Y, QIN E Q, ZHAO P, HE Y, et al. Risk factors for prolonged viral clearance in adult patients with COVID-19 in Beijing, China: a prospective observational study[J/OL]. Int Immunopharmacol, 2020, 89: 107031. DOI: 10.1016/S2213-2600(20)30116-8.
|
| [13] |
ZHANG S, ZHU H, YE H H, HU Y R, ZHENG N H, HUANG Z A, et al. Risk factors for prolonged virus shedding of respiratory tract and fecal in adults with severe acute respiratory syndrome coronavirus-2 infection[J/OL]. J Clin Lab Anal, 2021, 35: e23923. DOI: 10.1002/jcla.23923.
|
| [14] |
MOTOC N S, RUTA V M, MAN M A, UNGUR R A, CIORTEA V M, IRSAY L, et al. Factors associated with prolonged RT-PCR SARS-CoV-2 positive testing in patients with mild and moderate forms of COVID-19: a retrospective study[J/OL]. Medicina (Kaunas), 2022, 58: 707. DOI: 10.3390/medicina58060707.
|
| [15] |
刘军, 李欢, 张仕玉, 张鹏, 艾思奇, 田飞, 等. 湖北省新型冠状病毒肺炎患者发生重型、危重型的影响因素[J]. 山东大学学报(医学版), 2020, 58: 60-65. |
| [16] |
LIU Y Y, GE L L, FAN S Y, XU A J, WANG X Y, DONG X, et al. Disease progression of hospitalized elderly patients with omicron BA.2 treated with molnupiravir[J]. Infect Dis Ther, 2022, 11: 2241-2251. DOI:10.1007/s40121-022-00716-7 |
 2022, Vol. 43
2022, Vol. 43


