2. 海军军医大学(第二军医大学)海军特色医学中心皮肤科, 上海 200052
2. Department of Dermatology, Naval Medical Center, Naval Medical University (Second Military Medical University), Shanghai 200052, China
新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)是由严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)引起的新型呼吸系统疾病,在2019年12月30日被首次报道后目前已造成全球大流行。找到控制SARS-CoV-2感染和改善COVID-19临床症状的方法迫在眉睫。
SARS-CoV-2是一种正义单链RNA病毒,包含4种重要的结构蛋白:刺突蛋白、包膜蛋白、膜蛋白和核衣壳蛋白[1]。SARS-CoV-2通过表面刺突蛋白以血管紧张素转换酶2(angiotensin-converting enzyme 2,ACE2)为受体介导膜融合入侵宿主细胞,细胞上的跨膜丝氨酸蛋白酶2(transmembrane protease serine 2,TMPRSS2)会促进膜融合,进一步将病毒释放到宿主细胞中。SARS-CoV-2进入细胞后与溶酶体膜融合并进行病毒基因组和蛋白质复制, 然后通过胞吐作用从细胞释放[2]。SARS-CoV-2感染通过诱导高炎症反应导致免疫系统失调,产生过多的促炎症介质,触发急性肺损伤、感染性休克、急性呼吸窘迫综合征和多器官衰竭,而研究表明过度的肺部炎症与组胺释放有关[3]。
组胺是一种内源性生物胺,主要分布于肥大细胞和嗜碱性粒细胞的细胞质颗粒中,在受到免疫和/或非免疫刺激时被释放[4-6],并通过激活4种已知的组胺受体(H1、H2、H3、H4受体)发挥作用。组胺受体属于G蛋白偶联受体家族,具有多方面的药理和治疗特性。目前常见的组胺受体拮抗剂包括H1受体拮抗剂氯苯那敏、酮替芬、氯雷他定、西替利嗪,以及H2受体拮抗剂法莫替丁等[7]。
2020年2月,中国研究者系统分析了SARS-CoV-2基因编码的所有蛋白质,并通过同源建模完成蛋白质结构构建,基于靶标的虚拟配体药物筛选发现法莫替丁对COVID-19有非常出色的治疗前景[8]。同时,美国Borrell[9]使用计算机建模评估候选化合物与SARS-CoV-2靶点的结合也得到了相似的结论。为进一步验证法莫替丁的临床疗效,Freedberg等[10]于2020年开展了一项针对COVID-19患者的回顾性队列研究,结果表明服用法莫替丁的患者气管插管和死亡风险均明显降低。随后,关于组胺受体拮抗剂及其联合用药方案改善COVID-19患者炎症反应和症状的研究也陆续被报道,大量围绕组胺受体拮抗剂在COVID-19治疗中的临床试验研究正在开展(表 1)。本文就组胺受体拮抗剂及其联合用药在COVID-19患者中的治疗效果和作用机制及其应用前景进行综述。
|
|
表 1 组胺H1、H2受体拮抗剂用于COVID-19治疗的临床试验 Tab 1 Clinical trials of histamine H1 and H2 receptor antagonists in treatment of COVID-19 |
1 组胺受体拮抗剂在COVID-19治疗中的应用 1.1 H1受体拮抗剂
2021年1月发表的一项回顾性研究在西班牙2家养老院25例有症状的COVID-19患者中分析了H1受体拮抗剂(右氯苯那敏、西替利嗪或氯雷他定)联合阿奇霉素的治疗疗效,结果显示接受联合治疗的患者均未进展为严重病例(经皮动脉血氧饱和度<80%),观察到死亡率为0[11]。该研究将终点与西班牙同年龄老年人的官方数据进行比较,发现组胺受体拮抗剂联合阿奇霉素可能有助于COVID-19治疗能并预防老年患者发展为严重病例。一项随机、双盲、安慰剂对照Ⅲ期临床试验正在进行,该研究共纳入150例COVID-19患者,旨在评估酮替芬和吲哚美辛联合治疗成人轻、中症COVID-19的疗效,计划2022年12月1日前完成[12],研究结果或可帮助临床了解H1受体拮抗剂联合非甾体抗炎药在COVID-19治疗中的疗效与安全性。此外,H1受体拮抗剂联合外用糖皮质激素在COVID-19治疗中的应用也有报道[13]。1例以皮疹为最初表现的54岁女性COVID-19患者,在接受氯雷他定联合局部0.1%曲安奈德乳膏治疗后皮疹完全缓解,提示H1受体拮抗剂联合外用糖皮质激素可用于COVID-19皮肤表现的治疗。
H1受体拮抗剂还有助于SARS-CoV-2感染急性后遗症(post-acute sequelae of SARS-CoV-2 infection,PASC)的改善。PASC是一种新的、不明确的疾病,其特点是症状持续超过了预期的缓解时间。Groff等[14]的研究纳入250 351例COVID-19患者,发现半数以上的患者在康复6个月后经历了PASC,其中许多病例多器官系统受累,严重损害日常功能。有研究报告了2例既往无系统性疾病的女性PASC患者,在服用非处方H1受体拮抗剂(苯海拉明、非索非那定)后症状几乎完全缓解;在Facebook上的虚拟COVID-19研究和倡导组织中约900例PASC患者的数据分析结果也证实了H1受体拮抗剂对于PASC的疗效,提示H1受体拮抗剂可作为改善PASC的一种有效手段[15]。
1.2 H2受体拮抗剂2020年5月一项针对COVID-19患者的回顾性队列研究纳入来自一家美国机构的1 620例患者,法莫替丁治疗组接受了平均5.8 d的药物治疗。研究结果表明,在因COVID-19住院且最初未行气管插管的患者中,法莫替丁治疗组气管插管或死亡等临床恶化事件与未接受法莫替丁治疗的对照组相比显著减少[10]。2020年6月的一项回顾性观察研究(研究对象为10例未住院且自行服用法莫替丁的COVID-19患者)结果表明,所有患者在使用法莫替丁后疾病相关症状均有显著改善,使用法莫替丁后24 h内联合症状评分明显改善、外周氧饱和度增加,且患者对法莫替丁耐受性良好,提示法莫替丁对于改善COVID-19患者临床症状有效[16]。在美国康涅狄格州哈特福德医院进行的一项回顾性观察研究分析了878例COVID-19住院患者的电子病历记录,其中83例接受法莫替丁治疗,研究结果显示使用法莫替丁可以有效改善COVID-19临床症状,死亡和/或气管插管率及反映疾病严重程度的血清标志物水平均较低[17]。上述研究结果表明,法莫替丁在重症COVID-19患者中可以有效降低气管插管率和死亡率,且患者耐受性良好。
为进一步明确法莫替丁是否能改善轻、中症COVID-19患者的炎症反应和临床症状,Brennan等[18]开展了一项随机、双盲、安慰剂对照Ⅱ期临床试验(NCT04724720)。该研究招募了2021年1月至4月美国2家中心有症状、未接种SARS-CoV-2疫苗的确诊COVID-19成人门诊患者。患者自服法莫替丁(n=28)或安慰剂(n=27),连续14 d,在法莫替丁治疗的8.2 d(95% CI 7.0~9.8 d)和安慰剂治疗的11.4 d(95% CI 10.3~12.6 d)估计总体基线症状评分降低了50%。同时两组的抗SARS-CoV-2核心蛋白IgG水平相似。这一结果表明法莫替丁用于轻、中症COVID-19患者的安全性和耐受性好,能在不降低机体抗SARS-CoV-2免疫力的情况下更早地改善症状和炎症。
阿司匹林作为一种常使用的抗炎药物,一项关于法莫替丁与阿司匹林联合治疗COVID-19的回顾性研究表明法莫替丁与阿司匹林在COVID-19治疗中存在显著的协同获益[19]。该研究纳入了30个国家的400万例COVID-19患者,其中5 955例使用阿司匹林和法莫替丁联合治疗,结果显示法莫替丁和阿司匹林联合用药组患者(包括344例重症病例)的死亡率降低了32.5%。考虑到该研究结果及法莫替丁和阿司匹林等非处方药物的成本效益和轻微不良反应,法莫替丁与阿司匹林联合是COVID-19的潜在治疗方案。
1.3 H1和H2受体拮抗剂联合应用H1、H2受体拮抗剂联合应用常见于超敏反应性疾病、哮喘、系统性肥大细胞增多症、肿瘤等疾病的治疗,均有较好的治疗效果。一项西替利嗪和法莫替丁联合使用的队列研究结果提示,该药物组合可以有效降低COVID-19患者的死亡率,改善临床症状[20]。该研究纳入110例有严重至危重肺部症状的住院患者,患者接受西替利嗪-法莫替丁加标准治疗,结果显示所有接受双组胺受体拮抗剂治疗的患者死亡率和症状进展均有所降低。关于法莫替丁和氯雷他定联合用药的临床试验已完成,纳入214例COVID-19患者,实验组采用标准治疗方案加法莫替丁-氯雷他定,对照组采用标准治疗方案加法莫替丁治疗,该研究结果或将有助于明确法莫替丁和氯雷他定联合治疗COVID-19的疗效和安全性[21]。
2 组胺受体拮抗剂在COVID-19治疗中的潜在机制组胺受体拮抗剂在COVID-19治疗中可以有效降低死亡率、改善临床症状,但作用机制尚未完全明确,目前认为可能是通过抗炎、抗病毒等机制发挥作用。
2.1 抗炎作用SARS-CoV-2进入宿主细胞的2个主要宿主因子ACE2受体和TMPRSS2在肥大细胞上也有表达[22],SARS-CoV-2感染会激活肥大细胞,导致组胺和其他炎症介质释放[3]。一方面,Conti等[3]研究发现SARS-CoV-2激活的肥大细胞通过释放组胺导致IL-1水平升高,引起细胞因子风暴和炎症反应,且组胺与H1受体结合可增加肺部炎症水平。另一方面,组胺可通过H1受体增强辅助性T细胞(helper T cell,Th)1应答,影响Th1/Th2细胞因子水平[23],同时抑制干扰素γ的释放,促进了SARS-CoV-2感染引起的炎症反应。组胺受体拮抗剂通过介导免疫调节对肥大细胞组胺-细胞因子的交互作用,达到抑制炎症风暴、缓解临床症状的效果(图 1)。
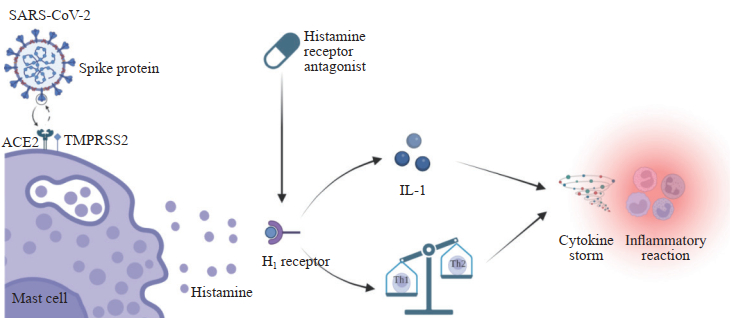
|
图 1 组胺受体拮抗剂在COVID-19治疗中的抗炎作用机制 Fig 1 Anti-inflammatory mechanism of histamine receptor antagonists in treatment of COVID-19 SARS-CoV-2 infection activates mast cells by binding to ACE2 receptors and TMPRSS2, leading to the release of histamine and other inflammatory mediators, causing cytokine storms and inflammatory reactions. Histamine receptor antagonists can inhibit inflammatory storms and relieve clinical symptoms by mediating immune regulation and histamine-cytokine interaction. COVID-19: Coronavirus disease 2019; SARS-CoV-2: Severe acute respiratory syndrome coronavirus 2; ACE2: Angiotensin-converting enzyme 2; TMPRSS2: Transmembrane protease serine 2; IL-1: Interleukin 1; Th: Helper T cell. |
研究人员对法莫替丁在COVID-19治疗中的作用机制提出了一种新的假说:法莫替丁可以激活迷走神经,通过α7烟碱型乙酰胆碱受体信号转导抑制信息来抑制细胞因子及炎症风暴。小鼠实验结果显示,在细胞因子风暴的背景下,法莫替丁具有一种以前未确定的迷走神经依赖性抗炎作用,而其他高剂量的H2受体拮抗剂在临床使用中无法复制这种作用[24]。
2.2 抗病毒作用研究发现法莫替丁是SARS-CoV-2复制和转录的关键蛋白酶3胰凝乳蛋白酶样蛋白酶(3-chymotrypsin-like protease,3CLpro)[8]和木瓜样蛋白酶(papain-like protease,PLpro)[25]的抑制剂,意味着法莫替丁对SARS-CoV-2有直接抗病毒作用(图 2)。SARS-CoV-2刺突假型病毒感染的体外实验研究表明,H1受体拮抗剂氯雷他定和地氯雷他定均可以阻止假型病毒进入ACE2过表达的人胚胎肾细胞293T细胞(HEK293T细胞);进一步的细胞膜色谱和表面等离子体共振结合实验表明,2种拮抗剂均能与ACE2结合,且地氯雷他定的结合亲和力远强于氯雷他定,提示H1受体拮抗剂可以通过阻断刺突蛋白-ACE2相互作用达到对SARS-CoV-2刺突假病毒的抑制作用[26]。还有研究认为法莫替丁可以抑制组胺诱导的SARS-CoV-2感染细胞Toll样受体3(Toll-like receptor 3,TLR3)的表达,并减少TLR3依赖的信号通路,最终激活干扰素调节因子3和NF-κB通路,进而控制炎症反应和抵抗病毒感染[27]。
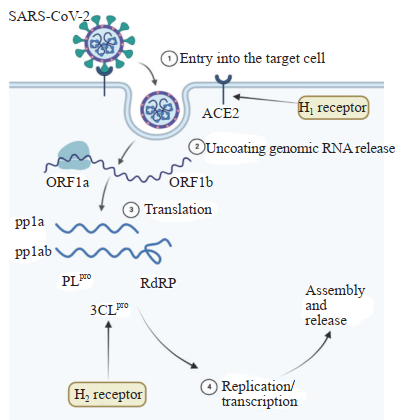
|
图 2 组胺受体拮抗剂在COVID-19治疗中的抗病毒作用机制 Fig 2 Antiviral mechanism of histamine receptor antagonists in treatment of COVID-19 H1 receptors inhibit endocytosis into host cells by blocking the binding of SARS-CoV-2's proteins to ACE2 receptors. Viral genomic RNA exposed to nucleic acid detection site ORF1ab after nucleocapsid release into cytoplasm. Ribosomal translation produces polyproteins pp1a and pp1ab. pp1a and pp1ab are hydrolyzed by the virus's own proteolytic enzymes 3CLpro and PLpro. The H2 receptor antagonist famotidine inhibits the viral process in vivo by inhibiting 3CLpro and PLpro. RdRP catalyzed replication, retranscription and assembly, and finally elimination by endocytosis. COVID-19: Coronavirus disease 2019; SARS-CoV-2: Severe acute respiratory syndrome coronavirus 2; ACE2: Angiotensin-converting enzyme 2; ORF: Open reading frame; 3CLpro: 3-chymotrypsin-like protease; PLpro: Papain-like protease; RdRP: RNA-dependent RNA polymerase. |
3 小结和展望
目前研究表明组胺受体拮抗剂对COVID-19患者治疗有效,可以在不降低免疫力的情况下改善轻、中症患者的临床症状和炎症反应,在危重症患者中可以降低急性肺损伤的风险、缩短住院时间并降低气管插管率和死亡率。组胺受体拮抗剂联合阿司匹林、阿奇霉素、非甾体抗炎药等,以及不同组胺拮抗剂之间的联合在COVID-19治疗中的应用均有报道,但疗效及安全性仍需要临床试验进一步验证。组胺受体拮抗剂在COVID-19治疗中的作用机制尚不完全清楚,可能与组胺受体拮抗剂的抗炎及抗病毒作用有关,也有研究表明法莫替丁可能通过迷走神经依赖性抗炎机制发挥作用。
组胺受体拮抗剂在COVID-19治疗中的疗效值得肯定,不过目前的研究结果仍有待进一步完善。部分研究因样本量较小、缺乏安慰剂对照组或随机分组或没有将患者根据疾病严重程度进一步分组统计,导致结果的证据等级不足。因此需开展前瞻性、多中心、大样本量的双盲随机对照临床试验进一步验证组胺受体拮抗剂在COVID-19治疗中的疗效与安全性。
2022年3月15日国家卫生健康委员会发布的《新型冠状病毒肺炎诊疗方案(试行第九版)》尚未提及组胺受体拮抗剂的使用。考虑到组胺受体拮抗剂在COVID-19治疗中显著的临床疗效、成本效益良好和不良反应轻微,“老药”组胺受体拮抗剂是COVID-19及PASC非常有前景的治疗方案。
| [1] |
NAQVI A A T, FATIMA K, MOHAMMAD T, FATIMA U, SINGH I K, SINGH A, et al. Insights into SARS-CoV-2 genome, structure, evolution, pathogenesis and therapies: structural genomics approach[J/OL]. Biochim Biophys Acta Mol Basis Dis, 2020, 1866: 165878. DOI: 10.1016/j.bbadis.2020.165878.
|
| [2] |
HOFFMANN M, KLEINE-WEBER H, SCHROEDER S, KRÜGER N, HERRLER T, ERICHSEN S, et al. SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease inhibitor[J/OL]. Cell, 2020, 181: 271-280. e8. DOI: 10.1016/j.cell.2020.02.052.
|
| [3] |
CONTI P, CARAFFA A, TETÈ G, GALLENGA C E, ROSS R, KRITAS S K, et al. Mast cells activated by SARS-CoV-2 release histamine which increases IL-1 levels causing cytokine storm and inflammatory reaction in COVID-19[J]. J Biol Regul Homeost Agents, 2020, 34: 1629-1632. |
| [4] |
BORRIELLO F, IANNONE R, MARONE G. Histamine release from mast cells and basophils[J]. Handb Exp Pharmacol, 2017, 241: 121-139. |
| [5] |
OLIVERA A, BEAVEN M A, METCALFE D D. Mast cells signal their importance in health and disease[J]. J Allergy Clin Immunol, 2018, 142: 381-393. DOI:10.1016/j.jaci.2018.01.034 |
| [6] |
MARSHALL J S, PORTALES-CERVANTES L, LEONG E. Mast cell responses to viruses and pathogen products[J/OL]. Int J Mol Sci, 2019, 20: 4241. DOI: 10.3390/ijms20174241.
|
| [7] |
THURMOND R L, GELFAND E W, DUNFORD P J. The role of histamine H1 and H4 receptors in allergic inflammation: the search for new antihistamines[J]. Nat Rev Drug Discov, 2008, 7: 41-53. DOI:10.1038/nrd2465 |
| [8] |
WU C R, LIU Y, YANG Y Y, ZHANG P, ZHONG W, WANG Y L, et al. Analysis of therapeutic targets for SARS-CoV-2 and discovery of potential drugs by computational methods[J]. Acta Pharm Sin B, 2020, 10: 766-788. DOI:10.1016/j.apsb.2020.02.008 |
| [9] |
BORRELL B. New York clinical trial quietly tests heartburn remedy against coronavirus[EB/OL]. (2020-04-26)[2022-07-10]. https://www.science.org/content/article/new-york-clinical-trial-quietly-tests-heartburn-remedy-against-coronavirus.
|
| [10] |
FREEDBERG D E, CONIGLIARO J, WANG T C, TRACEY K J, CALLAHAN M V, ABRAMS J A, et al. Famotidine use is associated with improved clinical outcomes in hospitalized COVID-19 patients: a propensity score matched retrospective cohort study[J/OL]. Gastroenterology, 2020, 159: 1129-1131. e3. DOI: 10.1053/j.gastro.2020.05.053.
|
| [11] |
MORÁN BLANCO J I, ALVARENGA BONILLA J A, HOMMA S, SUZUKI K, FREMONT-SMITH P, VILLAR GÓMEZ DE LAS HERAS K. Antihistamines and azithromycin as a treatment for COVID-19 on primary health care-A retrospective observational study in elderly patients[J/OL]. Pulm Pharmacol Ther, 2021, 67: 101989. DOI: 10.1016/j.pupt.2021.101989.
|
| [12] |
LIMKAKENG A T. Ketotifen and indomethacin combination treatment clinical trial for COVID-19(KICC COVID-19)[EB/OL]. (2022-05-09)[2022-07-10]. https://clinicaltrials.gov/ct2/show/NCT05007522?term=antihistamine&cond=COVID-19&draw=2&rank=11.
|
| [13] |
PAGALI S, PARIKH R S. Severe urticarial rash as the initial symptom of COVID-19 infection[J/OL]. BMJ Case Rep, 2021, 14: e241793. DOI: 10.1136/bcr-2021-241793.
|
| [14] |
GROFF D, SUN A, SSENTONGO A E, BA D M, PARSONS N, POUDEL G R, et al. Short-term and long-term rates of postacute sequelae of SARS-CoV-2 infection: a systematic review[J/OL]. JAMA Netw Open, 2021, 4: e2128568. DOI: 10.1001/jamanetworkopen.2021.28568.
|
| [15] |
PINTO M D, LAMBERT N, DOWNS C A, ABRAHIM H, HUGHES T D, RAHMANI A M, et al. Antihistamines for postacute sequelae of SARS-CoV-2 infection[J]. J Nurse Pract, 2022, 18: 335-338. DOI:10.1016/j.nurpra.2021.12.016 |
| [16] |
JANOWITZ T, GABLENZ E, PATTINSON D, WANG T C, CONIGLIARO J, TRACEY K, et al. Famotidine use and quantitative symptom tracking for COVID-19 in non-hospitalised patients: a case series[J]. Gut, 2020, 69: 1592-1597. DOI:10.1136/gutjnl-2020-321852 |
| [17] |
MATHER J F, SEIP R L, MCKAY R G. Impact of famotidine use on clinical outcomes of hospitalized patients with COVID-19[J]. Am J Gastroenterol, 2020, 115: 1617-1623. DOI:10.14309/ajg.0000000000000832 |
| [18] |
BRENNAN C M, NADELLA S, ZHAO X, DIMA R J, JORDAN-MARTIN N, DEMESTICHAS B R, et al. Oral famotidine versus placebo in non-hospitalised patients with COVID-19:a randomised, double-blind, data-intense, phase 2 clinical trial[J]. Gut, 2022, 71: 879-888. DOI:10.1136/gutjnl-2022-326952 |
| [19] |
MURA C, PREISSNER S, NAHLES S, HEILAND M, BOURNE P E, PREISSNER R. Real-world evidence for improved outcomes with histamine antagonists and aspirin in 22, 560 COVID-19 patients[J/OL]. Signal Transduct Target Ther, 2021, 6: 267. DOI: 10.1038/s41392-021-00689-y.
|
| [20] |
HOGAN II R B, HOGAN III R B, CANNON T, RAPPAI M, STUDDARD J, PAUL D, et al. Dual-histamine receptor blockade with cetirizine-famotidine reduces pulmonary symptoms in COVID-19 patients[J/OL]. Pulm Pharmacol Ther, 2020, 63: 101942. DOI: 10.1016/j.pupt.2020.101942.
|
| [21] |
AZAB S S. Combined antihistaminics therapy in COVID 19 patients[EB/OL]. (2021-09-14)[2022-07-10]. https://clinicaltrials.gov/ct2/show/NCT05043350?term=histamine&cond=COVID-19&draw=2&rank=11.
|
| [22] |
THEOHARIDES T C. COVID-19, pulmonary mast cells, cytokine storms, and beneficial actions of luteolin[J]. Biofactors, 2020, 46: 306-308. DOI:10.1002/biof.1633 |
| [23] |
BRYCE P J, MATHIAS C B, HARRISON K L, WATANABE T, GEHA R S, OETTGEN H C. The H1 histamine receptor regulates allergic lung responses[J]. J Clin Invest, 2006, 116: 1624-1632. DOI:10.1172/JCI26150 |
| [24] |
YANG H, GEORGE S J, THOMPSON D A, SILVERMAN H A, TSAAVA T, TYNAN A, et al. Famotidine activates the vagus nerve inflammatory reflex to attenuate cytokine storm[J/OL]. Mol Med, 2022, 28: 57. DOI: 10.1186/s10020-022-00483-8.
|
| [25] |
SEN GUPTA P S, BISWAL S, SINGHA D, RANA M K. Binding insight of clinically oriented drug famotidine with the identified potential target of SARS-CoV-2[J]. J Biomol Struct Dyn, 2021, 39: 5327-5333. DOI:10.1080/07391102.2020.1784795 |
| [26] |
HOU Y J, GE S, LI X W, WANG C, HE H Z, HE L C. Testing of the inhibitory effects of loratadine and desloratadine on SARS-CoV-2 spike pseudotyped virus viropexis[J/OL]. Chem Biol Interact, 2021, 338: 109420. DOI: 10.1016/j.cbi.2021.109420.
|
| [27] |
MUKHERJEE R, BHATTACHARYA A, BOJKOVA D, MEHDIPOUR A R, SHIN D, KHAN K S, et al. Famotidine inhibits toll-like receptor 3-mediated inflammatory signaling in SARS-CoV-2 infection[J/OL]. J Biol Chem, 2021, 297: 100925. DOI: 10.1016/j.jbc.2021.100925.
|
 2022, Vol. 43
2022, Vol. 43


