2. 海军军医大学(第二军医大学)第一附属医院肾内科, 上海 200433
2. Department of Nephrology, The First Affiliated Hospital of Naval Medical University (Second Military Medical University), Shanghai 200433, China
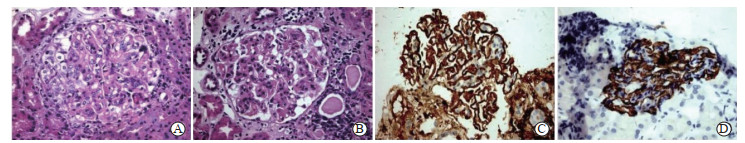
患者男,47岁,因“反复水肿伴蛋白尿2年余”于2021年12月21日就诊于海军军医大学(第二军医大学)第一附属医院肾内科。该患者既往有高血压病史4年、痛风病史2年。患者于2019年2月24日起无明显诱因出现双下肢水肿及晨起后眼睑水肿,自觉尿泡沫增多,未重视。2019年3月4日在外院查血肌酐(serum creatinine,SCr)101 μmol/L,估算肾小球滤过率(estimated glomerular filtration rate,eGFR)87.8 mL/min,血白蛋白21 g/L,低密度脂蛋白胆固醇4.6 mmol/L,24 h尿蛋白17.05 g,尿隐血(┼┼┼),尿蛋白(┼┼┼),血清抗磷脂酶A2受体(phospholipase A2 receptor,PLA2R)抗体47.62 RU/mL。2019年3月5日在外院行肾脏穿刺活检术。术后肾脏病理结果:光镜下显示8个肾小球,其中1个小球见细胞性新月体形成(图 1A),未见球性及节段性硬化;肾小球基底膜僵硬、增厚,系膜细胞节段性轻度增生(图 1B),系膜基质轻度增多,毛细血管袢开放好。肾间质内-小灶性淋巴/单核细胞浸润,伴间质纤维化;肾小管萎缩,少数肾小管内见蛋白管型;小动脉及细动脉管腔未见明显狭窄。电镜印象符合膜性肾病(membranous nephropathy,MN)(Ⅱ期),合并系膜增生及新月体形成。免疫荧光染色全片共见8个肾小球,其中IgG(┼┼,图 1C),IgA(—),IgM(—),κ(+),λ(+),C1q(+),C3(—),C4(—)。免疫组织化学染色示乙型肝炎表面抗原(—),乙型肝炎核心抗原(—),IgG(—),IgG4(—),PLA2R(+,图 1D);病理诊断:MN合并系膜增生及新月体形成。结合症状、体征、实验室及病理检查,当地医院诊断为“肾病综合征,MN”,予依诺肝素抗凝,甲泼尼龙60 mg静脉滴注3 d后改为口服甲泼尼龙48 mg/d[0.6 mg/(kg·d)]联合环磷酰胺0.5 g静脉滴注治疗后次日出院,继续口服药物治疗。出院后患者自觉水肿无明显好转,且逐渐出现尿色加深,呈棕色。2019年3月23日外院门诊随诊时复查SCr为122 μmol/L,尿常规示蛋白质(┼┼┼)、红细胞(┼┼┼)。再次于外院住院治疗,住院期间SCr进行性升高,考虑“急性肾损伤”。肾脏超声检查示肾脏稍增大,未见血肿,肾血管未见明显栓塞,排除肾穿刺后血肿形成、肾静脉血栓等,遂停用抗凝药物。同时患者出现咳嗽、咳痰,胸部CT提示双肺少许炎症,予止血、抗感染、化痰、补充丙种球蛋白后,给予甲泼尼龙500 mg静脉滴注冲击治疗3 d,联合环磷酰胺0.5 g(累积剂量1 g)静脉滴注治疗,续贯口服甲泼尼龙48 mg/d。4月3日复查SCr为381 μmol/L,eGFR 18.8 mL/min,治疗效果不佳,在患者及家属要求下于4月4日出院。为进一步治疗于4月5日入住海军军医大学(第二军医大学)第一附属医院肾内科。入院后体格检查:生命体征平稳,心、肺、腹未发现异常,双下肢轻度凹陷性水肿。辅助检查示:白细胞计数15.12×109/L,中性粒细胞计数11.76×109/L,血红蛋白99 g/L,血小板计数205×109/L,血白蛋白18 g/L,SCr 381 μmol/L,低密度脂蛋白胆固醇2.90 mmol/L,eGFR 16.0 mL/min,尿红细胞满视野,尿蛋白(┼┼┼┼),尿畸形红细胞占比0.46,凝血功能未见异常,自身抗体谱阴性。肾脏CT平扫未见血肿等异常征象,膀胱镜检查未见明显出血点,排除狼疮性肾炎、肝炎、自身免疫病等继发性原因,诊断为“肾病综合征,MN合并系膜增生及新月体形成,急性肾损伤,肾穿刺后迟发性出血”。予口服他克莫司3 mg/12 h+甲泼尼龙44 mg/d,辅以补充丙种球蛋白、止血等一般治疗后,水肿好转,尿液转清,于4月21日出院。5月5日于我院门诊复查血红蛋白为67 g/L,建议行骨髓穿刺检查,患者及家属拒绝,继续予止血、补铁等药物治疗。后多次复查血常规,血红蛋白水平逐渐回升。
|
图 1 外院肾穿刺活检组织病理结果(400×) A:苏木精-伊红染色示肾小球细胞性新月体形成;B:苏木精-伊红染色示系膜增生伴肾小球基底膜僵硬、增厚;C:免疫组织化学染色示免疫球蛋白G(┼┼);D:免疫组织化学染色示磷脂酶A2受体(+). |
此后患者定期在我院门诊监测肾功能、尿蛋白、他克莫司血药浓度,2019年4月30日至2020年9月14日患者SCr波动在140~243 μmol/L。2020年12月10日复查血白蛋白逐渐升高至41 g/L,24 h尿蛋白下降至1.9 g,调整用药为他克莫司1 mg/12 h+泼尼松2.5 mg/d。2021年1月2日于我院门诊复查,SCr为216 μmol/L,24 h尿蛋白为2.3 g。考虑病情未完全缓解,于1月24日再次住院治疗,查SCr为231 μmol/L,24 h尿蛋白为1.68 g,CD19+淋巴细胞42/μL,血清抗PLA2R抗体8.25 RU/mL。考虑治疗时间已超过21个月,血肌酐未下降至正常,且尿蛋白未达到完全缓解,予停用他克莫司,改为利妥昔单抗1 g静脉滴注,过程平稳,无过敏反应等不适。2月7日再次行利妥昔单抗(1 g)治疗,过程顺利,患者出院。出院后患者失访10个月。2021年12月21日患者再次入院,复查SCr为194 μmol/L,24 h尿蛋白3.1 g,CD19+淋巴细胞23/μL,抗PLA2R抗体7.07 RU/mL,再次予利妥昔单抗1 g静脉滴注(累计3 g),于12月25日出院。目前患者一般情况可,双下肢无明显水肿,规律门诊随访。
2 讨论从流行病学角度看,MN发病率逐年提高,在有些地区已超过IgA肾病成为最常见的肾小球疾病[1]。MN主要的病理特征是肾小球基膜(glomerular basement membrane,GBM)增厚和上皮下免疫复合物沉积。其临床主要表现为肾病综合征,即大量蛋白尿、低蛋白血症、高脂血症、水肿。从病因角度来看,MN可分为原发性MN(primary membranous nephropathy,PMN)和继发性MN(secondary membranous nephropathy,SMN)。PMN被认为是器官特异性自身免疫病,约占MN总数的75%~80%[2],其中70%~80%的患者抗PLA2R抗体阳性[3]。现在,抗PLA2R抗体已成为国内外专家、学者公认的PMN标志性抗体之一,并被改善全球肾脏病预后组织推荐,可以用于临床实践[4]。与抗PLA2R抗体阴性的PMN患者相比,抗体阳性者24 h尿蛋白水平更高[5-6]、肾功能下降更明显[7],并且治疗后缓解率更低[8]。此外分别有约5%~10%和1%~5%的PMN患者血液及肾组织中抗神经表皮生长因子样1抗体[9]、抗1型血小板反应蛋白7A域抗体阳性[10],近年来陆续还有其他MN相关抗体的报道[11]。SMN约占MN总数的20%~25%[12],病因可能为各种感染性疾病(如乙型肝炎、丙型肝炎、梅毒、疟疾、艾滋病等)、自身免疫病(如系统性红斑狼疮、干燥综合征、类风湿关节炎、IgG4相关肾病)、恶性肿瘤、药物等。
新月体由增生的壁层上皮细胞和渗出的单核细胞构成,其间可有中性粒细胞和淋巴细胞等炎症细胞浸润,以上成分附着于肾小囊壁层,在毛细血管球外侧呈新月状或环状结构分布。新月体是最具侵袭性的肾小球结构损伤,可能由抗GBM疾病、抗中性粒细胞胞质抗体(antineutrophil cytoplasmic antibody,ANCA)相关的肾小球肾炎或部分非常罕见的特发性疾病引起[13]。新月体性肾小球肾炎通常以急进性肾功能下降为主要的临床表现,是发生终末期肾病的主要原因之一。
PLA2R相关MN合并新月体形成极为罕见。北京大学第一医院肾内科2008年至2014年收治的401例PMN患者中仅28例(6.9%)合并新月体形成,且新月体在肾小球中的占比仅为4.9%,但这28例中79.7%的患者抗PLA2R抗体阳性[14]。有研究发现MN合并新月体肾炎(membranous nephropathy combined with crescentic glomerulonephritis,MNCG)与无新月体形成的MN相比,MNCG常表现为更明显的血尿和肾功能不全,易进展为终末期肾病[14-15]。关于MN合并新月体形成的治疗,公认的方案是糖皮质激素(常需要糖皮质激素冲击)联合免疫抑制剂[15],近年来随着新型生物制剂的发展,也有不少病例接受了生物制剂治疗。但MN合并新月体形成对于糖皮质激素+免疫抑制剂的治疗反应性差[14]。有研究对已排除SMN、抗GBM疾病、ANCA相关疾病的MN合并新月体形成患者的短期预后进行分析,发现MN治疗可达到完全缓解或部分缓解标准,但常出现肌酐水平较基线翻倍的情况,新月体形成和间质纤维化的比例较高是肌酐水平翻倍的危险因素[16-17]。MNCG可见于MN合并抗GBM病或ANCA相关疾病者,但是对于无上述合并症的MN患者而言,极少发现新月体形成。因此,MN合并新月体形成可能是2种疾病恰巧共同出现,也可能是2种疾病在病因上存在着关联。或许后一种说法更加可信:上皮下免疫复合物沉积可以促进GBM损伤,导致抗GBM抗体产生;反之,当GBM由于受到抗GBM抗体或其他抗体损伤而暴露了抗原表位后,可以导致免疫复合物在GBM的上皮下沉积而出现MN的病理表现[15]。有学者认为,MN合并新月体形成可能是MN的一种独特的亚型[16]。本病例肾穿刺病理标本可见8个肾小球,其中有1个合并新月体形成。一方面,本病例未达到光镜检查需10个肾小球以上的标准,亦未达到新月体肾炎(50%以上的肾小球出现新月体)的诊断标准;另一方面,肾穿刺活检是基于局部来推论肾脏整体受累情况,如遇病变分布不均匀,难免会出现以偏概全的情况。基于此,本例中较少的肾小球和新月体对肾脏整体的病理改变的代表性和准确性不佳,只能通过后续的随访观察进一步判断,必要时可考虑重复肾活检。本例患者拒绝重复肾活检,但其肾功能迅速进展、出现肉眼血尿,不能排除新月体肾炎的诊断。
对于PLA2R相关MN特征性的抗PLA2R抗体是否与新月体形成有关也存在争议。有研究比较了MN合并/不合并新月体患者的血清抗PLA2R抗体阳性率,未发现统计学差异,因此认为PLA2R抗体可能与新月体形成无关[14, 16-17]。Lu等[18]报告了1例PLA2R相关MNCG患者,其肾功能迅速恶化,血液中抗PLA2R抗体亚型以IgG3、IgG4为主,经血浆置换+利妥昔单抗+糖皮质激素治疗后,患者血液抗PLA2R抗体转阴,蛋白尿完全缓解并且肾功能恢复正常,由此判断IgG3可能具有致病性且是导致该病例中新月体形成的原因。推荐此类患者采用血浆置换联合应用利妥昔单抗治疗。尽管目前利妥昔单抗的长期肾脏保护功能还不清楚,而且其对高抗体滴度患者的治疗效果稍差,但是利妥昔单抗以其确切的疗效及较好的安全性,现已成为中-高危PMN治疗的一线用药,并且可用于慢性肾脏病4~5期的患者[4]。
本例患者起病初期除较高的尿蛋白水平外,还表现为突出的镜下血尿,变形红细胞占比达0.46。这和肾脏病理改变系膜增生性相关。但患者在1个月内(2019年4月5日至5月5日)血常规中的血红蛋白从99 g/L下降至67 g/L,血红蛋白大幅度降低的常见原因并非镜下血尿,而可能是出血性疾病如肾脏穿刺后血肿、变异的血管破裂引起血尿,还要考虑环磷酰胺引起的膀胱炎、药物引起的间质性肾炎、MN并发肾静脉血栓形成等,但经过血管彩超、膀胱镜、腹部CT等检查后上述情况基本排除,通过治疗反应来看,符合肾穿刺后出血。
本病例在治疗过程中多次调整治疗方案,主要有以下几个方面的考虑:(1)糖皮质激素+环磷酰胺治疗后出现急剧的肾功能下降和肉眼血尿,一方面考虑新月体及系膜增生所致,另一方面,由于环磷酰胺的常见不良反应为出血性膀胱炎,无法排除环磷酰胺的可能,因此换用其他免疫抑制剂;(2)糖皮质激素联合他克莫司治疗长达21个月后,病情未达到完全缓解;(3)尽管患者表现为不典型MN(系膜增生、细胞性新月体形成),但未发现常见的导致新月体形成的继发性因素(排除狼疮性肾炎、乙型肝炎等,未发现抗ANCA/GBM抗体等),缺乏启动血浆置换的指征。本病例的病程后期,抗PLA2R抗体转阴,但蛋白尿仍较多,一方面由于蛋白尿的缓解常滞后于抗体的下降,另一方面可能是因为抗体水平与患者症状表现常不平行[19],且严重的蛋白尿是MN无法缓解的独立危险因素[20]。当自身免疫反应启动,产生的抗体数量较少不足以破坏肾小球滤过屏障时,患者可暂无症状;当体液免疫增强、抗体产生增多后,免疫复合物沉积、足细胞受损,出现蛋白尿,此时血液和组织中就可检出抗PLA2R抗体。随着肾小球损伤逐渐加重,患者尿蛋白逐渐增多直至出现MN的临床表现,此时抗体滴度一般较高,说明疾病正处于活动期。在抗体产生逐渐减少甚至消失之后,因为GBM已经损伤、尚未恢复至正常,所以临床症状还将持续。所以蛋白尿可能会在免疫疾病活动停止后持续很长时间,因此并不总是需要开始或升级免疫抑制治疗[21]。对于MN合并系膜增生及新月体形成的肾病,目前尚没有统一的治疗方案,对于PLA2R抗体阳性的此类患者是否需要积极通过应用利妥昔单抗或血浆置换,争取早期将抗体完全清除还需要进一步的研究。尽管如此,对于PLA2R相关MN合并新月体形成的患者,在传统治疗(糖皮质激素联合环磷酰胺)有禁忌或不良反应时,利妥昔单抗提供了另一个临床治疗的选择。
| [1] |
HU R M, QUAN S X, WANG Y Z, ZHOU Y L, ZHANG Y, LIU L, et al. Spectrum of biopsy proven renal diseases in Central China: a 10-year retrospective study based on 34, 630 cases[J/OL]. Sci Rep, 2020, 10: 10994. DOI: 10.1038/s41598-020-67910-w.
|
| [2] |
RONCO P, DEBIEC H. Molecular pathogenesis of membranous nephropathy[J]. Annu Rev Pathol, 2020, 15: 287-313. DOI:10.1146/annurev-pathol-020117-043811 |
| [3] |
BECK L H Jr, BONEGIO R G B, LAMBEAU G, BECK D M, POWELL D W, CUMMINS T D, et al. M-type phospholipase A2 receptor as target antigen in idiopathic membranous nephropathy[J]. N Engl J Med, 2009, 361: 11-21. DOI:10.1056/NEJMoa0810457 |
| [4] |
ROVIN B H, ADLER S G, BARRATT J, BRIDOUX F, BURDGE K A, CHAN T M, et al. Executive summary of the KDIGO 2021 guideline for the management of glomerular diseases[J]. Kidney Int, 2021, 100: 753-779. DOI:10.1016/j.kint.2021.05.015 |
| [5] |
LI X, WEI D, ZHOU Z M, WANG B G, XU Y, PAN J, et al. Anti-PLA2R antibodies in Chinese patients with membranous nephropathy[J]. Med Sci Monit, 2016, 22: 1630-1636. DOI:10.12659/MSM.896090 |
| [6] |
QIN H Z, ZHANG M C, LE W B, REN Q, CHEN D C, ZENG C H, et al. Combined assessment of phospholipase A2 receptor autoantibodies and glomerular deposits in membranous nephropathy[J]. J Am Soc Nephrol, 2016, 27: 3195-3203. DOI:10.1681/ASN.2015080953 |
| [7] |
DONG D, FAN T T, WANG Y Y, ZHANG L, SONG L, ZHANG L. Relationship between renal tissues phospholipase A2 receptor and its serum antibody and clinical condition and prognosis of idiopathic membranous nephropathy: a meta-analysis[J/OL]. BMC Nephrol, 2019, 20: 444. DOI: 10.1186/s12882-019-1638-x.
|
| [8] |
RAO S J, SHEN Q, WANG H M, TANG S, WANG X Y. The association of anti-PLA2R with clinical manifestations and outcomes in idiopathic membranous nephropathy: a meta-analysis[J]. Int Urol Nephrol, 2020, 52: 2123-2133. DOI:10.1007/s11255-020-02588-7 |
| [9] |
SETHI S, DEBIEC H, MADDEN B, CHARLESWORTH M C, MORELLE J, GROSS L, et al. Neural epidermal growth factor-like 1 protein (NELL-1) associated membranous nephropathy[J]. Kidney Int, 2020, 97: 163-174. DOI:10.1016/j.kint.2019.09.014 |
| [10] |
TOMAS N M, BECK L H Jr, MEYER-SCHWESINGER C, SEITZ-POLSKI B, MA H, ZAHNER G, et al. Thrombospondin type-1 domain-containing 7A in idiopathic membranous nephropathy[J]. N Engl J Med, 2014, 371: 2277-2287. DOI:10.1056/NEJMoa1409354 |
| [11] |
HOXHA E, REINHARD L, STAHL R A K. Membranous nephropathy: new pathogenic mechanisms and their clinical implications[J]. Nat Rev Nephrol, 2022, 18: 466-478. |
| [12] |
ALSHARHAN L, BECK L H Jr. Membranous nephropathy: core curriculum 2021[J]. Am J Kidney Dis, 2021, 77: 440-453. DOI:10.1053/j.ajkd.2020.10.009 |
| [13] |
RODRIGUEZ E F, NASR S H, LARSEN C P, SETHI S, FIDLER M E, CORNELL L D. Membranous nephropathy with crescents: a series of 19 cases[J]. Am J Kidney Dis, 2014, 64: 66-73. DOI:10.1053/j.ajkd.2014.02.018 |
| [14] |
WANG J, ZHU P, CUI Z, QU Z, ZHANG Y M, WANG F, et al. Clinical features and outcomes in patients with membranous nephropathy and crescent formation[J/OL]. Medicine (Baltimore), 2015, 94: e2294. DOI: 10.1097/MD.0000000000002294.
|
| [15] |
ALAWIEH R, BRODSKY S V, SATOSKAR A A, NADASDY T, PARIKH S V, ROVIN B, et al. Membranous nephropathy with crescents[J]. Kidney Int Rep, 2020, 5: 537-541. DOI:10.1016/j.ekir.2020.01.010 |
| [16] |
SAITO M, KOMATSUDA A, SATO R, SAITO A, KAGA H, ABE F, et al. Clinicopathological and long-term prognostic features of membranous nephropathy with crescents: a Japanese single-center experience[J]. Clin Exp Nephrol, 2018, 22: 365-376. DOI:10.1007/s10157-017-1465-y |
| [17] |
钱玉珺, 左科, 李世军, 李晓梅, 曾彩虹, 刘志红, 等. 膜性肾病合并新月体形成的临床病理分析[J]. 医学研究生学报, 2015, 28: 1262-1267. |
| [18] |
LU H, CUI Z, ZHOU X J, JIN Q Z, YU X J, WANG S X, et al. Plasma exchange and rituximab treatments in primary membranous nephropathy combined with crescentic glomerulonephritis: a case report[J/OL]. Medicine (Baltimore), 2019, 98: e15303. DOI: 10.1097/MD.0000000000015303.
|
| [19] |
BURBELO P D, JOSHI M, CHATURVEDI A, LITTLE D J, THURLOW J S, WALDMAN M, et al. Detection of PLA2R autoantibodies before the diagnosis of membranous nephropathy[J]. J Am Soc Nephrol, 2020, 31: 208-217. DOI:10.1681/ASN.2019050538 |
| [20] |
GAO S, CUI Z, WANG X, ZHANG Y M, WANG F, CHENG X Y, et al. Rituximab therapy for primary membranous nephropathy in a Chinese cohort[J/OL]. Front Med (Lausanne), 2021, 8: 663680. DOI: 10.3389/fmed.2021.663680.
|
| [21] |
SAFAR-BOUERI L, PIYA A, BECK L H Jr, AYALON R. Membranous nephropathy: diagnosis, treatment, and monitoring in the post-PLA2R era[J]. Pediatr Nephrol, 2021, 36: 19-30. DOI:10.1007/s00467-019-04425-1 |
 2022, Vol. 43
2022, Vol. 43


