2. 广西医科大学生物医药协同创新中心, 南宁 530021;
3. 江南大学食品科学与技术国家重点实验室, 无锡 214122
2. Collaborative Innovation Centre for Biomedicine, Guangxi Medical University, Nanning 530021, Guangxi Zhuang Autonomous Region, China;
3. State Key Laboratory of Food Science and Technology, Jiangnan University, Wuxi 214122, Jiangsu, China
严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)是一种人类致病性冠状病毒,其引起的新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)自2019年12月暴发以来,全球COVID-19疫情持续处于高位流行水平。WHO网站(https://covid19.who.int/)发布数据显示,截至2021年11月1日已超过2.4亿人感染SARS-CoV-2并导致超过501万人死亡。面对来势汹汹的SARS-CoV-2,亟须加强对其感染机制的认识。受体是影响病毒感染和组织嗜性的关键因素。最新研究表明,血管紧张素转换酶(angiotensin-converting enzyme,ACE)2是SARS-CoV-2感染人类细胞的受体,并参与介导病毒感染所致的肺损伤、心脏损伤、肾损伤、睾丸损伤、血管损伤等多种组织器官损伤[1-2]。在COVID-19暴发流行初期,以肺炎为主要表现的下呼吸道损伤最为常见,提示肺是SARS-CoV-2攻击的主要靶器官[3-4]。但目前人肺中ACE2的表达尚未完全清楚,SARS-CoV-2是否通过ACE2感染人肺也存在争议[5]。本研究通过生物信息学方法和免疫组织化学方法检测人肺中ACE2的表达,并对SARS-CoV-2感染人肺及其引起损伤的ACE2机制进行初步探讨,以期为该病毒感染及其治疗、防控等方面的研究提供依据。
1 材料和方法 1.1 转录组数据与组织标本人体正常组织器官的转录组数据来源于基因型-组织表达(Genotype-Tissue Expression,GTEx)数据库(https://gtexportal.org)的TOIL RSEM expected-count.v7和GTEx phenotype.v7数据包。8例人肺组织标本取自广西医科大学第一附属医院确诊肺癌或疑似肺癌患者的肺部结节(已切除可疑病变部位),排除呼吸道感染及肺部炎症患者的肺切除手术标本,正常人肾组织蜡块切片取自广西医科大学第一附属医院病理科。上述组织标本采集均经患者知情同意,本研究通过广西医科大学医学伦理委员会审批。
1.2 基因转录数据处理与分析参考Uhlen等[6]的数据处理方法,使用edgeR软件包对转录数据进行每千个碱基的转录每百万映射读取的抄本数(transcripts per kilobase of exon model per million mapped reads,TPM)标准化处理,得到基因的标准化表达量,即蛋白编码基因的每千个碱基的转录每百万映射读取的抄本数(protein-coding transcripts per kilobase of exon model per million mapped reads,pTPM)进行分析,将基因表达的阈值设为1 pTPM。
1.3 组织蜡块切片制作及病理检查新鲜人肺组织迅速置入4 ℃预冷的F12K培养基(美国Gibco公司)进行保存和运输。组织先用4 ℃预冷的PBS反复冲洗数次,然后用手术刀切除可疑病变部位,最后分别游离出支气管组织和肺组织。处理后的组织经甲醛固定、梯度乙醇脱水、石蜡包埋、4 μm厚连续切片、贴片、烤片后制成组织蜡块切片。组织蜡块切片经二甲苯脱蜡、梯度乙醇水化后行常规H-E染色,光学显微镜下观察。
1.4 ACE2免疫组织化学检测组织蜡块切片经二甲苯脱蜡、梯度乙醇水化后,按照免疫组织化学超敏UltraSensitiveTM SP试剂盒(福州迈新生物技术开发有限公司)说明书进行实验,采用1 mol/L Tris-HCl缓冲液(pH=8.8)和高压蒸汽法进行抗原修复,一抗孵育采用兔抗人ACE2抗体(武汉博士德生物工程有限公司),1∶100稀释、4 ℃湿盒过夜孵育,染色行DAB显色和苏木精复染。同时采用PBS代替一抗作阴性对照,人肾组织蜡块切片作阳性对照。免疫组织化学检测结果的判定标准:光学显微镜下随机观察5个高倍视野,以阴性对照为参考,阳性显色强度以无显色、淡黄色、棕黄色、棕褐色分别计0~3分,阳性细胞比例以无、<25%、25%~49%、50%~74%、≥75%分别计0~4分,将2项指标得分相加0分为阴性(-)、1~2分为弱阳性(+)、3~4分为阳性(┼┼)、5~7分为强阳性(┼┼┼)[7]。
1.5 统计学处理采用SPSS 23.0统计软件进行数据分析。转录水平的组间比较行Welch方差分析,事后比较行Games-Howell检验;免疫组化的组间比较行Kruskal-Wallis非参数检验,事后比较行所有成对比较检验。检验水准(α)为0.05。
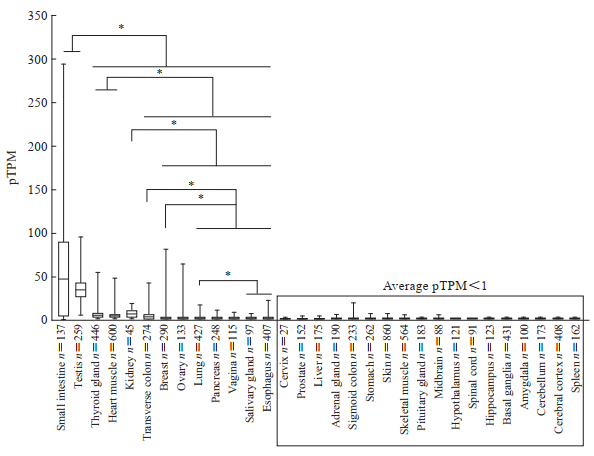
2 结果 2.1 人体正常组织器官ACE2基因转录水平分析人体正常组织器官间ACE2基因转录水平差异有统计学意义(F=1 104,P<0.001)。ACE2基因主要高表达于人小肠、睾丸,其次是甲状腺、心肌、肾脏、横结肠、乳腺,卵巢、肺、胰腺、阴道、唾液腺、食管存在低水平表达(其中肺的平均pTPM为1.1),而子宫颈、前列腺、肝脏、肾上腺、乙状结肠、胃、皮肤、骨骼肌、脑、脊髓及脾脏可视为仅有限表达或不表达(平均pTPM均<1)。见图 1。
|
图 1 人体各组织器官的ACE2基因转录水平 Fig 1 Transcription levels of ACE2 gene in various tissues and organs of human The DNA data of various tissues and organs collected for analysis were from Genotype-Tissue Expression database (https://gtexportal.org). *P < 0.05. ACE2: Angiotensin-converting enzyme 2; pTPM: Protein-coding transcripts per kilobase of exon model per million mapped reads. |
2.2 人肺组织的H-E染色检查
实验所用人肺组织和人支气管组织各解剖部位结构完整,未见细胞坏死脱落、癌变、炎性渗出、纤维化、钙化、气道扩张等异常病理改变,表明实验组织均为正常组织,可反映组织的正常生理特性。
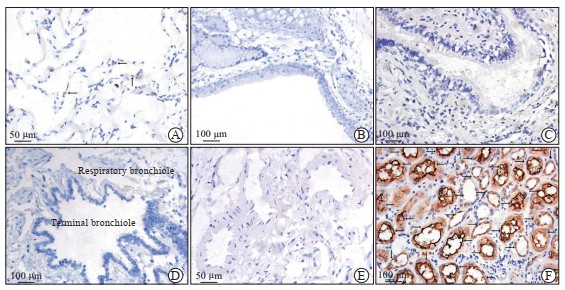
2.3 人肺组织中ACE2的分布及表达ACE2在人肺组织中的分布差异有统计学意义(H=13.286,P<0.01),其在肺泡组织的分布高于血管内皮组织及各级支气管组织(Z=2.688,调整后P<0.05)。在肺泡组织,ACE2的表达阳性率为50%(4/8),主要呈弱阳性散在分布于Ⅱ型肺泡上皮细胞,而在Ⅰ型肺泡上皮细胞、肺泡巨噬细胞等其他类型细胞均未见表达。同时,在血管内皮组织以及支气管、细支气管、终末细支气管、呼吸性细支气管等各级支气管组织也均未见ACE2表达。见图 2。
|
图 2 人肺组织中ACE2的免疫组织化学染色检测结果 Fig 2 Immunohistochemical staining detection of ACE2 in human lung tissue A: Only a small number of type Ⅱ alveolar epithelial cells were ACE2 positive in alveolar tissue; B-D: Bronchial tissue (B), bronchiole tissue, terminal bronchiole tissue (C) and respiratory bronchiole tissue (D) were ACE2 negative; E: Vascular endothelial tissue was ACE2 negative; F: Human kidney tissue was used as positive control. The ACE2 positive expression in all images were indicated by black arrows. ACE2: Angiotensin-converting enzyme 2. |
3 讨论
人类ACE2基因位于染色体Xp22,包含18个外显子,共编码805个氨基酸,是一类具有胞外锌金属蛋白酶催化结构域活性的Ⅰ型跨膜糖蛋白[8]。ACE2主要发挥以下3种生物功能:(1)ACE2及其同工酶ACE在肾素-血管紧张素系统中充当关键调节酶,ACE主要通过正向调节作用于血管紧张素(angiotensin,Ang)Ⅰ生成AngⅡ进而发挥促进血管收缩、炎症反应和组织纤维化等作用;ACE2则发挥负向调节作用,通过裂解AngⅡ生成Ang(1-7)多肽发挥促进血管舒张、抗凋亡和抗增殖等作用。(2)在肠道和肾脏中,ACE2和其同系物Collectrin可以增强中性氨基酸转运体B0AT1的极化表达和活性,促进肠道和肾脏的氨基酸吸收。(3)ACE2被证明是严重急性呼吸综合征冠状病毒(severe acute respiratory syndrome coronavirus,SARS-CoV)的人兽共用受体,不同物种(包括人、水貂、猫、果子狸、菊头蝠等)的ACE2均可以支持SARS-CoV和SARS-CoV-2的感染与复制,与该类病毒的跨种属传播和人际流行密切相关[9]。
研究表明,人类ACE2对SARS-CoV-2刺突蛋白的亲和力较ACE2对SARS-CoV的亲和力高10~20倍,是SARS-CoV-2具有更高传染性的重要原因[10]。值得注意的是,ACE2除了介导病毒的直接感染,还间接促进了病毒感染所致的组织损伤。一项小鼠染毒研究发现,感染SARS-CoV或注射病毒刺突蛋白均可诱导肺部细胞的ACE2降解,进而引起ACE/ACE2轴的失衡和AngⅡ的增加,最终诱发肺水肿及炎症反应,而通过输注重组ACE2调节肾素-血管紧张素系统可以消除SARS-CoV刺突蛋白所致的肺损伤反应[11]。在SARS-CoV-2患者中同样观察到ACE2下调促进了血栓形成、心脏损伤以及肾脏损伤[12-13]。因此,ACE2不仅是SARS-CoV、SARS-CoV-2的受体,也是抵抗这类病毒感染所致组织损伤的重要保护分子,对病毒感染、转归和预后都至关重要。
流行病学调查表明,人类对SARS-CoV-2普遍易感,COVID-19疫情暴发初期大多数COVID-19患者表现出呼吸道感染症状以及CT肺炎影像学特征,提示肺是SARS-CoV-2攻击的主要靶器官[3-4]。本实验利用生物信息学方法,基于GTEx数据库对人体正常组织器官的ACE2基因转录水平进行了研究,发现ACE2基因主要表达于人小肠、睾丸,其次是甲状腺、心肌、肾脏、横结肠、乳腺,而肺中其表达水平较低(平均pTPM为1.1)。同样的,最新一项单细胞RNA测序研究也发现人肺部细胞的ACE2 mRNA表达率极低(约为0.64%),其中Ⅱ型肺泡上皮细胞的阳性率为1.0%~1.8%,平均占阳性细胞总数的83%,而其他细胞类型包括Ⅰ型肺泡上皮细胞、气管上皮细胞、成纤维细胞、血管内皮细胞和肺泡巨噬细胞等ACE2的表达水平及阳性率均远低于Ⅱ型肺泡上皮细胞[14]。本实验进一步应用免疫组织化学染色法对临床采集的原代人肺组织进行ACE2检测,结果与单细胞RNA测序研究结果相似。ACE2在人肺组织不同解剖部位的表达差异有统计学意义,其主要在肺泡组织中的Ⅱ型肺泡上皮细胞上呈弱阳性散在分布,而在血管内皮组织以及支气管、细支气管、终末细支气管、呼吸性细支气管等各级支气管组织均未见表达。另外,本实验中ACE2在人肺组织表达阳性率仅为50%(4/8),推测这可能是个体的差异导致的。
综上所述,本研究发现SARS-CoV-2受体ACE2广泛表达于人体的多个组织器官,与已发现的COVID-19患者体内的SARS-CoV-2分布范围和病理损伤相一致,因此ACE2很可能是导致SARS-CoV-2具有广泛器官嗜性并引起全身感染的重要分子[2]。值得注意的是,ACE2主要高表达于小肠和睾丸,而低表达于肺部,这与疫情初期COVID-19患者以肺炎为主要临床表现而较少伴有肠道功能紊乱、睾丸损伤等症状[3-4, 15]并不相符。这可能与肺的开放程度更高以及受限于SARS-CoV-2的空气传播特性和气血屏障等肺部生理阻隔导致的病毒复制部位集中有关。2项独立的COVID-19患者尸检病理报告也发现,肺内感染或全身感染患者的肺部病毒载量均远高于肺外器官,炎症程度也更为显著,且肺部的病毒载量与肺外病毒阳性的器官数量呈正相关,表明SARS-CoV-2主要在肺部复制继而向其他组织器官扩散[16-17]。
本实验发现人肺具有感染SARS-CoV-2的ACE2分子基础,并且主要定位于少量的Ⅱ型肺泡上皮细胞,然而ACE2基因及蛋白在人肺的表达水平较低且部位局限,因此SARS-CoV-2在人肺中感染不仅仅依赖于ACE2分子,可能还存在其他感染机制。最新研究已发现一些与SARS-CoV-2感染相关的潜在受体,如白细胞分化抗原147、神经纤毛蛋白1、受体酪氨酸激酶家族成员Anexelekto和肾损伤分子1,以及通过裂解刺突蛋白发挥协助入侵细胞作用的弗林蛋白酶、跨膜丝氨酸蛋白酶2和组织蛋白酶等宿主细胞蛋白酶[18-23]。除了肺,这些潜在受体还进一步解释了为什么SARS-CoV-2能突破ACE2受体限制而感染其他低表达ACE2的组织器官,如肝和脑[17]。但这些潜在受体的分布和对病毒感染及复制能力的影响尚未完全明确。ACE2在人肺的低表达也可能加剧了SARS-CoV-2感染后肺部的ACE/ACE2轴失衡,从而加重了肺损伤,提示输注ACE2或ACE2激动剂对SARS-CoV-2的治疗具有潜在应用价值。
需要强调的是,本研究中的人肺组织来源于肺癌或疑似肺癌的肺部结节患者的肺切除手术标本中的正常肺组织,尚不能完全等同于正常人的肺组织。机体的不同生理和病理条件也会影响ACE2的表达,如性别、年龄、吸烟史、性激素水平以及血压等因素[24],而本研究纳入的转录组数据以及人肺组织标本均来源于正常肺组织且例数有限,未能进行不同生理和病理条件下ACE2的表达差异分析。
| [1] |
ZHOU P, YANG X L, WANG X G, HU B, ZHANG L, ZHANG W, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin[J]. Nature, 2020, 579: 270-273. DOI:10.1038/s41586-020-2012-7 |
| [2] |
ASHRAF U M, ABOKOR A A, EDWARDS J M, WAIGI E W, ROYFMAN R S, HASAN S A, et al. SARS-CoV-2, ACE2 expression, and systemic organ invasion[J]. Physiol Genomics, 2021, 53: 51-60. DOI:10.1152/physiolgenomics.00087.2020 |
| [3] |
耿梦杰, 任翔, 余建兴, 蒋荣猛, 李中杰, 冯子健, 等. 不同年龄组新型冠状病毒肺炎患者临床特征分析[J]. 疾病监测, 2021, 36: 573-580. |
| [4] |
FU L W, WANG B Y, YUAN T W, CHEN X T, AO Y L, FITZPATRICK T, et al. Clinical characteristics of coronavirus disease 2019(COVID-19) in China: a systematic review and meta-analysis[J]. J Infect, 2020, 80: 656-665. DOI:10.1016/j.jinf.2020.03.041 |
| [5] |
NAWIJN M C, TIMENS W. Can ACE2 expression explain SARS-CoV-2 infection of the respiratory epithelia in COVID-19?[J/OL]. Mol Syst Biol, 2020, 16: e9841. DOI: 10.15252/msb.20209841.
|
| [6] |
UHLEN M, KARLSSON M J, ZHONG W, TEBANI A, POU C, MIKES J, et al. A genome-wide transcriptomic analysis of protein-coding genes in human blood cells[J/OL]. Science, 2019, 366: eaax9198. DOI: 10.1126/science.aax9198.
|
| [7] |
杨利, 张增峰, 樊晓晖, 梁珍丽, 林天松, 王月英, 等. 鹧鸪禽流感病毒和人流感病毒唾液酸受体分布特征[J]. 中国人兽共患病学报, 2014, 30: 545-550. DOI:10.3969/cjz.j.issn.1002-2694.2014.06.001 |
| [8] |
WIESE O, ZEMLIN A E, PILLAY T S. Molecules in pathogenesis: angiotensin converting enzyme 2(ACE2)[J]. J Clin Pathol, 2021, 74: 285-290. DOI:10.1136/jclinpath-2020-206954 |
| [9] |
GHEBLAWI M, WANG K M, VIVEIROS A, NGUYEN Q, ZHONG J C, TURNER A J, et al. Angiotensin-converting enzyme 2:SARS-CoV-2 receptor and regulator of the renin-angiotensin system: celebrating the 20th anniversary of the discovery of ACE2[J]. Circ Res, 2020, 126: 1456-1474. DOI:10.1161/CIRCRESAHA.120.317015 |
| [10] |
WRAPP D, WANG N S, CORBETT K S, GOLDSMITH J A, HSIEH C L, ABIONA O, et al. Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation[J]. Science, 2020, 367: 1260-1263. DOI:10.1126/science.abb2507 |
| [11] |
KUBA K, IMAI Y, RAO S, GAO H, GUO F, GUAN B, et al. A crucial role of angiotensin converting enzyme 2(ACE2) in SARS coronavirus-induced lung injury[J]. Nat Med, 2005, 11: 875-879. DOI:10.1038/nm1267 |
| [12] |
LI X T, ZHANG M W, ZHANG Z Z, CAO Y D, LIU X Y, MIAO R, et al. Abnormal apelin-ACE2 and SGLT2 signaling contribute to adverse cardiorenal injury in patients with COVID-19[J]. Int J Cardiol, 2021, 336: 123-129. DOI:10.1016/j.ijcard.2021.05.029 |
| [13] |
SIVARAMAN D, LEELA K, VENUGOPAL V. ACE2 downregulation promotes thrombosis and cardiac injury in COVID-19 patients[J]. Asian Pac J Trop Med, 2021, 14: 330-332. DOI:10.4103/1995-7645.320524 |
| [14] |
ZHAO Y, ZHAO Z X, WANG Y J, ZHOU Y Q, MA Y, ZUO W. Single-cell RNA expression profiling of ACE2, the receptor of SARS-CoV-2[J]. Am J Respir Crit Care Med, 2020, 202: 756-759. DOI:10.1164/rccm.202001-0179LE |
| [15] |
MA X X, GUAN C H, CHEN R, WANG Y Y, FENG S L, WANG R S, et al. Pathological and molecular examinations of postmortem testis biopsies reveal SARS-CoV-2 infection in the testis and spermatogenesis damage in COVID-19 patients[J]. Cell Mol Immunol, 2021, 18: 487-489. DOI:10.1038/s41423-020-00604-5 |
| [16] |
YAO X H, LUO T, SHI Y, HE Z C, TANG R, ZHANG P P, et al. A cohort autopsy study defines COVID-19 systemic pathogenesis[J]. Cell Res, 2021, 31: 836-846. DOI:10.1038/s41422-021-00523-8 |
| [17] |
PUELLES V G, LÜTGEHETMANN M, LINDENMEYER M T, SPERHAKE J P, WONG M N, ALLWEISS L, et al. Multiorgan and renal tropism of SARS-CoV-2[J]. N Engl J Med, 2020, 383: 590-592. DOI:10.1056/NEJMc2011400 |
| [18] |
GENG J J, CHEN L, YUAN Y F, WANG K, WANG Y C, QIN C, et al. CD147 antibody specifically and effectively inhibits infection and cytokine storm of SARS-CoV-2 and its variants delta, alpha, beta, and gamma[J/OL]. Signal Transduct Target Ther, 2021, 6: 347. DOI: 10.1038/s41392-021-00760-8.
|
| [19] |
DALY J L, SIMONETTI B, KLEIN K, CHEN K E, WILLIAMSON M K, ANTÓN-PLÁGARO C, et al. Neuropilin-1 is a host factor for SARS-CoV-2 infection[J]. Science, 2020, 370: 861-865. DOI:10.1126/science.abd3072 |
| [20] |
CANTUTI-CASTELVETRI L, OJHA R, PEDRO L D, DJANNATIAN M, FRANZ J, KUIVANEN S, et al. Neuropilin-1 facilitates SARS-CoV-2 cell entry and infectivity[J]. Science, 2020, 370: 856-860. DOI:10.1126/science.abd2985 |
| [21] |
WANG S, QIU Z Y, HOU Y N, DENG X Y, XU W, ZHENG T T, et al. AXL is a candidate receptor for SARS-CoV-2 that promotes infection of pulmonary and bronchial epithelial cells[J]. Cell Res, 2021, 31: 126-140. DOI:10.1038/s41422-020-00460-y |
| [22] |
YANG C, ZHANG Y, ZENG X, CHEN H J, CHEN Y C, YANG D, et al. Kidney injury molecule-1 is a potential receptor for SARS-CoV-2[J]. J Mol Cell Biol, 2021, 13: 185-196. DOI:10.1093/jmcb/mjab003 |
| [23] |
SHANG J, WAN Y S, LUO C M, YE G, GENG Q B, AUERBACH A, et al. Cell entry mechanisms of SARS-CoV-2[J]. Proc Natl Acad Sci USA, 2020, 117: 11727-11734. DOI:10.1073/pnas.2003138117 |
| [24] |
LI Y W, ZHOU W, YANG L, YOU R. Physiological and pathological regulation of ACE2, the SARS-CoV-2 receptor[J/OL]. Pharmacol Res, 2020, 157: 104833. DOI: 10.1016/j.phrs.2020.104833.
|
 2022, Vol. 43
2022, Vol. 43


