糖尿病是一种以高血糖为特征的内分泌疾病。在糖尿病人群中,2型糖尿病(type 2 diabetes mellitus,T2DM)占比约为90%。据估计,2019年全世界糖尿病患者有4.63亿例,预计到2030年可达5.78亿例[1]。糖尿病膀胱功能障碍(diabetic bladder dysfunction,DBD)是一种常见的糖尿病并发症[2],在糖尿病患者血糖控制欠佳者中有50%以上继发DBD[3]。DBD涉及多种症状,包括储尿问题(如膀胱过度活动症和急迫性尿失禁)及排尿问题(如膀胱排空障碍、尿潴留和尿失禁)[4]。
DBD的病因和发病机制目前仍未明确,当前研究认为氧化应激在DBD发病中有重要意义。核因子E2相关因子2(nuclear factor erythroid derived 2-like 2,Nrf2)是对抗氧化应激的重要调控分子,其作为转录因子可与抗氧化响应元件(antioxidant response element,ARE)结合构成Nrf2-ARE信号通路,从而调控下游抗氧化蛋白分子的表达[5]。目前Nrf2在DBD中的具体机制尚不清楚[6]。本研究探索了Nrf2在DBD中的作用及机制。
1 材料和方法 1.1 实验材料Nrf2抗体(货号ab137550)与神经生长因子(nerve growth factor,NGF)抗体(货号ab52918)购自英国Abcam公司,神经生长因子前体(pro-form of nerve growth factor,Pro-NGF)抗体(货号ALO-ANT-005)购自以色列Alomone公司,β-肌动蛋白(β-actin)抗体(货号4970S)、Bcl-2抗体(货号3498)、Bcl-2关联蛋白X(Bcl-2-associated X,Bax)抗体(货号5023)、还原型辅酶/醌氧化还原酶1[NAD(P)H: quinone oxidoreductase 1,NQO1]抗体(货号62262S)、血红素氧合酶1(heme oxygenase 1,HO-1)抗体(货号86806S)、caspase 3抗体(货号9662)及核纤层蛋白B(lamin B)抗体(货号13435)、兔抗鼠二抗(货号58802)、山羊抗兔二抗(货号7074)购自美国CST公司,内源性过氧化物酶阻断剂(货号AR1108)、非特异性染色阻断剂(货号AR0009)购自武汉博士德生物工程有限公司,TBST溶液(货号C520009)与RIPA裂解液(货号C500007)购自生工生物工程(上海)股份有限公司。BCA蛋白定量试剂盒(货号23225)购自美国ThermoFisher公司。Masson染色试剂盒(货号G1006)购自武汉赛维尔生物科技有限公司,丙二醛ELISA检测试剂盒(货号KTB1050)购自武汉艾美捷科技有限公司,晚期糖基化终末产物(advanced glycation end product,AGE)ELISA检测试剂盒(货号CSB-E09414m)购自德国Cusabio Biotech公司,活性氧ELISA检测试剂盒(货号G-03538X)购自上海雅吉生物科技有限公司,超氧化物歧化酶(superoxide dismutase,SOD)ELISA检测试剂盒(货号S311)购自东仁化学科技(上海)有限公司,谷胱甘肽ELISA检测试剂盒(货号BC1175)购自北京索莱宝科技有限公司。
1.2 实验动物与造模方法8周龄雄性Nrf2基因敲除(Nfe2l2tm1Ywk,Nrf2KO)小鼠及同龄雄性野生型(wild type,WT)C57BL/6小鼠均购自江苏集萃药康生物科技股份有限公司[动物生产许可证号为SCXK(苏)2018-0008],饲养于SPF级环境。动物实验操作均在海军军医大学(第二军医大学)第一附属医院[动物使用许可证号为SYXK(沪)2020-0033]完成,并通过动物实验伦理委员会审批。Nrf2KO与WT小鼠各20只,随机分成Nrf2基因敲除小鼠T2DM造模组(Nrf2KO+T2DM组)、Nrf2基因敲除小鼠对照组(Nrf2KO组)、WT小鼠T2DM造模组(T2DM组)和WT小鼠对照组(WT组),每组10只。T2DM造模的2组小鼠给予高脂饲料(60%脂肪热量)喂养,2组对照小鼠给予普通饲料喂养。饲养12周后,T2DM造模的2组小鼠禁食8 h后给予链脲佐菌素(120 mg/kg)一次性腹腔注射,1周内随机检测1次空腹外周血血糖,血糖>16.7 mmol/L即认定T2DM小鼠模型建立成功。T2DM小鼠造模成功后,继续饲养8周用于实验研究。
1.3 小鼠生理指标检测(1)基础代谢量测量:将小鼠放入单独代谢笼中,监测小鼠24 h饮食、饮水情况及一般状态。小鼠在代谢笼中度过适应期后,将定量饮用水盛于饮水壶中,24 h后测量饮水壶中剩余液体量并计算出小鼠饮水量,同时测量容器中收集的小鼠排尿量。(2)体重及膀胱质量测量:将固定容器置于电子天平并调零,取小鼠或之后分离的膀胱组织放入固定容器中,待天平稳定后读取测量值。(3)血糖、糖化血红蛋白测量:用4%水合氯醛按100 μL/10 g的剂量对小鼠进行腹腔注射麻醉后,固定小鼠并用碘伏清洁消毒尾部,采集尾静脉血液。取新鲜血液滴加到血糖测量仪检测试纸上,利用血糖分析仪(型号One Touch UltraEasy,美国强生公司)测量血糖值。取新鲜血液,采用糖化血红蛋白测量仪(型号DCA Vantage,德国Siemens公司)检测糖化血红蛋白含量。
1.4 蛋白质印迹法处死小鼠并收集小鼠膀胱组织样本。每组随机选取5只小鼠的组织样本,用PBS清洗表面血液,吸干组织上的水分后称取10 mg组织。加入200 µL预冷的RIPA裂解液,于冰上进行匀浆,4 ℃条件下13 000×g离心10 min,取上清液保存待测。利用BCA蛋白试剂盒计算蛋白质浓度,然后分离细胞核蛋白质,提取得到的膀胱组织细胞核蛋白质与总蛋白质分别进行SDS-PAGE、PVDF膜(货号IPVH00010,美国Millipore公司)转膜、抗体孵育(所有一抗均按1∶1 000稀释于TBST溶液,二抗按1∶5 000稀释于TBST溶液),其中细胞核蛋白质检测采用核纤层蛋白B作为内参照,细胞质蛋白质检测采用β-肌动蛋白作为内参照。最后滴加ECL显影液(货号WBKLS0500,美国Millipore公司),利用免疫印迹显影仪(型号AI600,美国GE公司)拍照,并用ImageJ 1.53软件测量条带灰度值。
1.5 Masson染色取制备好的膀胱组织石蜡切片(由武汉赛维尔生物科技有限公司完成)置于烘片机(型号HI1220,德国Leica公司)75 ℃烘烤30 min。将石蜡切片放入盛有PBS的染色盒中,按要求设置自动载玻片染色机(型号Autostainer XL,德国Leica公司)相关参数后,将染色盒放入机器中进行脱蜡。对切片依次进行苏木精染液染色5 min、PBS洗涤6 min、1%盐酸分化5 s、清水冲洗返蓝5 min、梯度乙醇脱水、中性树胶(货号10004160,国药集团)封片。通过显微镜观察并采集图像,利用ImageJ 1.53软件测量膀胱壁厚度。
1.6 免疫组织化学染色将膀胱组织石蜡切片烘烤、脱蜡、洗涤后,除去膀胱组织切片上的PBS,滴加内源性过氧化物酶阻断剂(货号AR1108,武汉博士德生物制品有限公司)。在目标区域内滴加非特异性染色阻断剂(货号AR0009,武汉博士德生物制品有限公司)常温孵育30 min,加PBS洗涤3次,每次5 min。滴加一抗(Nrf2抗体与caspase 3抗体分别按1∶200和1∶1 000稀释于PBS)4 ℃孵育约12 h。之后加PBS洗涤3次,每次5 min。滴加二抗(按1∶200稀释于PBS)室温孵育1 h。经PBS洗涤后进行梯度乙醇脱水,中性树胶封片。在显微镜下观察Nrf2与caspase 3的表达情况并采集图像。
1.7 ELISA检测取收集的膀胱组织,采用试剂盒进行丙二醛、AGE、活性氧、SOD和谷胱甘肽检测,检测过程均严格按照相应的ELISA检测试剂盒说明书操作步骤进行。
1.8 统计学处理应用GraphPad Prism 8.0.2软件进行数据处理及绘图。计量资料以x ±s表示,组间比较采用单因素方差分析,两两比较采用最小显著性差异法。检验水准(α)为0.05。
2 结果 2.1 T2DM模型小鼠构建成功WT组和Nrf2KO组小鼠体重、膀胱质量、血糖、糖化血红蛋白、24 h饮水量及24 h排尿量差异均无统计学意义(P均>0.05)。T2DM组小鼠体重、膀胱质量、血糖、糖化血红蛋白、24 h饮水量及24 h排尿量均高于WT组(P均<0.05),提示T2DM小鼠模型建立成功。Nrf2KO+T2DM组小鼠体重、膀胱质量、血糖、糖化血红蛋白、24 h饮水量及24 h排尿量均高于WT组及Nrf2KO组(P均<0.05),且糖化血红蛋白水平高于T2DM组(P<0.05)。见表 1。
|
|
表 1 各组小鼠生理指标测量结果 Tab 1 Measurement results of physiological indicators of mice in each group |
2.2 各组小鼠膀胱组织形态学改变
Masson染色结果(图 1)显示,WT组与Nrf2KO组小鼠膀胱壁厚度[分别为(702.10±129.91)μm、(678.00±140.30)μm]差异无统计学意义(P>0.05),T2DM组[(916.00±129.82)μm]及Nrf2KO+T2DM组[(880.20±111.58)μm]小鼠膀胱壁厚度均大于WT组及Nrf2KO组(P均<0.05)。以上结果说明T2DM小鼠膀胱组织出现了代偿性增生。

|
图 1 各组小鼠膀胱组织Masson染色 Fig 1 Masson staining of bladder tissues of mice in each group A: WT group (C57BL/6 mice on a normal diet); B: Nrf2KO group (Nrf2 knockout mice on a normal diet); C: T2DM group (T2DM model of C57BL/6 mice); D: Nrf2KO+T2DM group (T2DM model of Nrf2 knockout mice). WT: Wild type; Nrf2: Nuclear factor erythroid derived 2-like 2; T2DM: Type 2 diabetes mellitus. |
2.3 各组小鼠膀胱组织中Nrf2的表达
免疫组织化学染色(图 2A)和蛋白质印迹法(图 2B、2C)检测结果显示,T2DM组小鼠膀胱组织中细胞核Nrf2和总Nrf2蛋白表达水平均低于WT组(P均<0.05),Nrf2KO组及Nrf2KO+T2DM组小鼠膀胱组织中Nrf2均无明显表达。
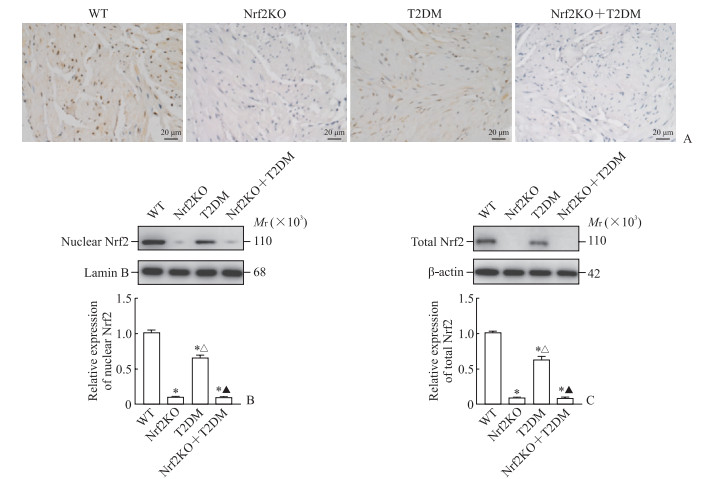
|
图 2 各组小鼠膀胱组织中Nrf2的表达 Fig 2 Expression of Nrf2 in bladder tissues of mice in each group A: Immunohistochemical staining of Nrf2 in mouse bladder tissues; B: Western blotting detection of nuclear Nrf2 expression in bladder tissues; C: Western blotting detection of total Nrf2 expression in bladder tissues. WT group: C57BL/6 mice on a normal diet; Nrf2KO group: Nrf2 knockout mice on a normal diet; T2DM group: T2DM model of C57BL/6 mice; Nrf2KO+T2DM group: T2DM model of Nrf2 knockout mice. *P < 0.05 vs WT group; △P < 0.05 vs Nrf2KO group; ▲P < 0.05 vs T2DM group. n=5, x ±s. WT: Wild type; Nrf2: Nuclear factor erythroid derived 2-like 2; T2DM: Type 2 diabetes mellitus. |
2.4 各组小鼠膀胱组织中细胞凋亡相关分子的表达
免疫组织化学染色(图 3A、3B)显示,WT组及Nrf2KO组小鼠膀胱组织中细胞凋亡分子caspase 3表达无明显差异(P>0.05),而T2DM组、Nrf2KO+T2DM组caspase 3表达高于WT组及Nrf2KO组,且Nrf2KO+T2DM组高于T2DM组(P均<0.05)。蛋白质印迹法检测结果(图 3C)显示,WT组与Nrf2KO组小鼠膀胱组织中Bax/Bcl-2比值(分别为1.00±0.05、1.30±0.09)差异无统计学意义(P>0.05),T2DM组(1.92±0.22)、Nrf2KO+T2DM组(2.55±0.35)Bax/Bcl-2比值均高于WT组及Nrf2KO组,且Nrf2KO+T2DM组高于T2DM组(P均<0.05)。
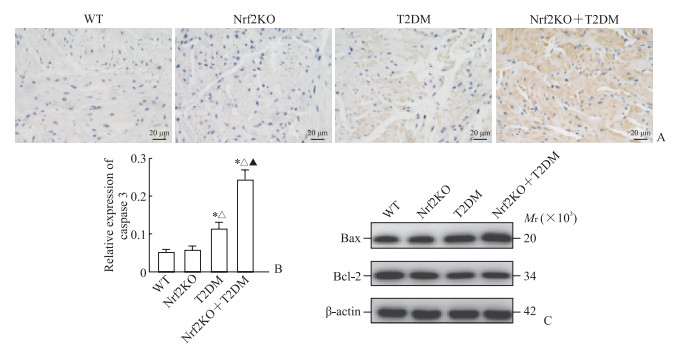
|
图 3 各组小鼠膀胱组织中caspase 3和Bax/Bcl-2的表达 Fig 3 Expression of caspase 3 and Bax/Bcl-2 in bladder tissues of mice in each group A: Immunohistochemical staining of caspase 3 in mouse bladder tissues; B: Relative expression of caspase 3 detected by immunohistochemical staining; C: Western blotting of Bax/Bcl-2 expression in bladder tissues. *P < 0.05 vs WT group; △P < 0.05 vs Nrf2KO group; ▲P < 0.05 vs T2DM group. n=5, x ±s. WT group: C57BL/6 mice on a normal diet; Nrf2KO group: Nrf2 knockout mice on a normal diet; T2DM group: T2DM model of C57BL/6 mice; Nrf2KO+T2DM group: T2DM model of Nrf2 knockout mice. caspase 3: Cysteine aspartic acid specific protease 3; Bax: Bcl-2-associated X; Bcl-2: B-cell lymphoma 2; WT: Wild type; Nrf2: Nuclear factor erythroid derived 2-like 2; T2DM: Type 2 diabetes mellitus. |
2.5 各组小鼠膀胱组织中氧化应激及抗氧化应激相关分子的表达
ELISA检测结果(图 4)显示,Nrf2KO组与WT组小鼠膀胱组织中氧化应激产物AGE、丙二醛、活性氧水平差异均无统计学意义(P均>0.05),T2DM组与Nrf2KO+T2DM组小鼠膀胱组织中AGE、丙二醛、活性氧水平均高于WT组及Nrf2KO组,且Nrf2KO+T2DM组高于T2DM组(P均<0.05);Nrf2KO组与WT组小鼠膀胱组织中抗氧化应激分子SOD、谷胱甘肽水平差异均无统计学意义(P均>0.05),T2DM组与Nrf2KO+T2DM组SOD、谷胱甘肽水平均低于WT组、Nrf2KO组,且Nrf2KO+T2DM组低于T2DM组(P均<0.05)。
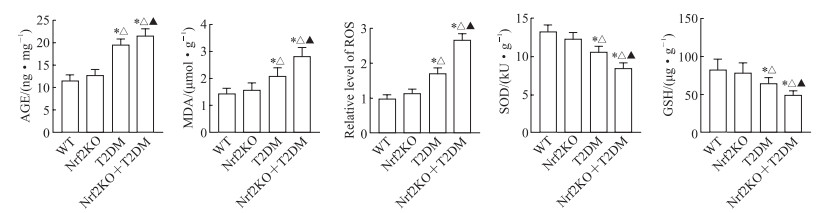
|
图 4 酶联免疫吸附试验检测各组小鼠膀胱组织中氧化应激及抗氧化应激相关分子的表达 Fig 4 Expression of oxidative stress and anti-oxidative stress-related molecules in bladder tissue of mice in each group detected by enzyme-linked immunosorbent assay WT group: C57BL/6 mice on a normal diet; Nrf2KO group: Nrf2 knockout mice on a normal diet; T2DM group: T2DM model of C57BL/6 mice; Nrf2KO+T2DM group: T2DM model of Nrf2 knockout mice. *P < 0.05 vs WT group; △P < 0.05 vs Nrf2KO group; ▲P < 0.05 vs T2DM group. n=5, x ±s. AGE: Advanced glycation end product; MDA: Malondialdehyde; ROS: Reactive oxygen species; SOD: Superoxide dismutase; GSH: Glutathione; WT: Wild type; Nrf2: Nuclear factor erythroid derived 2-like 2; T2DM: Type 2 diabetes mellitus. |
蛋白质印迹法检测结果(图 5)显示,WT组与Nrf2KO组小鼠膀胱组织中抗氧化应激分子NQO1(1.00±0.04、0.83±0.07)和HO-1(1.00±0.04、0.85±0.05)蛋白质表达差异均无统计学意义(P均>0.05),T2DM组、Nrf2KO+T2DM组NQO1(0.72±0.04、0.53±0.08)及HO-1(0.76±0.10、0.56±0.09)蛋白质表达均低于WT组、Nrf2KO组,且Nrf2KO+T2DM组低于T2DM组(P均<0.05)。

|
图 5 蛋白质印迹法检测各组小鼠膀胱组织中抗氧化应激分子的表达 Fig 5 Expression of antioxidant stress molecules in bladder tissues of mice in each group detected by Western blotting WT group: C57BL/6 mice on a normal diet; Nrf2KO group: Nrf2 knockout mice on a normal diet; T2DM group: T2DM model of C57BL/6 mice; Nrf2KO+T2DM group: T2DM model of Nrf2 knockout mice. NQO1: NAD(P)H: quinone oxidoreductase 1; HO-1: Heme oxygenase 1; WT: Wild type; Nrf2: Nuclear factor erythroid derived 2-like 2; T2DM: Type 2 diabetes mellitus. |
2.6 各组小鼠膀胱组织中神经营养因子NGF、Pro-NGF的表达
蛋白质印迹法检测结果(图 6)显示,WT组与Nrf2KO组小鼠膀胱组织中NGF(1.00±0.04、0.92±0.04)、Pro-NGF(1.00±0.04、1.17±0.07)蛋白质表达差异均无统计学意义(P均>0.05);T2DM组、Nrf2KO+T2DM组NGF蛋白质表达(0.72±0.04、0.78±0.05)均低于WT组、Nrf2KO组,且Nrf2KO+T2DM组低于T2DM组(P均<0.05);T2DM组、Nrf2KO+T2DM组Pro-NGF蛋白质表达(1.37±0.07、1.56±0.15)均高于WT组、Nrf2KO组,且Nrf2KO+T2DM组高于T2DM组(P均<0.05)。
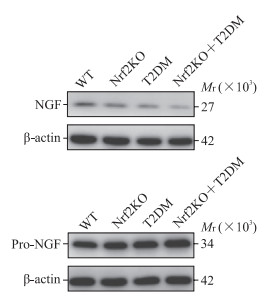
|
图 6 蛋白质印迹法检测各组小鼠膀胱组织中神经营养因子的表达 Fig 6 Expression of neurotrophic factors in bladder tissues of mice in each group detected by Western blotting WT group: C57BL/6 mice on a normal diet; Nrf2KO group: Nrf2 knockout mice on a normal diet; T2DM group: T2DM model of C57BL/6 mice; Nrf2KO+T2DM group: T2DM model of Nrf2 knockout mice. NGF: Nerve growth factor; Pro-NGF: Pro-form of nerve growth factor; WT: Wild type; Nrf2: Nuclear factor erythroid derived 2-like 2; T2DM: Type 2 diabetes mellitus. |
3 讨论
DBD是最常见的糖尿病并发症,其症状包括膀胱过度活动症及膀胱排空障碍、尿潴留等,严重影响患者生活质量[7]。本研究成功构建了T2DM小鼠及Nrf2基因敲除小鼠糖尿病模型,并进一步探索Nrf2在DBD发病中的作用及机制。研究结果显示,Nrf2KO组小鼠各项生理指标、膀胱组织形态学改变与WT组相比差异均无统计学意义,表明单纯敲除Nrf2基因不会影响小鼠的体重、血糖等生理指标及膀胱组织形态学,也不会对小鼠膀胱细胞造成明显损伤。蛋白质印迹法检测结果显示T2DM组小鼠膀胱组织中总Nrf2及核内Nrf2蛋白质的表达量与WT组相比均降低。此外,细胞凋亡分子caspase 3的免疫组织化学染色结果显示,Nrf2KO+T2DM组小鼠膀胱组织中caspase 3的表达与WT组、Nrf2KO组相比均增高,表明在T2DM发生过程中伴随着Nrf2的缺失,小鼠膀胱组织细胞的损伤凋亡更加严重。
本研究结果显示,单纯敲除Nrf2基因不会影响小鼠膀胱组织中AGE、活性氧、丙二醛等氧化应激产物的水平,而这些氧化应激产物在T2DM组的水平高于WT组及Nrf2KO组,且在Nrf2KO+T2DM组的水平高于T2DM组。这一结果表明T2DM小鼠膀胱组织中氧化应激水平升高,而Nrf2基因的敲除加重了氧化应激。此外,T2DM组小鼠膀胱组织中抗氧化应激分子谷胱甘肽和SOD的表达量较WT组及Nrf2KO组低,Nrf2KO+T2DM组谷胱甘肽和SOD的表达量低于其他3组,表明Nrf2基因敲除后小鼠膀胱组织的抗氧化应激能力下降。
本研究还检测了NQO1和HO-1(Nrf2-ARE分子通路下游重要抗氧化分子[8-9])的表达情况,结果显示单纯敲除小鼠Nrf2基因并未对小鼠膀胱内氧化应激调节能力造成影响,而T2DM组小鼠膀胱组织中NQO1及HO-1的表达量均低于WT组及Nrf2KO组,Nrf2KO+T2DM组NQO1及HO-1的表达量进一步降低。以上结果表明T2DM小鼠Nrf2-ARE分子通路受损,下游抗氧化蛋白表达量及活性降低,氧化应激调节能力受损,敲除Nrf2基因的T2DM小鼠膀胱组织氧化应激代谢调节失衡更加严重。
高血糖引起的氧化应激是造成膀胱细胞损伤及凋亡的重要原因[10]。T2DM可导致机体内丙二醛、AGE等增加及醛糖还原酶活化和多元醇途径激活,从而使机体内活性氧进一步增加[11]。现有研究表明,活性氧可以诱导Bax进入线粒体并造成细胞色素C释放,激活caspase从而介导细胞凋亡[12];活性氧通过泛素-蛋白酶体途径引起Bcl-2蛋白降解和表达下调、Bax分子表达上调,启动下游细胞凋亡途径,从而导致平滑肌细胞损伤、凋亡,最终造成膀胱功能障碍[13-14]。本研究利用蛋白质印迹法及免疫组织化学染色技术对小鼠膀胱组织中凋亡相关分子的表达进行检测,结果显示T2DM组小鼠膀胱组织中Bax/Bcl-2比值增高,caspase 3表达增加,且这些改变在Nrf2KO+T2DM组更加显著。这一结果表明氧化应激可以通过激活细胞凋亡途径诱导T2DM小鼠膀胱组织细胞凋亡,而进一步抑制Nrf2分子通路会加重T2DM小鼠膀胱组织细胞的损伤及凋亡,促进DBD进展。
氧化应激会诱导膀胱平滑肌细胞凋亡,还可以通过干扰神经营养因子的合成与代谢影响神经元活性,从而导致参与膀胱功能调控的神经组织发生病变[15-16]。糖尿病神经组织病变是DBD的潜在病因机制,糖尿病状态下NGF等合成及代谢障碍可能是导致神经组织病变的重要因素。Pro-NGF具有与NGF不同的生理功能,Pro-NGF对p75神经营养素受体有较高的亲和力,并可促进细胞凋亡信号转导;而NGF对原肌球蛋白受体激酶A神经营养素受体有较高的亲和力,可以激活神经元中营养信号通路[17]。Pro-NGF和NGF表达量的相对稳定对维持神经元的正常生理功能起着重要作用。膀胱组织中NGF表达降低造成神经元凋亡,可导致膀胱感觉功能降低和膀胱排空能力不全,这种现象在病程较长的糖尿病患者中较为常见[18]。此外,有研究表明,Nrf2通路激活可以上调NGF表达,从而促进经高糖处理后神经元的神经突生长[19]。星形胶质细胞中的Nrf2通过谷氨酸受体和细胞内的Ca2+信号发挥抗氧化作用,对周围神经元和突触具有神经保护功能[20]。利用花青素诱导大鼠膀胱中Nrf2-ARE通路分子的表达,可提高膀胱组织中NGF的表达量,有利于改善糖尿病大鼠的膀胱功能障碍[21]。本研究利用蛋白质印迹技术检测4组小鼠膀胱组织中Pro-NGF和NGF的相对表达量,结果显示与WT组及Nrf2KO组相比,T2DM组和Nrf2KO+T2DM组Pro-NGF表达增加、NGF表达下降。此项实验结果表明,T2DM小鼠膀胱组织中NGF的表达降低与Nrf2分子受到抑制相关。
综上所述,本研究通过Nrf2基因缺失的T2DM小鼠模型证实Nrf2基因在DBD进程中发挥着重要作用,该基因表达下调可加重T2DM小鼠膀胱细胞的损伤与凋亡,加重氧化应激损伤,还能使细胞抗氧化应激能力下降。同时Nrf2表达下调还导致NGF、Pro-NGF等神经营养因子合成障碍与表达减少,这也是导致膀胱功能障碍的潜在原因。
| [1] |
SAEEDI P, PETERSOHN I, SALPEA P, MALANDA B, KARURANGA S, UNWIN N, et al. Global and regional diabetes prevalence estimates for 2019 and projections for 2030 and 2045: results from the International Diabetes Federation Diabetes Atlas, 9th edition[J/OL]. Diabetes Res Clin Pract, 2019, 157: 107843. DOI: 10.1016/j.diabres.2019.107843.
|
| [2] |
ARRELLANO-VALDEZ F, URRUTIA-OSORIO M, ARROYO C, SOTO-VEGA E. A comprehensive review of urologic complications in patients with diabetes[J/OL]. Springerplus, 2014, 3: 549. DOI: 10.1186/2193-1801-3-549.
|
| [3] |
WITTIG L, CARLSON K V, ANDREWS J M, CRUMP R T, BAVERSTOCK R J. Diabetic bladder dysfunction: a review[J]. Urology, 2019, 123: 1-6. DOI:10.1016/j.urology.2018.10.010 |
| [4] |
LIU G M, DANESHGARI F. Diabetic bladder dysfunction[J]. Chin Med J (Engl), 2014, 127: 1357-1364. |
| [5] |
BEHL T, KAUR I, SEHGAL A, SHARMA E, KUMAR A, GROVER M, et al. Unfolding Nrf2 in diabetes mellitus[J]. Mol Biol Rep, 2021, 48: 927-939. DOI:10.1007/s11033-020-06081-3 |
| [6] |
CUADRADO A, ROJO A I, WELLS G, HAYES J D, COUSIN S P, RUMSEY W L, et al. Therapeutic targeting of the NRF2 and KEAP1 partnership in chronic diseases[J]. Nat Rev Drug Discov, 2019, 18: 295-317. DOI:10.1038/s41573-018-0008-x |
| [7] |
DANESHGARI F, LIU G M, BIRDER L, HANNA-MITCHELL A T, CHACKO S. Diabetic bladder dysfunction: current translational knowledge[J]. J Urol, 2009, 182(6 Suppl): S18-S26. |
| [8] |
PRASANNA P L, RENU K, VALSALA GOPALAKRISHNAN A. New molecular and biochemical insights of doxorubicin-induced hepatotoxicity[J/OL]. Life Sci, 2020, 250: 117599. DOI: 10.1016/j.lfs.2020.117599.
|
| [9] |
SONG X H, LONG D X. Nrf2 and ferroptosis: a new research direction for neurodegenerative diseases[J/OL]. Front Neurosci, 2020, 14: 267. DOI: 10.3389/fnins.2020.00267.
|
| [10] |
ANDERSSON K E. Oxidative stress and its possible relation to lower urinary tract functional pathology[J]. BJU Int, 2018, 121: 527-533. DOI:10.1111/bju.14063 |
| [11] |
ROCHETTE L, ZELLER M, COTTIN Y, VERGELY C. Diabetes, oxidative stress and therapeutic strategies[J]. Biochim Biophys Acta, 2014, 1840: 2709-2729. DOI:10.1016/j.bbagen.2014.05.017 |
| [12] |
OLA M S, NAWAZ M, AHSAN H. Role of Bcl-2 family proteins and caspases in the regulation of apoptosis[J]. Mol Cell Biochem, 2011, 351(1/2): 41-58. |
| [13] |
AZAD N, IYER A, VALLYATHAN V, WANG L Y, CASTRANOVA V, STEHLIK C, et al. Role of oxidative/nitrosative stress-mediated Bcl-2 regulation in apoptosis and malignant transformation[J]. Ann N Y Acad Sci, 2010, 1203: 1-6. DOI:10.1111/j.1749-6632.2010.05608.x |
| [14] |
AYHANCI A, TANRIVERDI D T, SAHINTURK V, CENGIZ M, APPAK-BASKOY S, SAHIN I K. Protective effects of boron on cyclophosphamide-induced bladder damage and oxidative stress in rats[J]. Biol Trace Elem Res, 2020, 197: 184-191. DOI:10.1007/s12011-019-01969-z |
| [15] |
DE OLIVEIRA M G, DE MEDEIROS M L, TAVARES E B G, MÓNICA F Z, ANTUNES E. Methylglyoxal, a reactive glucose metabolite, induces bladder overactivity in addition to inflammation in mice[J/OL]. Front Physiol, 2020, 11: 290. DOI: 10.3389/fphys.2020.00290.
|
| [16] |
MOSSA A H, GALAN A, CAMMISOTTO P G, VELASQUEZ FLORES M, SHAMOUT S, BARCELONA P, et al. Antagonism of proNGF or its receptor p75NTR reverses remodelling and improves bladder function in a mouse model of diabetic voiding dysfunction[J]. Diabetologia, 2020, 63: 1932-1946. DOI:10.1007/s00125-020-05222-4 |
| [17] |
SOLIGO M, PROTTO V, FLORENZANO F, BRACCI-LAUDIERO L, DE BENEDETTI F, CHIARETTI A, et al. The mature/pro nerve growth factor ratio is decreased in the brain of diabetic rats: analysis by ELISA methods[J]. Brain Res, 2015, 1624: 455-468. DOI:10.1016/j.brainres.2015.08.005 |
| [18] |
GOMEZ C S, KANAGARAJAH P, GOUSSE A E. Bladder dysfunction in patients with diabetes[J]. Curr Urol Rep, 2011, 12: 419-426. DOI:10.1007/s11934-011-0214-0 |
| [19] |
HSU Y Y, TSENG Y T, LO Y C. Berberine, a natural antidiabetes drug, attenuates glucose neurotoxicity and promotes Nrf2-related neurite outgrowth[J]. Toxicol Appl Pharmacol, 2013, 272: 787-796. DOI:10.1016/j.taap.2013.08.008 |
| [20] |
HABAS A, HAHN J, WANG X H, MARGETA M. Neuronal activity regulates astrocytic Nrf2 signaling[J]. Proc Natl Acad Sci USA, 2013, 110: 18291-18296. DOI:10.1073/pnas.1208764110 |
| [21] |
CHEN S Z, ZHU Y F, LIU Z F, GAO Z Y, LI B Y, ZHANG D Q, et al. Grape seed proanthocyanidin extract ameliorates diabetic bladder dysfunction via the activation of the Nrf2 pathway[J/OL]. PLoS One, 2015, 10: e0126457. DOI: 10.1371/journal.pone.0126457.
|
 2022, Vol. 43
2022, Vol. 43


