IL-18又名γ干扰素诱生因子,是一种促炎性细胞因子,参与先天性和获得性免疫应答的调节[1]。IL-18结构与IL-1β相似,因此被归属到细胞因子IL-1家族。IL-18的表达失衡会导致炎症及各种疾病的发生,并与多种生殖相关妇科疾病存在关联。本文综述了IL-18的激活机制及其在子宫内膜异位症(endometriosis,EM)、多囊卵巢综合征(polycystic ovarian syndrome,PCOS)、反复自然流产(recurrent spontaneous abortion,RSA)等妇科生殖疾病发生和发展中的作用,为研究相关疾病的发生机制和治疗策略提供思路。
1 IL-18激活机制IL-18以非活性前体的形式储存在细胞内间隙中。机体中含NLR家族Pyrin域蛋白3(NLR family pyrin domain containing 3,NLRP3)炎症小体在被病原体相关分子模式或危险相关分子模式激活后,可活化caspase 1,裂解加工、活化IL-18前体为成熟细胞因子IL-18。除了caspase 1外,糜蛋白酶、颗粒酶B、中性粒细胞来源的蛋白酶3也可以活化IL-18前体,形成成熟的IL-18[2](图 1)。
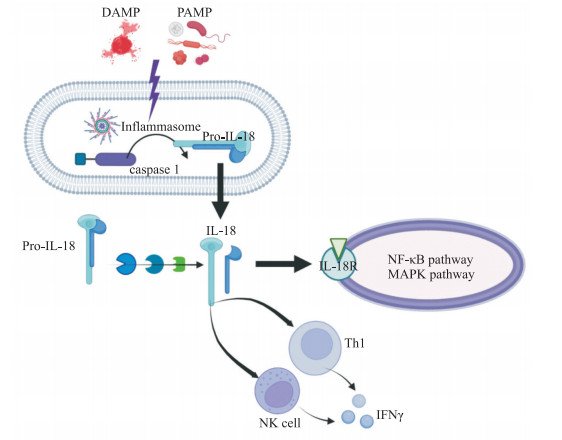
|
图 1 IL-18激活过程 Fig 1 Process of IL-18 activation IL: Interleukin; DAMP: Damage-associated molecular pattern; PAMP: Pathogen-associated molecular pattern; caspase: Cysteine aspartic acid specific protease; IL-18R: Interleukin-18 receptor; NF-κB: Nuclear factor κB; MAPK: Mitogen-activated protein kinase; Th: Helper T cell; NK: Natural killer; IFNγ: Interferon γ. |
IL-18存在于多种细胞中,包括角质形成细胞、树突状细胞、巨噬细胞、肝巨噬细胞、星形胶质细胞、小胶质细胞、肠上皮细胞和成骨细胞等[3]。IL-18通过与IL-18受体(IL-18 receptor,IL-18R)结合发挥作用。IL-18R由α链和β链异源二聚体组成,存在于T细胞、自然杀伤(natural killer,NK)细胞、B细胞、巨噬细胞、中性粒细胞、嗜碱性粒细胞、内皮细胞、平滑肌细胞、软骨细胞、角质形成细胞、成纤维细胞、黑素细胞和众多上皮细胞中。由于其在辅助性T细胞(helper T cell,Th)里只表达于Th1表面,所以可以将IL-18R作为区分Th1和Th2的表面分子标志物。IL-18与IL-18R结合形成二聚体后,细胞内Toll/IL-1受体域与髓样分化因子88(myeloid differentiation factor 88,MyD88)和IL-1受体相关激酶(IL-1 receptor-associated kinase,IRAK)结合,使IRAK磷酸化。在NF-κB信号通路中,磷酸化的IRAK与肿瘤坏死因子受体相关因子6结合,从而降解κB抑制剂(inhibitor of κB,IκB)。随后,NF-κB被释放、活化并诱导炎症细胞因子的产生[4]。IL-18也通过信号转导及转录活化因子3(signal transducer and activator of transcription 3,STAT3)和MAPK的磷酸化发挥作用。IL-18可促进T细胞增殖,诱导调节Th1的分化成熟、促进Th1为主的细胞免疫反应,并且增强T细胞、NK细胞中γ干扰素的表达[5](图 1)。
2 IL-18与EMEM是指有活性的子宫内膜细胞种植在子宫被覆黏膜及子宫肌层以外而形成的一种常见妇科疾病,临床上常表现为痛经、卵巢子宫内膜异位囊肿及不孕症。其发病机制仍未明确,但随着研究的不断深入,免疫相关学说成为研究的热点。Oku等[6]研究发现EM患者腹腔液中IL-18相较于非EM患者显著升高,同时异位组织中IL-18可诱导腹膜单核细胞中环加氧酶2的表达,促进EM的进展。然而,Zhang等[7]研究结果却显示EM患者的腹腔液IL-18浓度显著低于非EM患者,腹腔液和血清中IL-18的浓度与EM的分期无关。在轻度EM中,Glitz等[8]研究结果显示EM患者腹腔液及血清中IL-18水平与健康女性相比无明显差异,不支持IL-18与EM存在关联。在重度EM中,Noble等[9]发现EM患者的腹腔液中IL-12水平高于对照组,并且EM晚期阶段IL-12水平与初始阶段相比显著增加;而EM患者血清或腹腔液样本中IL-18水平与对照组相比差异均无统计学意义,说明严重EM与IL-18水平无关。
上述研究的结果互相矛盾,IL-18在EM中的作用仍然是一个值得商榷的问题,除了各研究所选的EM患者分期不同外,这些矛盾也可能来源于EM的复杂性及IL-18的免疫双向作用。EM有着类似肿瘤的恶行生物学行为,患者机体免疫功能紊乱使得子宫内膜细胞如同肿瘤细胞一样发生免疫逃逸,并在异位种植、生长。在近些年的研究中,学者们认为Th1向Th2漂移的机体免疫改变伴随着EM发生与进展的全过程。Podgaec等[10]发现相较正常女性,EM患者腹腔液中的γ干扰素和IL-10水平升高,IL-4/γ干扰素、IL-4/IL-2、IL-10/γ干扰素比值均明显升高,尽管γ干扰素水平升高,但仍朝着Th2免疫反应的方向发展。而在Tarokh等[11]的研究中,EM组患者血清中γ干扰素的浓度明显降低,Th1向Th2方向漂移。EM发展进程中Th1向Th2漂移的波动、体液免疫与细胞免疫参与程度的不同,可能是IL-18水平波动的重要原因(图 2)。
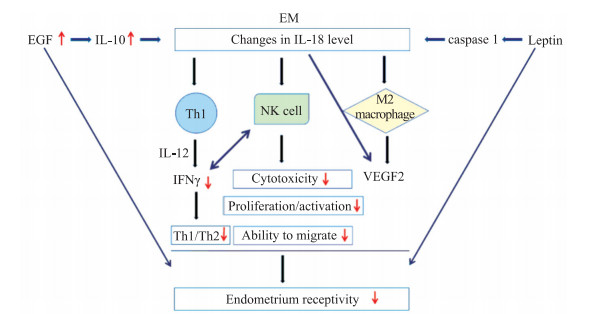
|
图 2 IL-18与EM的关系 Fig 2 Relationship between IL-18 and EM IL: Interleukin; EM: Endometriosis; EGF: Epidermal growth factor; caspase: Cysteine aspartic acid specific protease; Th: Helper T cell; IFNγ: Interferon γ; NK: Natural killer; VEGF: Vascular endothelial growth factor. |
NK细胞在EM病理生理过程中发挥重要作用。研究发现,EM患者腹腔液和外周血中细胞毒性NK细胞明显减少并伴随NK细胞整体活性的下降,同时成熟NK细胞数量明显减少、未成熟NK细胞比例有所增加,NK细胞在功能上也存在一定缺陷,这种NK细胞数量的减少及功能上的缺陷使异位子宫内膜细胞易于存活并进一步种植生长,导致EM的发生与进展[12]。IL-18作为NK细胞的激活剂,可促进NK细胞的活化、增殖,并诱导NK细胞产生γ干扰素,发挥细胞毒性作用;同时IL-18还可促进NK细胞的迁移,引起Th1型免疫反应[13-14]。因此,IL-18水平的降低可能通过影响NK细胞活性,促进EM的发生、发展(图 2)。
异位病灶的种植和增殖一定伴随着血管的新生,血管内皮生长因子(vascular endothelial growth factor,VEGF)在血管新生中起着重要的作用。Zhang等[15]通过病例对照研究发现,EM患者血清VEGF浓度显著高于对照组,且血清和子宫内膜组织中VEGF水平随着r-AFS分期的增高和痛经程度的加重而升高,提示VEGF在EM病情进展中起着重要作用。IL-18与血管生成及VEGF的相关性已被深入研究。IL-18微环境下,M2型巨噬细胞可通过释放促血管生成介质及与内皮细胞直接交互作用,诱导血管的过度生成[16-17]。EM病灶的形成伴随着VEGF水平的增加,IL-18水平的波动与VEGF水平升高存在一定的相关性(图 2)。
EM患者子宫内膜容受性存在缺陷。许多证据表明,EM患者生育力降低,其中子宫内膜容受性下降是引起EM患者生育力下降的重要原因[18]。表皮细胞生长因子(epidermal growth factor,EGF)在子宫内膜容受性的建立及胚胎植入方面起着重要的作用。Wang等[19]通过临床研究发现,子宫内膜中肝素结合性EGF表达水平与雌二醇、孕酮、子宫内膜厚度呈正相关,肝素结合性EGF可能通过与雌二醇、孕酮的协同作用提高子宫内膜对胚胎的容受性,从而影响胚胎着床率。研究表明,轻度EM性不孕症患者腹腔液中EGF水平显著升高,但重度EM性不孕症患者的EGF水平却无明显变化[20]。EGF可通过提高IL-10水平来抑制IL-18的表达[21]。瘦素可调节子宫内膜容受性相关分子,研究表明,EM患者血清瘦素水平明显高于健康女性,且瘦素水平可评估患者EM严重程度[22]。瘦素可通过调节炎症小体caspase 1的功能进一步调控IL-18水平[23]。EGF与瘦素均可调控IL-18的产生,而IL-18作为关键因子,本身也可调控内膜容受性(图 2)。既往研究证实,干扰素诱导因子如IL-12/IL-15/IL-18参与子宫NK细胞的激活和血管生成过程,其分泌不足或过度表达均可导致着床过程的失败;IL-18介导的血管重建缺失可导致内膜容受性下降,并参与内膜NK细胞的局部募集与活化,调节内膜容受性[24-25]。
3 IL-18与PCOSPCOS是育龄期妇女常见的内分泌代谢疾病,发病率约为6%~10%,常伴有肥胖、胰岛素抵抗和高雄激素血症。PCOS患者表现出低度慢性炎症状态,因此避免异常的免疫激活和减少炎症相关暴露是PCOS持续性治疗的重要方式[26]。作为关键炎症因子,IL-18在PCOS中的作用受到了相关学者的关注。研究发现PCOS患者血清、卵泡液及内膜中IL-18水平明显升高,且与BMI、胰岛素抵抗指数、雄激素水平呈正相关;无论PCOS患者是否存在肥胖和胰岛素抵抗,其IL-18水平均是升高的[27-28]。PCOS患者子宫内膜中IL-18蛋白和mRNA表达量均高于正常女性,且超重的PCOS患者子宫内膜IL-18表达水平更高,造成内膜的慢性低度炎症状态,影响胚胎的着床,使PCOS患者胚胎种植率低且易于流产[29]。PCOS中IL-18的高表达可能是NLRP3炎症小体激活导致的。炎症小体能够调节caspase 1的活化进而促进IL-1β前体和IL-18前体的成熟和分泌,而PCOS患者的炎症小体相关基因显著高表达,同时IL-18表达水平与炎症小体基因表达水平呈正相关[30]。肥胖、胰岛素抵抗是PCOS重要的临床改变,Rheinheimer等[31]对探讨NLRP3与肥胖和胰岛素抵抗关系的19项研究结果进行系统分析,结果显示NLRP3与肥胖和胰岛素抵抗存在密切关联,进一步证实了NLRP3与PCOS之间的相关性。
肥胖和胰岛素抵抗是PCOS的重要临床特征。目前有研究认为,导致PCOS患者慢性炎症状态的是肥胖而非PCOS本身[32]。研究发现,无论BMI是否增高,50%~60%的PCOS患者存在腹型肥胖,即伴有腹部脂肪积聚现象。脂肪组织是代谢活跃的内分泌器官,可分泌多种激素和细胞因子。脂肪组织分泌产物可分为促炎及抗炎物质,肥胖患者存在不同程度的脂肪因子分泌异常和脂肪细胞肥大,脂肪因子表达发生改变,促炎因子如单核细胞趋化因子1、TNF-α、IL-6等上调并占主导地位,进而促发炎症反应,降低患者胰岛素敏感性,间接参与胰岛素抵抗的发生、发展[33]。在肥胖个体中,IL-18的表达量也会有所增高,导致胰岛素抵抗、糖耐量受损和2型糖尿病的发生。IL-18作为一种前炎症细胞因子,可诱导TNF-α的产生,进一步诱导IL-6的合成,造成PCOS患者慢性炎症状态并加重患者的胰岛素抵抗[34](图 3)。

|
图 3 IL-18与PCOS的关系 Fig 3 Relationship between IL-18 and PCOS IL: Interleukin; PCOS: Polycystic ovarian syndrome; IL-18R: Interleukin 18 receptor; NLRP3: NLR family pyrin domain containing 3; TNF: Tumor necrosis factor. |
PCOS以高雄激素血症为特征,卵巢的病理改变包括卵泡膜细胞的过度增殖、小卵泡的过度募集及不排卵。卵泡膜细胞控制卵泡的发育及闭锁,调节卵巢类固醇激素的合成,是PCOS患者雄激素过多合成和分泌的主要来源,卵泡膜细胞功能的失调将导致病理状态的发生。研究表明卵巢卵泡膜细胞表面存在IL-18R,说明IL-18可直接作用于卵泡膜细胞,并对卵泡膜细胞的增殖和类固醇生成造成影响[35]。IL-18参与卵泡的发育、闭锁、排卵和类固醇生成,并与卵泡的过度发育有关[36-38]。IL-18水平的异常可能会影响蛋白水解酶(如胶原酶和弹性蛋白酶)的激活,这些酶可以消化细胞外基质蛋白,使卵泡破裂从而排卵。而PCOS患者卵泡液中IL-18水平升高导致的轻度慢性炎症或许是导致PCOS无排卵的原因之一。Zhang等[39]发现,随着卵泡液中IL-18水平的升高,PCOS患者可获得卵母细胞的机会显著增加,但受精的卵母细胞发育成优质胚胎的机会却减少。这可能是IL-18对排卵、卵母细胞质量和着床有负面影响的又一证据(图 3)。
4 IL-18与RSARSA是指经历2次或2次以上妊娠丢失,约有5%的夫妻受此病影响,且很大一部分原因未知[40]。RSA病因复杂,涉及染色体异常、母体生殖道异常、母体内分泌异常、免疫功能异常、生殖道感染等多个方面[41]。IL-18在RSA中起着重要作用。Wilson等[42]对205例孕妇血清中IL-18水平进行测定,结果显示流产的孕妇血清中IL‐18水平升高,并可影响妊娠结局。Comba等[43]发现RSA患者血液和组织中IL-12、IL-18和γ干扰素的水平显著升高,而白血病抑制因子和巨噬细胞游走抑制因子的水平显著降低,说明着床过程中的炎症可能导致流产。Al-Khateeb等[44]研究结果显示,IL-18基因rs360717和rs1946519基因型分布在RSA患者和对照组之间存在显著差异;RSA患者血清IL-18水平低于对照组,并且在rs360717的G/G和G/A基因型及rs1946519的C/C和C/A基因型患者中表现得更为明显。
免疫失衡与RSA关系密切,免疫治疗在RSA的治疗中已经广泛应用[45]。NK细胞占子宫内膜淋巴细胞的70%~90%,根据膜表面标志物可分为CD56+CD16+亚群和CD56+CD16-亚群,前者对胚胎起免疫杀伤和排斥作用,后者对胚胎起免疫防护和营养作用。子宫内膜NK细胞大部分为CD56+CD16-亚群,RSA患者蜕膜组织NK细胞含量与正常妊娠女性蜕膜并无差异,但CD56+CD16+ NK细胞比例明显上升、CD56+CD16- NK细胞比例明显下降,NK细胞毒性明显增强。研究显示,RSA患者分泌期子宫内膜间质NK细胞的比例显著高于正常生育女性,NK细胞数量的改变或功能失调可能打破母胎界面细胞因子的平衡,激活免疫细胞杀伤胚胎,过多的NK细胞也可能促进异常胚胎的种植而导致流产[46]。IL-18作为NK细胞的激活剂,可促进NK细胞的扩增,同时还可增加NK细胞抗原提呈细胞样表型,提高NK细胞的杀伤作用[47]。IL-18也可促进蜕膜组织中NK细胞的增殖,以及CD56+CD16- NK细胞向CD56+CD16+ NK细胞的转化,从而导致流产[48](图 4)。

|
图 4 IL-18与RSA的关系 Fig 4 Relationship between IL-18 and RSA IL: Interleukin; RSA: Recurrent spontaneous abortion; Th: Helper T cell; NK: Natural killer. |
T细胞在子宫内膜和蜕膜淋巴细胞中含量仅少于NK细胞,研究表明,Th1/Th2比例的失衡会影响母胎免疫耐受,是导致RSA的原因之一[49]。早期适量的Th1因子有利于滋养细胞形成,并在着床期促进血管生成。但Th1类细胞因子是促炎细胞因子,其过度及长时间表达会对胚胎的存活产生不利影响。一方面,Th1通过激活细胞毒性T细胞、NK细胞和巨噬细胞激活细胞免疫,导致滋养层细胞凋亡与损伤;另一方面,Th1还通过激活母胎界面的血管内皮细胞促凝剂导致母体高凝状态,诱导胎盘血栓形成。有研究表明,给予妊娠小鼠Th1细胞因子(如TNF-α和γ干扰素)可导致超过80%的流产率,其机制可能是激活的纤维蛋白原样蛋白2导致胎盘滋养细胞纤维素增多,诱发自然流产[50]。RSA患者中Th1/Th2比例失衡,Th1细胞分泌的细胞因子占主导[51]。IL-18在Th1反应中发挥重要作用,诱导T细胞和NK细胞产生γ干扰素。缺乏IL-18的小鼠在存在IL-12的情况下,γ干扰素的产生减少[52]。RSA患者中IL-18水平的提高可能导致Th1细胞因子比例的上升,引起Th1/Th2比例失衡,从而造成患者子宫免疫微环境紊乱,进而导致流产(图 4)。
5 结语IL-18与多种生殖相关妇科疾病的发生、发展存在关联。EM患者IL-18的表达水平在不同研究中存在差异,可能是源于IL-18对NK细胞、Th1/Th2漂移、VEGF生成在疾病不同阶段的影响不同,目前没有定论,仍需要从EM分期角度进行分阶段研究,以明确IL-18在EM不同疾病进展阶段的具体作用,为各阶段EM的治疗提供依据。PCOS患者血清、卵泡液及内膜中IL-18水平均升高,并与患者BMI、胰岛素抵抗指数和雄激素水平呈正相关;IL-18参与卵泡的发育、闭锁、排卵和类固醇生成,并通过对卵泡的作用来影响PCOS患者的生殖能力。RSA患者IL-18水平显著升高,IL-18与流产患者的免疫失衡状态密切相关,可能通过调控NK细胞和Th1参与RSA的发病机制。综上所述,IL-18参与EM、PCOS、RSA等女性生殖相关疾病的发病机制,并通过影响内膜容受性、卵泡发育、生殖免疫等影响女性生殖能力,调控IL-18的表达和作用可能有助于治疗相关妇科生殖疾病、提高患者生育能力,这为未来研究提供了思路。
| [1] |
WAWROCKI S, DRUSZCZYNSKA M, KOWALEWICZ-KULBAT M, RUDNICKA W. Interleukin 18(IL-18) as a target for immune intervention[J]. Acta Biochim Pol, 2016, 63: 59-63. |
| [2] |
OMOTO Y, TOKIME K, YAMANAKA K, HABE K, MORIOKA T, KUROKAWA I, et al. Human mast cell chymase cleaves pro-IL-18 and generates a novel and biologically active IL-18 fragment[J]. J Immunol, 2006, 177: 8315-8319. DOI:10.4049/jimmunol.177.12.8315 |
| [3] |
BIET F, LOCHT C, KREMER L. Immunoregulatory functions of interleukin 18 and its role in defense against bacterial pathogens[J]. J Mol Med (Berl), 2002, 80: 147-162. DOI:10.1007/s00109-001-0307-1 |
| [4] |
KAPLANSKI G. Interleukin-18:biological properties and role in disease pathogenesis[J]. Immunol Rev, 2018, 281: 138-153. DOI:10.1111/imr.12616 |
| [5] |
YASUDA K, NAKANISHI K, TSUTSUI H. Interleukin-18 in health and disease[J/OL]. Int J Mol Sci, 2019, 20: 649. DOI: 10.3390/ijms20030649.
|
| [6] |
OKU H, TSUJI Y, KASHIWAMURA S I, ADACHI S, KUBOTA A, OKAMURA H, et al. Role of IL-18 in pathogenesis of endometriosis[J]. Hum Reprod, 2004, 19: 709-714. DOI:10.1093/humrep/deh108 |
| [7] |
ZHANG X M, LIN J, QIAN Y L, DENG L. Decreased levels of interleukin-18 in peritoneal fluid but not in serum of patients with endometriosis[J]. Fertil Steril, 2004, 81: 1229-1234. DOI:10.1016/j.fertnstert.2003.09.074 |
| [8] |
GLITZ C, SOUZA C A, RODINI G P, GENRO V, BILIBIO J P, SENGER M, et al. Peritoneal and serum interleukin-18 levels are not increased in women with minimum or mild endometriosis[J]. Braz J Med Biol Res, 2009, 42: 1039-1043. DOI:10.1590/S0100-879X2009001100007 |
| [9] |
NOBLE A, MEHTA H, LOVELL A, PAPAIOANNOU E, FAIRBANKS L. IL-12 and IL-4 activate a CD39-dependent intrinsic peripheral tolerance mechanism in CD8+ T cells[J]. Eur J Immunol, 2016, 46: 1438-1448. DOI:10.1002/eji.201545939 |
| [10] |
PODGAEC S, ABRAO M S, DIAS J A Jr, RIZZO L V, DE OLIVEIRA R M, BARACAT E C. Endometriosis: an inflammatory disease with a Th2 immune response component[J]. Hum Reprod, 2007, 22: 1373-1379. DOI:10.1093/humrep/del516 |
| [11] |
TAROKH M, GHAFFARI NOVIN M, POORDAST T, TAVANA Z, NAZARIAN H, NOROUZIAN M, et al. Serum and peritoneal fluid cytokine profiles in infertile women with endometriosis[J]. Iran J Immunol, 2019, 16: 151-162. |
| [12] |
JEUNG I, CHEON K, KIM M R. Decreased cytotoxicity of peripheral and peritoneal natural killer cell in endometriosis[J/OL]. Biomed Res Int, 2016, 2016: 2916070. DOI: 10.1155/2016/2916070.
|
| [13] |
BRADY J, CAROTTA S, THONG R P L, CHAN C J, HAYAKAWA Y, SMYTH M J, et al. The interactions of multiple cytokines control NK cell maturation[J]. J Immunol, 2010, 185: 6679-6688. DOI:10.4049/jimmunol.0903354 |
| [14] |
WALZER T, DALOD M, ROBBINS S H, ZITVOGEL L, VIVIER E. Natural-killer cells and dendritic cells: "l'union fait la force"[J]. Blood, 2005, 106: 2252-2258. |
| [15] |
ZHANG F, LIU X L, WANG W, DONG H L, XIA Y F, RUAN L P, et al. Expression of MMIF, HIF-1α and VEGF in serum and endometrial tissues of patients with endometriosis[J]. Curr Med Sci, 2018, 38: 499-504. DOI:10.1007/s11596-018-1906-1 |
| [16] |
KOBORI T, HAMASAKI S, KITAURA A, YAMAZAKI Y, NISHINAKA T, NIWA A, et al. Interleukin-18 amplifies macrophage polarization and morphological alteration, leading to excessive angiogenesis[J/OL]. Front Immunol, 2018, 9: 334. DOI: 10.3389/fimmu.2018.00334.
|
| [17] |
AMIN M A, RABQUER B J, MANSFIELD P J, RUTH J H, MAROTTE H, HAAS C S, et al. Interleukin 18 induces angiogenesis in vitro and in vivo via Src and Jnk kinases[J]. Ann Rheum Dis, 2010, 69: 2204-2212. DOI:10.1136/ard.2009.127241 |
| [18] |
MIRAVET-VALENCIANO J, RUIZ-ALONSO M, GÓMEZ E, GARCIA-VELASCO J A. Endometrial receptivity in eutopic endometrium in patients with endometriosis: it is not affected, and let me show you why[J]. Fertil Steril, 2017, 108: 28-31. DOI:10.1016/j.fertnstert.2017.06.002 |
| [19] |
WANG H, SHI G W, LI M, FAN H, MA H, SHENG L. Correlation of IL-1 and HB-EGF with endometrial receptivity[J]. Exp Ther Med, 2018, 16: 5130-5136. |
| [20] |
SOTNIKOVA N Y, ANTSIFEROVA Y S, SHOKHINA M N. Local epidermal growth factor production in women with endometriosis[J]. Russ J Immunol, 2001, 6: 55-60. |
| [21] |
HALPERN M D, DOMINGUEZ J A, DVORAKOVA K, HOLUBEC H, WILLIAMS C S, MEZA Y G, et al. Ileal cytokine dysregulation in experimental necrotizing enterocolitis is reduced by epidermal growth factor[J]. J Pediatr Gastroenterol Nutr, 2003, 36: 126-133. DOI:10.1097/00005176-200301000-00024 |
| [22] |
HUSSEIN S S, FARHAN F S, IBRAHIM ALI A. Serum leptin as a marker for severity of endometriosis[J/OL]. Obstet Gynecol Int, 2020, 2020: 6290693. DOI: 10.1155/2020/6290693.
|
| [23] |
JITPRASERTWONG P, JAEDICKE K M, NILE C J, PRESHAW P M, TAYLOR J J. Leptin enhances the secretion of interleukin (IL)-18, but not IL-1β, from human monocytes via activation of caspase-1[J]. Cytokine, 2014, 65: 222-230. DOI:10.1016/j.cyto.2013.10.008 |
| [24] |
CROY B A, HE H, ESADEG S, WEI Q X, MCCARTNEY D, ZHANG J H, et al. Uterine natural killer cells: insights into their cellular and molecular biology from mouse modelling[J]. Reproduction, 2003, 126: 149-160. DOI:10.1530/rep.0.1260149 |
| [25] |
LÉDÉE-BATAILLE N, BONNET-CHEA K, HOSNY G, DUBANCHET S, FRYDMAN R, CHAOUAT G. Role of the endometrial tripod interleukin-18, -15, and -12 in inadequate uterine receptivity in patients with a history of repeated in vitro fertilization-embryo transfer failure[J]. Fertil Steril, 2005, 83: 598-605. DOI:10.1016/j.fertnstert.2004.11.021 |
| [26] |
PATEL S. Polycystic ovary syndrome (PCOS), an inflammatory, systemic, lifestyle endocrinopathy[J]. J Steroid Biochem Mol Biol, 2018, 182: 27-36. DOI:10.1016/j.jsbmb.2018.04.008 |
| [27] |
YANG Y, QIAO J, LI R, LI M Z. Is interleukin-18 associated with polycystic ovary syndrome?[J/OL]. Reprod Biol Endocrinol, 2011, 9: 7. DOI: 10.1186/1477-7827-9-7.
|
| [28] |
DAWOOD A, ALKAFRAWY N, SALEH S, NORELDIN R, ZEWAIN S. The relationship between IL-18 and atherosclerotic cardiovascular risk in Egyptian lean women with polycystic ovary syndrome[J]. Gynecol Endocrinol, 2018, 34: 294-297. DOI:10.1080/09513590.2017.1395835 |
| [29] |
LONG X Y, LI R, YANG Y, QIAO J. Overexpression of IL-18 in the proliferative phase endometrium of patients with polycystic ovary syndrome[J]. Reprod Sci, 2017, 24: 252-257. DOI:10.1177/1933719116653681 |
| [30] |
ROSTAMTABAR M, ESMAEILZADEH S, KARKHAH A, AMIRI M, RAHMANI A, BAKOUEI F, et al. Elevated expression of IL-18 but not IL-1β gene is associated with NALP3 and AIM2 inflammasome in polycystic ovary syndrome[J/OL]. Gene, 2020, 731: 144352. DOI: 10.1016/j.gene.2020.144352.
|
| [31] |
RHEINHEIMER J, DE SOUZA B M, CARDOSO N S, BAUER A C, CRISPIM D. Current role of the NLRP3 inflammasome on obesity and insulin resistance: a systematic review[J]. Metabolism, 2017, 74: 1-9. DOI:10.1016/j.metabol.2017.06.002 |
| [32] |
MOTTA A B. The role of obesity in the development of polycystic ovary syndrome[J]. Curr Pharm Des, 2012, 18: 2482-2491. DOI:10.2174/13816128112092482 |
| [33] |
TZANAVARI T, GIANNOGONAS P, KARALIS K P. TNF-α and obesity[J]. Curr Dir Autoimmun, 2010, 11: 145-156. DOI:10.1159/000289203 |
| [34] |
OSBORN O, GRAM H, ZORRILLA E P, CONTI B, BARTFAI T. Insights into the roles of the inflammatory mediators IL-1, IL-18 and PGE2 in obesity and insulin resistance[J]. Swiss Med Wkly, 2008, 138: 665-673. |
| [35] |
ZHANG H Y, ZHU F F, ZHU Y J, HU Y J, CHEN X. Effects of IL-18 on the proliferation and steroidogenesis of bovine theca cells: possible roles in the pathogenesis of polycystic ovary syndrome[J]. J Cell Mol Med, 2021, 25: 1128-1139. DOI:10.1111/jcmm.16179 |
| [36] |
SALMASSI A, FATTAHI A, NOURI M, HEDDERICH J SCHMUTZLER A G. Expression of mRNA and protein of IL-18 and its receptor in human follicular granulosa cells[J]. J Endocrinol Invest, 2017, 40: 447-454. DOI:10.1007/s40618-016-0590-x |
| [37] |
VIDAL-VANACLOCHA F, MENDOZA L, TELLERIA N, SALADO C, VALCÁRCEL M, GALLOT N, et al. Clinical and experimental approaches to the pathophysiology of interleukin-18 in cancer progression[J]. Cancer Metastasis Rev, 2006, 25: 417-434. DOI:10.1007/s10555-006-9013-3 |
| [38] |
SARAPIK A, VELTHUT A, HALLER-KIKKATALO K, FAURE G C, BÉNÉ M C, DE CARVALHO BITTENCOURT M, et al. Follicular proinflammatory cytokines and chemokines as markers of IVF success[J/OL]. Clin Dev Immunol, 2012, 2012: 606459. DOI: 10.1155/2012/606459.
|
| [39] |
ZHANG H Y, WANG X M, XU J, ZHU Y J, CHEN X, HU Y J. IL-18 and IL-18 binding protein concentration in ovarian follicular fluid of women with unexplained infertility to PCOS during in vitro fertilization[J/OL]. J Reprod Immunol, 2020, 138: 103083. DOI: 10.1016/j.jri.2020.103083.
|
| [40] |
LI Y H, MARREN A. Recurrent pregnancy loss: a summary of international evidence-based guidelines and practice[J]. Aust J Gen Pract, 2018, 47: 432-436. DOI:10.31128/AJGP-01-18-4459 |
| [41] |
DIMITRIADIS E, MENKHORST E, SAITO S, KUTTEH W H, BROSENS J J. Recurrent pregnancy loss[J/OL]. Nat Rev Dis Primers, 2020, 6: 98. DOI: 10.1038/s41572-020-00228-z.
|
| [42] |
WILSON R, MOOR J, JENKINS C, MILLER H, WALKER J J, MCLEAN M A, et al. Abnormal first trimester serum interleukin 18 levels are associated with a poor outcome in women with a history of recurrent miscarriage[J]. Am J Reprod Immunol, 2004, 51: 156-159. DOI:10.1046/j.8755-8920.2003.00126.x |
| [43] |
COMBA C, BASTU E, DURAL O, YASA C, KESKIN G, OZSURMELI M, et al. Role of inflammatory mediators in patients with recurrent pregnancy loss[J/OL]. Fertil Steril, 2015, 104: 1467-1474. e1. DOI: 10.1016/j.fertnstert.2015.08.011.
|
| [44] |
AL-KHATEEB G M, SATER M S, FINAN R R, MUSTAFA F E, AL-BUSAIDI A S, AL-SULAITI M A, et al. Analysis of interleukin-18 promoter polymorphisms and changes in interleukin-18 serum levels underscores the involvement of interleukin-18 in recurrent spontaneous miscarriage[J]. Fertil Steril, 2011, 96: 921-926. DOI:10.1016/j.fertnstert.2011.06.079 |
| [45] |
CARP H. Immunotherapy for recurrent pregnancy loss[J]. Best Pract Res Clin Obstet Gynaecol, 2019, 60: 77-86. DOI:10.1016/j.bpobgyn.2019.07.005 |
| [46] |
TANG A W, ALFIREVIC Z, QUENBY S. Natural killer cells and pregnancy outcomes in women with recurrent miscarriage and infertility: a systematic review[J]. Hum Reprod, 2011, 26: 1971-1980. DOI:10.1093/humrep/der164 |
| [47] |
SENJU H, KUMAGAI A, NAKAMURA Y, YAMAGUCHI H, NAKATOMI K, FUKAMI S, et al. Effect of IL-18 on the expansion and phenotype of human natural killer cells: application to cancer immunotherapy[J]. Int J Biol Sci, 2018, 14: 331-340. DOI:10.7150/ijbs.22809 |
| [48] |
WANG F, ZHU H, LI B, LIU M X, LIU D, DENG M L, et al. Effects of human chorionic gonadotropin, estradiol, and progesterone on interleukin-18 expression in human decidual tissues[J]. Gynecol Endocrinol, 2017, 33: 265-269. DOI:10.1080/09513590.2016.1212829 |
| [49] |
DIEJOMAOH M F E. Recurrent spontaneous miscarriage is still a challenging diagnostic and therapeutic quagmire[J]. Med Princ Pract, 2015, 24(Suppl 1): 38-55. |
| [50] |
CLARK D A, CHAOUAT G, ARCK P C, MITTRUECKER H W, LEVY G A. Cytokine-dependent abortion in CBA×DBA/2 mice is mediated by the procoagulant fgl2 prothrombinase[correction of prothombinase][J]. J Immunol, 1998, 160: 545-549. |
| [51] |
YUAN J, LI J, HUANG S Y, SUN X. Characterization of the subsets of human NKT-like cells and the expression of Th1/Th2 cytokines in patients with unexplained recurrent spontaneous abortion[J]. J Reprod Immunol, 2015, 110: 81-88. DOI:10.1016/j.jri.2015.05.001 |
| [52] |
DINARELLO C A. IL-18:a TH1-inducing, proinflammatory cytokine and new member of the IL-1 family[J]. J Allergy Clin Immunol, 1999, 103(1 Pt 1): 11-24. |
 2022, Vol. 43
2022, Vol. 43


