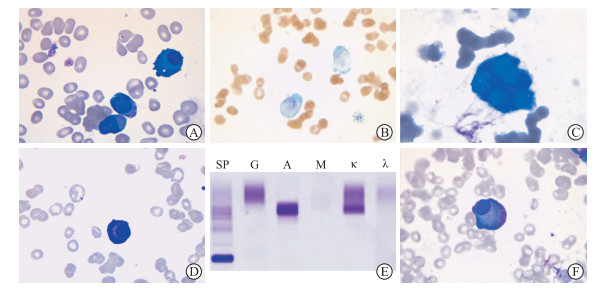
患者男,53岁,因“反复胸闷1个月余”于2020年3月5日就诊于我院。患者入院前1个多月无明显诱因出现胸闷伴心悸,多于劳累后出现,每次持续3~5 min,休息后可缓解,无其他不适。入院后体格检查:生命体征平稳,皮肤黏膜、口唇苍白,皮下无出血点;全身浅表淋巴结未及肿大,胸骨无压痛,双肺呼吸音粗,左肺可闻及哮鸣音,右肺未闻及干、湿性啰音,肝脾肋下未触及。血常规检查示白细胞计数0.9×109/L,中性粒细胞计数0.17×109/L,淋巴细胞计数0.54×109/L,红细胞计数1.31×1012/L,血红蛋白50 g/L,血小板计数79×109/L;肝功能检查示总蛋白58.6 g/L,白蛋白36.3 g/L,球蛋白22.3 g/L,白蛋白/球蛋白比值1.6;血清总钙2.15 mmol/L;免疫五项检查示IgA 5.40 g/L;红细胞沉降率113.0 mm/1 h;CRP 125.1 mg/L;铁蛋白800.10 ng/mL;β2-微球蛋白1.76 μg/mL;血细胞形态检查示外周血原始血细胞占比7%;肾功能、心肌酶、电解质、凝血功能、风湿全套、肿瘤三项、甲状腺功能、糖化血红蛋白、降钙素原未见明显异常;骨髓细胞形态学检查示原始细胞约占48%,该类细胞胞体大小不等,染色质疏松,核仁较明显,胞质量偏少、染蓝色,部分细胞胞质可见伪足(图 1A),髓过氧化物酶染色呈弱阳性(图 1B),可见多圆核巨核细胞(图 1C)。免疫组织化学染色示CD34(小簇+)、CD117(簇状+)、CD61(-)、CD71(-)、CD3(-)、CD20(-)、CD138(-)、Ki-67(+,<5%)。流式细胞术检测示CD117阳性细胞占有核细胞总数的43.3%,其免疫表型为CD34部分阳性,CD117(+)、CD33(+)、CD13(+)、人类白细胞抗原DR(+)、CD14(-)、CD64(+)、CD36(-)、CD56(-)、CD4(部分+)、CD19(-)、CD7(-)、CD61(-)、CD71(-),提示急性髓系白血病(acute myelocytic leukemia,AML)(非M3)免疫表型;另可见约1.5%的单克隆浆细胞,其免疫表型为CD38(++)、CD138(+)、CD19(-)、CD56(部分+)、CD117(+)、CD200(+),胞内Ig轻链κ限制性表达。复查骨髓细胞形态可见浆细胞比例约为2%,可见幼稚浆细胞及其核仁(图 1D),异常浆细胞占比0.5%~1%。AML基因突变及融合基因检测示tet癌基因家族成员2(tet oncogene family member 2,TET2)、FMS样酪氨酸激酶3(FMS-like tyrosine kinase 3,FLT3)、肾母细胞瘤基因1(Wilm’s tumor gene 1,WT1)、Runt相关转录因子1(Runt-related transcription factor 1,RUNX1)突变;染色体核型正常;血清蛋白电泳未发现M蛋白;血清免疫固定电泳示IgA-κ泳道发现异常单克隆条带,类型为IgA-κ型(图 1E);血清蛋白定量示总蛋白57.1 g/L,白蛋白36.5 g/L,IgA 4.78 g/L,IgG 6.38 g/L;异常免疫球蛋白血症血清轻链检查示血清κ轻链0.25 g/L,血清λ轻链0.73 g/L,血清κ轻链/λ轻链比值为3.438 4;尿蛋白电泳未发现M蛋白;尿免疫固定电泳未发现异常单克隆条带;尿游离κ轻链89.20 mg/L,游离λ轻链17.3 mg/L,血清κ轻链/游离λ轻链比值5.156 1。腹部+腰椎+骨盆CT平扫示胃腔充盈欠佳,胃窦部胃壁增厚;右下腹回盲部局部肠管壁均匀增厚;右肾小结节状稍高密度灶。诊断为AML(TET2、FLT3突变阳性,高危);单克隆免疫球蛋白血症IgA-κ型。2020年3月19日予D-CAG方案(地西他滨25 mg每天1次,第1~5天;阿柔比星20 mg第6天、第8天;阿糖胞苷15 mg每12 h 1次,第6~19天;粒细胞刺激因子300 μg每天1次)化疗。化疗结束后第1天复查血常规示白细胞计数1.0×109/L,中性粒细胞计数0.11×109/L,红细胞计数2.11×1012/L,血红蛋白67 g/L,血小板计数40×109/L。骨髓细胞形态学检查示原始细胞占18.5%;浆细胞占7.5%,其中异常浆细胞占2.5%(图 1F)。多部位骨髓穿刺活检术后免疫组织化学染色示CD34(散在+)、CD117(散在+)、髓过氧化物酶(散在+)、CD33(散在+)、CD3(散在少+)、配对盒基因5(偶见+)、CD15(散在少+)、CD68R(散在+),骨髓增生减低,原始细胞散在分布。提示形态学部分缓解。患者及家属要求出院,拒绝血免疫球蛋白和轻链定量、血和尿免疫固定电泳等检查。于2020年4月16日出院,未进一步治疗。2020年4月27日于当地医院查血常规示白细胞计数3.41×109/L,红细胞计数2.90×1012/L,血红蛋白89 g/L,血小板计数262×109/L,中性粒细胞计数2.12×109/L。2020年5月28日于当地医院查血常规示白细胞计数2.67×109/L,中性粒细胞计数1.34×109/L,红细胞计数3.62×1012/L,血红蛋白122 g/L,血小板计数199×109/L。2020年7月2日电话随访患者一般情况尚可,无明显发热、畏寒、寒战、咳嗽、咳痰、胸闷、气促,无鼻出血、牙龈出血,皮肤黏膜无出血点。2020年9月17日患者于家中死亡。
|
图 1 骨髓细胞形态学检查和免疫固定电泳结果 A:治疗前骨髓细胞形态学检查示原始细胞占48%,该类细胞胞体大小不等,染色质疏松,核仁较为明显,胞质偏少、染蓝色,部分可见伪足,同视野内可见浆细胞(瑞吉染色,1 000×);B:治疗前骨髓细胞形态学检查示髓过氧化物酶染色呈弱阳性(1 000×);C:治疗前骨髓细胞形态学检查可见多圆核巨核细胞(瑞吉染色,1 000×);D:治疗前骨髓细胞形态学检查示幼稚浆细胞,可见核仁(瑞吉染色,1 000×);E:治疗前血清免疫固定电泳在免疫球蛋白A-κ泳道发现异常单克隆条带,单克隆免疫球蛋白类型为免疫球蛋白A-κ;F:治疗后骨髓细胞形态学检查示异常浆细胞,占比约2.5%,可见火焰状浆细胞(瑞吉染色,1 000×). |
2 讨论
AML是一类起源于造血干细胞的恶性克隆性疾病[1],是成人白血病最常见的分类,约占80%[2]。目前AML的诊断依赖于细胞形态学、免疫学、细胞遗传学和分子生物学分型,其中基因检测对于白血病诊断、预后判断、残留监测具有重要意义。AML基因检测常见的Ⅰ类突变有FLT3、Kirsten鼠肉瘤病毒癌基因(Kirsten rat sarcoma viral oncogene,KRAS)、神经母细胞瘤RAS病毒致癌基因(neuroblastoma RAS viral oncogene homolog,NRAS)、肿瘤蛋白p53(tumor protein p53,TP53)、原癌基因C-kit(proto-oncogene C-kit,C-kit)等,主要作用是异常激活信号转导通路和诱导细胞增殖失控[3]。FLT3突变为非M3型AML独立不良预后因素,尤其是有高突变型/野生型等位基因比(≥0.5)的患者[4-5]。TET2突变在AML患者中为Ⅲ类突变,突变率达23%[3],该基因是细胞发育和恶性肿瘤形成中DNA甲基化的关键调节剂[6],预后判断价值在不同人群中具有差异性[7]。AML发病机制目前多认为是“二次打击模式”,即多基因突变导致AML发生、发展,多基因突变发生率为30.23%,且至少包含Ⅰ、Ⅱ类突变[8]。本例患者为Ⅰ、Ⅲ类突变,FLT3和TET2突变可通过诱导细胞增殖失控、表观遗传调节异常促进AML的发生,且TET2突变还可调节浆细胞表观遗传,可能为异常浆细胞的出现奠定了分子生物学基础。
单克隆免疫球蛋白血症病因尚不清楚,可能与多种因素刺激导致单克隆B细胞-浆细胞过度增殖并分泌单克隆免疫球蛋白有关[9]。单克隆免疫球蛋白升高可见于多发性骨髓瘤、瓦尔登斯特伦巨球蛋白血症、免疫球蛋白轻链淀粉样变性、孤立性浆细胞瘤、髓外浆细胞瘤、POEMS综合征、浆细胞白血病、恶性淋巴增殖性疾病、B细胞淋巴瘤、慢性淋巴细胞白血病、重链病、意义未明的单克隆免疫球蛋白血症、继发性单克隆免疫球蛋白血症[10]。本例患者骨髓浆细胞比例<10%,达不到多发性骨髓瘤诊断标准,血清免疫固定电泳提示单克隆免疫球蛋白类型为IgA-κ型,排除瓦尔登斯特伦巨球蛋白血症、免疫球蛋白轻链淀粉样变性、重链病,结合该患者影像学、骨髓穿刺检查结果,无孤立性浆细胞瘤、髓外浆细胞瘤诊断依据。此外,患者无多发神经病、器官肿大、内分泌病变、皮肤变化,不支持POEMS综合征,外周浆细胞比值明显低于20%,排除浆细胞白血病。该患者外周血淋巴细胞<5×109/L,且无肝脾淋巴结肿大,骨髓涂片无淋巴细胞比例异常增多,流式细胞术提示为AML免疫表型,不支持恶性淋巴增殖性疾病、B细胞淋巴瘤、慢性淋巴细胞白血病。患者有贫血症状,意义未明的单克隆免疫球蛋白血症没有CRAB症状(高钙血症、肾功能不全、贫血、骨病变),但贫血为AML患者常见临床表现,暂不能完全排除意义未明单克隆丙种球蛋白血症(monoclonal gammopathy of undetermined significance,MGUS),因此该患者诊断为单克隆免疫球蛋白血症。
AML合并单克隆免疫球蛋白血症罕见,且多为病例报告[11]。1984年,Shoenfeld等[12]在2例AML患者中发现了单克隆IgG,并提出淋巴浆细胞系统可能参与了骨髓增生性疾病。Mailankody等[13]报道MGUS患者发生AML/骨髓增生异常综合征(myelodysplastic syndrome,MDS)的风险较普通人群高8.01倍,而这些MGUS患者免疫球蛋白类型为IgG、IgA。另一项旨在确定MGUS患者是否存在AML和MDS风险增加的研究显示605例MGUS患者发生AML/MDS的风险为正常人群的1.96倍,其中2例AML合并Ig类型分别为IgG与IgA,但MGUS群体发生AML的风险增加无统计学意义[14]。另有4篇病例报告报道了AML合并M蛋白,类型分别为IgA-κ型、IgG-κ型、IgA-λ型、λ轻链型[11, 15-17]。单克隆免疫球蛋白血症和AML都是克隆性疾病,起源于不同细胞的克隆,两者合并出现提示预后不良,其机制可能与MAPK信号通路介导有关[18-19],亦有免疫刺激学说提出危险因子可刺激白血病细胞同异常浆细胞相互促进增殖[20]。有趣的是,AML合并的M蛋白成分以IgG/IgA/轻链为主,均非IgM,没有相关研究论证其中的关联。
本例患者为FLT3与TET2突变的AML伴IgA-κ型单克隆免疫球蛋白血症,既往未见报道。该患者为中老年男性,起病时骨髓细胞形态学检查可见病态造血,提示AML继发于MDS的可能性大。结合流式细胞术、血清免疫固定电泳可见IgA-κ型M蛋白,治疗方向主要针对白血病并动态观察浆细胞克隆及M蛋白水平变化。美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南推荐IA方案(伊达比星+阿糖胞苷)、DA方案(柔红霉素+阿糖胞苷)或含中大剂量阿糖胞苷为常规诱导治疗方案,而继发于MDS的AML优先选择D-CAG方案。本例患者化疗后第1天复查骨髓细胞形态示原始细胞由初诊的48%下降至18.5%,提示形态学部分缓解,治疗反应与该患者预后不良判断相符,但治疗后浆细胞占比升高且出现异常浆细胞,考虑诱导化疗后白血病细胞克隆得到控制,而异常浆细胞增殖成为优势克隆,表现为形态学上异常浆细胞升高。
AML合并单克隆免疫球蛋白血症罕见,对于其治疗及疗效的报道极少。1例Bcl-6辅抑制因子(Bcl-6corepressor,BCOR)突变和脂肪肉瘤易位基因(translocation liposarcoma,TLS)-ETS相关基因(ETS-related gene,ERG)融合的急性髓细胞性白血病伴单克隆免疫球蛋白血症患者,接受1个周期的IA(依达比星10 mg第1~4天;阿糖胞苷0.075 g每12 h 1次,第1~7天)诱导化疗,化疗开始后第25天复查骨髓形态示白血病细胞由86%下降至3%,疗效评估为形态学完全缓解[8]。另一例74岁与MDS相关的AML患者合并IgG-κ型M蛋白,考虑患者年龄大及其耐受能力,并未给予AML标准治疗,以延长生存期、降低肿瘤负荷为目的,予以地西他滨(20 mg/m2第1~5天,4周为1个周期)治疗,在治疗第4个周期时,骨髓涂片、组织活检未发现浆细胞,且M蛋白转阴,提示完全缓解,且缓解状态持续到第12个治疗周期,此案例说明地西他滨可能对AML和MGUS均有效[12]。本例患者同样考虑继发于MDS的AML,存在预后不良基因突变与浆细胞异常克隆,其中TET2基因突变可调控髓系、浆细胞表观遗传,推荐选择包含去甲基化的地西他滨方案,但该患者危险分层为高危,是否能完全缓解需继续治疗后观察,完全缓解期间行异基因造血干细胞移植是唯一治愈的希望。回顾诊治过程,患者开始治疗时是否需要同时兼顾单克隆免疫球蛋白血症的干预,加用蛋白酶体抑制剂是否会有助于控制病情,还有待进一步探索。
| [1] |
SALEH K, KHALIFEH-SALEH N, KOURIE H R. Acute myeloid leukemia transformed to a targetable disease[J]. Future Oncol, 2020, 16: 961-972. DOI:10.2217/fon-2019-0670 |
| [2] |
YAMAMOTO J F, GOODMAN M T. Patterns of leukemia incidence in the United States by subtype and demographic characteristics, 1997-2002[J]. Cancer Causes Control, 2008, 19: 379-390. DOI:10.1007/s10552-007-9097-2 |
| [3] |
Cancer Genome Atlas Research Network; LEY T J, MILLER C, DING L, RAPHAEL B J, MUNGALL A J, ROBERTSON A, et al. Genomic and epigenomic landscapes of adult de novo acute myeloid leukemia[J]. N Engl J Med, 2013, 368: 2059-2074. DOI:10.1056/NEJMoa1301689 |
| [4] |
GALE R E, GREEN C, ALLEN C, MEAD A J, BURNETT A K, HILLS R K, et al. The impact of FLT3 internal tandem duplication mutant level, number, size, and interaction with NPM1 mutations in a large cohort of young adult patients with acute myeloid leukemia[J]. Blood, 2008, 111: 2776-2784. DOI:10.1182/blood-2007-08-109090 |
| [5] |
DÖHNER K, THIEDE C, JAHN N, PANINA E, GAMBIETZ A, LARSON R A, et al. Impact of NPM1/FLT3-ITD genotypes defined by the 2017 European LeukemiaNet in patients with acute myeloid leukemia[J]. Blood, 2020, 135: 371-380. DOI:10.1182/blood.2019002697 |
| [6] |
BOWMAN R L, LEVINE R L. TET2 in normal and malignant hematopoiesis[J/OL]. Cold Spring Harb Perspect Med, 2017, 7: a026518. DOI: 10.1101/cshperspect.a026518.
|
| [7] |
METZELER K H, MAHARRY K, RADMACHER M D, MRÓZEK K, MARGESON D, BECKER H, et al. TET2 mutations improve the new European LeukemiaNet risk classification of acute myeloid leukemia: a Cancer and Leukemia Group B study[J]. J Clin Oncol, 2011, 29: 1373-1381. DOI:10.1200/JCO.2010.32.7742 |
| [8] |
王芳, 张阳, 陈雪, 房建成, 王茫桔, 滕文, 等. 初诊急性髓系白血病患者十种常见突变基因的突变组分析[J]. 白血病·淋巴瘤, 2015, 24: 161-164. DOI:10.3760/cma.j.issn.1009-9921.2015.03.009 |
| [9] |
BIDA J P, KYLE R A, THERNEAU T M, MELTON L J 3rd, PLEVAK M F, LARSON D R, et al. Disease associations with monoclonal gammopathy of undetermined significance: a population-based study of 17, 398 patients[J]. Mayo Clin Proc, 2009, 84: 685-693. DOI:10.4065/84.8.685 |
| [10] |
李娟. 继发性单克隆免疫球蛋白血症的诊断与治疗[J]. 中国实用内科杂志, 2007, 27: 1497-1499. DOI:10.3969/j.issn.1005-2194.2007.19.002 |
| [11] |
JIN J, LUO S, YE X, HUANG J. BCOR mutation and TLS-ERG expression in acute myeloid leukemia with monoclonal immunoglobulinemia[J]. Onco Targets Ther, 2019, 12: 7123-7127. DOI:10.2147/OTT.S218805 |
| [12] |
SHOENFELD Y, BERLINER S, AYALONE A, SHAKLAI M, DJALDETTI M, PICK A I, et al. Monoclonal gammopathy in patients with chronic and acute myeloid leukemia[J]. Cancer, 1984, 54: 280-283. DOI:10.1002/1097-0142(19840715)54:2<280::AID-CNCR2820540216>3.0.CO;2-9 |
| [13] |
MAILANKODY S, PFEIFFER R M, KRISTINSSON S Y, KORDE N, BJORKHOLM M, GOLDIN L R, et al. Risk of acute myeloid leukemia and myelodysplastic syndromes after multiple myeloma and its precursor disease (MGUS)[J]. Blood, 2011, 118: 4086-4092. |
| [14] |
ROEKER L E, LARSON D R, KYLE R A, KUMAR S, DISPENZIERI A, RAJKUMAR S V. Risk of acute leukemia and myelodysplastic syndromes in patients with monoclonal gammopathy of undetermined significance (MGUS): a population-based study of 17 315 patients[J]. Leukemia, 2013, 27: 1391-1393. DOI:10.1038/leu.2013.34 |
| [15] |
李宝林, 李明, 王丽娜, 吕莹, 牟晓丽, 李卓, 等. 急性髓系白血病伴IgA-κ型M蛋白血症1例并文献复习[J]. 临床血液学杂志, 2016, 29: 74-75. |
| [16] |
NISCOLA P, NERI B, MORINO L, DE FABRITIIS P. Monoclonal gammopathy responsive to decitabine given for acute myeloid leukemia in a frail patient[J]. Acta Haematol, 2018, 139: 58-59. DOI:10.1159/000485960 |
| [17] |
吴佳颖, 邓理南, 董培源, 孙汉英, 孟凡凯. 急性髓系白血病合并单克隆免疫球蛋白血症1例报告并文献复习[J]. 中国实用内科杂志, 2019, 39: 306-307. |
| [18] |
DAVIES F E, DRING A M, LI C, RAWSTRON A C, SHAMMAS M A, O'CONNOR S M, et al. Insights into the multistep transformation of MGUS to myeloma using microarray expression analysis[J]. Blood, 2003, 102: 4504-4511. DOI:10.1182/blood-2003-01-0016 |
| [19] |
PLATANIAS L C. Map kinase signaling pathways and hematologic malignancies[J]. Blood, 2003, 101: 4667-4679. DOI:10.1182/blood-2002-12-3647 |
| [20] |
WU S P, COSTELLO R, HOFMANN J N, KORDE N, MAILANKODY S, PURDUE M, et al. MGUS prevalence in a cohort of AML patients[J]. Blood, 2013, 122: 294-295. |
 2022, Vol. 43
2022, Vol. 43


