2. 上海交通大学附属第一人民医院检验科, 上海 200080
2. Department of Laboratory Medicine, Shanghai General Hospital, Shanghai Jiao Tong University, Shanghai 200080, China
钙调磷酸酶抑制剂(calcineurin inhibitor,CNI)作为免疫抑制治疗的基石,广泛应用于多种器官移植术后的治疗。超过90%的肾移植患者术后接受含CNI的维持性免疫抑制治疗[1]。抗增殖类药物(霉酚酸制剂、咪唑立宾等)、CNI和糖皮质激素三联免疫抑制剂疗法已成为器官移植术后维持性治疗的主流,但CNI可引起肾小球入球动脉收缩、肾小球硬化和间质纤维化,进而导致移植肾急性、慢性损伤[2-3]和移植肾功能减退[4-5],亦可导致高血压、继发性糖尿病等不良事件[6-7]。减少或停用CNI虽然可以减轻或规避其不良反应,但会增加急性排斥反应的风险。
西罗莫司是一种大环内酯类药物,属于哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)抑制剂。在人体内西罗莫司与其受体FK506结合蛋白12(FK506-binding protein 12,FKBP12)形成复合物,抑制钙调神经磷酸酶活性,抑制T淋巴细胞和B淋巴细胞的增殖、分化及抗体形成,发挥免疫抑制功能[8-9]。西罗莫司联合或替代环孢素、糖皮质激素可以维持移植肾功能稳定[10-11]。用西罗莫司替代CNI可以缓解移植肾功能损害,但会伴有血脂代谢异常等不良反应[12-13]。既往有少数研究尝试在传统三联免疫抑制治疗的基础上增加西罗莫司形成四联疗法[14-15]。基于这些研究基础和临床观察结果,我们尝试通过降低CNI剂量减少患者的肾脏不良反应,同时追加小剂量西罗莫司维持整体免疫抑制强度,在传统三联免疫抑制治疗基础上构建四联免疫抑制剂治疗方案,并将该方案用于治疗轻、中度移植肾功能不全(血肌酐120~250 μmol/L)。本研究回顾性分析了2010-2020年在上海交通大学附属第一人民医院接受上述四联免疫抑制剂治疗的患者资料,现总结如下。
1 资料和方法 1.1 研究对象选择2010-2020年在上海交通大学附属第一人民医院接受三联免疫抑制剂(霉酚酸制剂/咪唑立宾+CNI+糖皮质激素)治疗的移植肾功能不全患者。纳入标准:(1)接受同种异体肾移植术后服用不包含西罗莫司的三联免疫抑制剂(霉酚酸制剂/咪唑立宾+CNI+糖皮质激素)治疗且有移植肾功能不全(血肌酐120~250 μmol/L);(2)入组前1个月未诊断过急性排斥反应,未调整过免疫抑制治疗方案;(3)接受药物转换。排除标准:(1)二次肾移植术后;(2)胰肾联合等多器官移植术后;(3)不能按照研究计划规律随访。
1.2 药物转换治疗方案患者减少CNI剂量,同时口服西罗莫司(初始剂量0.5 mg/d)。根据肾功能与血药浓度调整西罗莫司和CNI剂量。治疗目标为西罗莫司血药浓度2~4 ng/mL,CNI血药浓度降低。
1.3 观察指标调整治疗方案后每周至少复查1次血肌酐,定期复查血脂、血常规等。血肌酐降低比例=(四联免疫抑制剂治疗后血肌酐-四联免疫抑制剂治疗前血肌酐)/四联免疫抑制剂治疗前血肌酐。以血肌酐降低至正常水平(< 110 μmol/L)且连续2次检测正常为肾功能恢复正常。以慢性肾脏病流行病合作工作组(Chronic Kidney Disease Epidemiology Collaboration,CKD-EPI)开发的公式计算估算的肾小球滤过率(estimated glomerular filtration rate,eGFR)。利用雅培ARCHITECT i1000全自动免疫分析仪(美国雅培公司)采用免疫荧光法检测血清药物浓度。
1.4 统计学处理应用SPSS 19.0软件进行统计学分析。符合正态分布的计量资料以x±s表示,组内比较采用配对t检验,组间比较采用独立样本t检验;不符合正态分布的计量资料以中位数(范围)表示,比较采用非参数检验。计数资料以例数和百分数表示,组间比较采用χ2检验。检验水准(α)为0.05。
2 结果 2.1 入组患者基本情况满足纳入和排除标准的患者共59例,其中男44例、女15例,年龄19~65(37.90±10.07)岁。患者均在上海交通大学附属第一人民医院接受同种异体肾移植,术后接受霉酚酸制剂/咪唑立宾+CNI+糖皮质激素三联免疫抑制剂治疗。霉酚酸制剂/咪唑立宾:55例服用霉酚酸制剂,包括吗替麦考酚酯胶囊(商品名:骁悉)和麦考酚钠肠溶片(商品名:米芙),4例服用咪唑立宾;CNI:39例服用他克莫司(商品名:普乐可复),20例服用环孢素(商品名:新山地明);糖皮质激素:59例患者均服用泼尼松或甲泼尼龙。患者转换治疗药物方案前血肌酐水平为127~237(148.88±27.64)μmol/L。
2.2 药物转换治疗情况59例患者均按原计划自初始剂量(0.5 mg/d)开始服用西罗莫司,并逐渐减少CNI剂量。至四联免疫抑制剂治疗调整完成时,持续治疗时间为中位数10.5(2~52)个月,西罗莫司血药浓度为1.53~8.96(4.74±1.62)ng/mL。59例患者中有53例实现了CNI血药浓度降低,降低比例为(37.00±19.00)%,其中降低比例为0%~10%、>10%~20%、>20%~30%、>30%~40%、>40%~50%、>50%~60%、>60%~70%的患者分别为1、10、8、17、7、9、1例;4例患者CNI血药浓度升高,升高比例分别为7.97%、8.68%、10.00%和17.07%;2例患者CNI种类更换(环孢素更换为他克莫司)。此外,霉酚酸制剂/咪唑立宾剂量减少、维持不变的患者分别为20、32例,每日糖皮质激素剂量减少、维持不变的患者分别有29、24例。
2.3 四联免疫抑制剂的治疗效果如表 1所示,追加小剂量西罗莫司并更换为四联免疫抑制剂治疗后,患者肾功能较前明显好转,血肌酐水平由药物转换治疗前的127~237(148.88±27.64)μmol/L降低为67~210(111.53±24.87)μmol/L,eGFR由药物转换治疗前的(48.66±11.92)mL/(min•1.73 m2)升高为(69.26±18.50)mL/(min•1.73 m2),差异均有统计学意义(P均 < 0.01)。与此同时,患者血脂(甘油三酯和胆固醇)较药物转换治疗前略有升高,但差异无统计学意义(P均>0.05);白蛋白、血小板计数和血红蛋白较药物转换治疗前均无明显变化(P均>0.05)。
|
|
表 1 肾移植患者转换为四联免疫抑制剂治疗后肾功能、血脂和血常规指标的变化 Tab 1 Changes of renal function, blood lipid and blood routine indexes of patients undergoing renal transplantation after conversion to quadruple immunosuppressive therapy |
2.4 早期药物转换和晚期药物转换的治疗效果
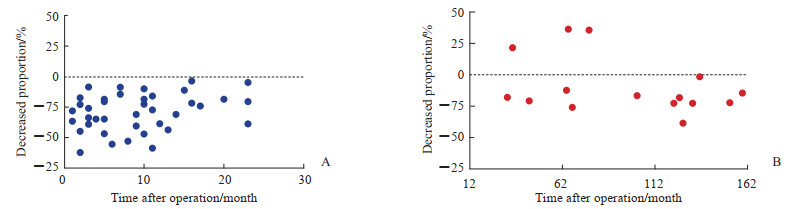
患者药物转换治疗的时间存在一定分布特征,59例患者中,44例在术后1~23个月转换为四联免疫抑制剂治疗,15例在术后32~159个月转换为四联免疫抑制剂治疗。以术后2年为界,将59例患者分别纳入早期转换组(n=44)和晚期转换组(n=15)。由表 2可见,两组患者性别差异无统计学意义(P>0.05),但早期转换组患者的年龄小于晚期转换组(P < 0.05);药物转换治疗前,两组患者血肌酐、甘油三酯、胆固醇水平差异均无统计学意义(P均>0.05);两组患者接受四联免疫抑制剂治疗的持续时间差异无统计学意义(P>0.05);药物转换治疗后,两组患者西罗莫司血药浓度、CNI血药浓度降低或不变的比例、霉酚酸制剂/咪唑立宾剂量降低或不变的比例、糖皮质激素剂量降低或不变的比例、血肌酐水平和血脂水平差异均无统计学意义(P均>0.05),早期转换组药物转换后血肌酐水平较转换前降低(P < 0.05),晚期转换组药物转换后血肌酐水平较转换前有所降低但差异无统计学意义(P>0.05)。此外,早期转换组接受四联免疫抑制剂治疗后血肌酐水平降低比例较晚期转换组更为明显(图 1),肾功能恢复正常的患者比例也高于晚期转换组[77.27%(34/44)vs 40.00%(6/15),P < 0.05]。
|
|
表 2 早期转换组和晚期转换组肾移植患者药物转换治疗前后各项指标比较 Tab 2 Comparison of indexes between renal transplant patients in early and late conversion groups before and after drug conversion |
|
图 1 早期转换组(A)和晚期转换组(B)药物转换后血肌酐降低比例分布 Fig 1 Proportion distribution of serum creatinine decreased in early (A) and late (B) conversion groups after drug conversion |
3 讨论
CNI是肾移植术后广泛使用的免疫抑制剂,常用药物为环孢素和他克莫司,其本身具有一定的肾毒性,可引起急/慢性移植肾功能不全和移植肾慢性纤维化等组织学改变[16-17]。西罗莫司与环孢素和他克莫司同属大环内酯类药物,但具有不同的作用靶点和代谢通道。有研究显示,用西罗莫司完全替代CNI可缓解移植肾功能不全[18-19]。基于这些发现,我们尝试降低移植肾功能不全患者的CNI剂量,降低CNI带来的肾功能负荷以促进移植肾功能恢复。减少CNI剂量的同时,通过追加西罗莫司维持足够的免疫抑制强度,用以治疗轻、中度移植肾功能不全(血肌酐120~250 μmol/L)。
本研究结果显示,追加小剂量西罗莫司后,绝大多数患者(53/59)的CNI血药浓度降低,西罗莫司血药浓度为(4.74±1.62)ng/mL。总体而言,四联免疫抑制剂治疗的转换是成功的。四联免疫抑制剂治疗后患者肾功能明显改善,血肌酐水平由药物转换治疗前的127~237(148.88±27.64)μmol/L降低为67~210(111.53±24.87)μmol/L,eGFR由药物转换治疗前的(48.66±11.92)mL/(min•1.73 m2)升高为(69.26±18.50)mL/(min•1.73 m2),差异均有统计学意义(P均 < 0.01)。我们认为移植肾功能恢复的主要原因在于降低了CNI剂量及CNI导致的移植肾负荷,同时追加的小剂量西罗莫司保障了整体免疫抑制强度。本研究结果还显示在减少CNI、追加西罗莫司的同时,绝大部分患者霉酚酸制剂/咪唑立宾和糖皮质激素剂量维持不变或减少,提示追加的西罗莫司不但弥补了减量CNI应有的治疗强度,还替代了部分霉酚酸制剂/咪唑立宾和糖皮质激素的免疫抑制作用。
CNI本身具有影响血糖、血脂代谢的不良反应,而血脂升高也是西罗莫司常见的不良反应之一[13, 20]。本研究中西罗莫司使用剂量为小剂量(初始剂量0.5 mg/d,目标血药浓度为2~4 ng/mL)的目的在于控制西罗莫司导致的血脂代谢不良反应。研究结果显示转换为四联免疫抑制剂治疗后患者甘油三酯和胆固醇水平虽然都有所升高,但差异并无统计学意义(P均>0.05)。上述结果说明该四联免疫抑制剂治疗方案对患者血脂代谢影响不大。需要指出的是,这一结果一方面有赖于控制西罗莫司浓度(目标血药浓度2~4 ng/mL,实际平均浓度为4.74 ng/mL),另一方面也有赖于控制并减少了口服糖皮质激素的治疗剂量。
移植肾功能不全是多种病因参与的病理过程,患者的临床表现各异。基于临床经验和本研究结果,我们发现肾移植术后不同时间接受四联免疫抑制剂治疗的患者肾功能恢复程度不同,早期转换组患者的肾功能好于晚期转换组。这种治疗效果的差异可能与不同时期CNI参与肾功能不全的致病机制有关。有研究显示,肾移植术后早期CNI通过血管内皮损伤导致肾小球入球动脉收缩、肾单位缺血及后续的移植肾损伤。而长时间的CNI治疗会通过多种作用途径参与移植肾间质纤维化、肾小球硬化等慢性化病变[3]。基于临床观察所见和这些认识,本研究以术后2年为界,将59例患者分为早期转换组(n=44)和晚期转换组(n=15)。研究结果显示,虽然两组患者都完成了相同的四联免疫抑制剂治疗转换,但早期转换组患者获得了更为理想的肾功能恢复,这与早期CNI所致的可逆性肾损害(肾血管内皮损伤和肾小球动脉收缩)的特征一致。晚期转换组患者药物转换治疗前血肌酐水平与早期组相近,但肾功能恢复不显著,这可能是因为减少CNI虽然可以缓解其肾损害作用,但无法逆转已发生的移植肾慢性改变(间质纤维化、肾小管萎缩、肾小球硬化等)。文献报道西罗莫司可以通过调控血小板源性生长因子、骨形态发生蛋白7和TGF-β缓解移植肾纤维化[21-22],但本研究中晚期转换组并未观察到肾移植功能的显著改善。这可能是因为追加的西罗莫司剂量较小,尚不足以产生显著的逆转慢性移植肾病变的效果。此外,晚期转换组患者年龄大于早期转换组,年龄越大患者的整体健康水平下降,可能存在更多的其他系统(心血管和内分泌系统)疾病参与移植肾功能减退,这或许也限制了四联免疫抑制剂的治疗效果。
目前CNI仍是肾移植术后维持免疫抑制治疗的基石之一。单纯减少CNI剂量虽然可以缓解CNI导致的肾毒性,但可能导致移植术后免疫抑制不足、排斥反应增多。本研究采用的四联免疫抑制治疗方案通过增加小剂量西罗莫司维持了充足而稳定的免疫抑制强度,获得移植肾功能的稳定改善,同时追加的小剂量西罗莫司也未造成血脂代谢异常等不良反应。
本研究还发现,早期转换组除了治疗效果好于较晚期转换组,治疗持续时间也相对更短。早期转换组患者接受四联免疫抑制剂的治疗持续时间中位数为9.5个月,而晚期转换组为11.0个月,虽然两组差异无统计学意义(P>0.05),但早期转换组实际最短治疗时间只有2个月。上述结果提示对术后早期移植肾功能不全患者追加小剂量西罗莫司并降低CNI血药浓度,可以更快、更显著地改善移植肾功能。
综上所述,本研究探索了术后肾移植功能不全患者应用减少CNI剂量并追加小剂量西罗莫司的四联免疫抑制剂方案的疗效和安全性,结果显示转换为四联免疫抑制剂治疗方案后患者移植肾功能显著改善且血脂代谢未受到明显影响,并且术后早期(2年内)转换为四联免疫抑制剂治疗的患者移植肾功能改善更为明显,说明以西罗莫司为主的四联免疫抑制剂治疗对于移植肾功能不全尤其术后早期移植肾功能不全患者是安全、有效的。本研究为回顾性分析,样本量较小、信息量有限,也未能对药物转换治疗前后的尿蛋白水平进行定量观察,希望今后能开展更大样本的随机对照研究,更深入地探索以西罗莫司为主的四联免疫抑制剂治疗的应用效果,为肾移植患者建立疗效更高、不良反应更少的长期免疫抑制治疗方案。
| [1] |
HART A, SMITH J M, SKEANS M A, GUSTAFSON S K, WILK A R, CASTRO S, et al. OPTN/SRTR 2017 annual data report: kidney[J]. Am J Transplant, 2019, 19(Suppl 2): 19-123. |
| [2] |
NANKIVELL B J, BORROWS R J, FUNG C L, O'CONNELL P J, ALLEN R D, CHAPMAN J R. The natural history of chronic allograft nephropathy[J]. N Engl J Med, 2003, 349: 2326-2333. DOI:10.1056/NEJMoa020009 |
| [3] |
FAROUK S S, REIN J L. The many faces of calcineurin inhibitor toxicity-what the FK?[J]. Adv Chronic Kidney Dis, 2020, 27: 56-66. DOI:10.1053/j.ackd.2019.08.006 |
| [4] |
张小东, 杨辉, 王伟. 中国肾移植受者哺乳动物雷帕霉素靶蛋白抑制剂临床应用专家共识[J/CD]. 实用器官移植电子杂志, 2018, 6: 83-89.
|
| [5] |
FANTUS D, ROGERS N M, GRAHAMMER F, HUBER T B, THOMSON A W. Roles of mTOR complexes in the kidney: implications for renal disease and transplantation[J]. Nat Rev Nephrol, 2016, 12: 587-609. |
| [6] |
OBERBAUER R, SEGOLONI G, CAMPISTOL J M, KREIS H, MOTA A, LAWEN J, et al. Early cyclosporine withdrawal from a sirolimus-based regimen results in better renal allograft survival and renal function at 48 months after transplantation[J]. Transpl Int, 2005, 18: 22-28. DOI:10.1111/j.1432-2277.2004.00052.x |
| [7] |
DHARNIDHARKA V R. Costimulation blockade with belatacept in renal transplantation[J]. N Engl J Med, 2005, 353: 2085-2086. DOI:10.1056/NEJM200511103531919 |
| [8] |
邱建新. 西罗莫司: 一种新的免疫抑制剂[J]. 世界临床药物, 2003, 24: 237-239, 242. |
| [9] |
GROTH C G, BÄCKMAN L, MORALES J M, CALNE R, KREIS H, LANG P, et al. Sirolimus (rapamycin)-based therapy in human renal transplantation: similar efficacy and different toxicity compared with cyclosporine. Sirolimus European Renal Transplant Study Group[J]. Transplantation, 1999, 67: 1036-1042. DOI:10.1097/00007890-199904150-00017 |
| [10] |
KAHAN B D, JULIAN B A, PESCOVITZ M D, VANRENTERGHEM Y, NEYLAN J. Sirolimus reduces the incidence of acute rejection episodes despite lower cyclosporine doses in Caucasian recipients of mismatched primary renal allografts: a phase Ⅱ trial. Rapamune Study Group[J]. Transplantation, 1999, 68: 1526-1532. DOI:10.1097/00007890-199911270-00016 |
| [11] |
ANIL KUMAR M S, HEIFETS M, FYFE B, SAAED M I, MORITZ M J, PARIKH M H, et al. Comparison of steroid avoidance in tacrolimus/mycophenolate mofetil and tacrolimus/sirolimus combination in kidney transplantation monitored by surveillance biopsy[J]. Transplantation, 2005, 80: 807-814. DOI:10.1097/01.tp.0000173378.28790.0b |
| [12] |
KARPE K M, TALAULIKAR G S, WALTERS G D. Calcineurin inhibitor withdrawal or tapering for kidney transplant recipients[J/CD]. Cochrane Database Syst Rev, 2017, 7: CD006750. DOI: 10.1002/14651858.CD006750.pub2.
|
| [13] |
STALLONE G, INFANTE B, GRANDALIANO G, GESUALDO L. Management of side effects of sirolimus therapy[J]. Transplantation, 2009, 87(8 Suppl): S23-S26. |
| [14] |
ZHAO D Q, LI S W, SUN Q Q. Sirolimus-based immunosuppressive regimens in renal transplantation: a systemic review[J]. Transplant Proc, 2016, 48: 3-9. DOI:10.1016/j.transproceed.2016.01.002 |
| [15] |
DE SIMONE P, CARRAI P, COLETTI L, GHINOLFI D, PETRUCCELLI S, FILIPPONI F. Modification of immunosuppressive therapy as risk factor for complications after liver transplantation[J]. Best Pract Res Clin Gastroenterol, 2017, 31: 199-209. DOI:10.1016/j.bpg.2017.03.001 |
| [16] |
HOŠKOVÁ L, MÁLEK I, KOPKAN L, KAUTZNER J. Pathophysiological mechanisms of calcineurin inhibitor-induced nephrotoxicity and arterial hypertension[J]. Physiol Res, 2017, 66: 167-180. |
| [17] |
VANHOVE T, GOLDSCHMEDING R, KUYPERS D. Kidney fibrosis: origins and interventions[J]. Transplantation, 2017, 101: 713-726. DOI:10.1097/TP.0000000000001608 |
| [18] |
CHEN G D, LIU X C, SHI L, QIU J, WANG C X, FEI J G, et al. Calcineurin inhibitor conversion to rapamycin can improve graft function in living donor kidney transplantation with older donors[J]. Transplant Proc, 2013, 45: 1648-1650. DOI:10.1016/j.transproceed.2013.01.099 |
| [19] |
韩飞, 吴建永, 黄洪锋, 张晓辉, 何强, 王逸民, 等. 肾移植慢性移植物功能不全患者环孢素切换为西罗莫司4年随访研究[J/CD]. 中华移植杂志(电子版), 2010, 4: 276.
|
| [20] |
VERGÈS B, CARIOU B. mTOR inhibitors and diabetes[J]. Diabetes Res Clin Pract, 2015, 110: 101-108. DOI:10.1016/j.diabres.2015.09.014 |
| [21] |
白莉, 康晓明, 张洋. 雷帕霉素对大鼠肾间质纤维化中PDGF, TGF-β和BMP-7表达的影响[J]. 齐齐哈尔医学院学报, 2015, 36: 1726-1727. |
| [22] |
张彩侠, 俞香宝, 邢昌赢, 赵秀芬, 钱军, 孙彬. 雷帕霉素对肾间质成纤维细胞结缔组织生长因子和纤维连接蛋白表达的影响[J]. 江苏医药, 2012, 38: 2381-2383. DOI:10.19460/j.cnki.0253-3685.2012.20.007 |
 2021, Vol. 42
2021, Vol. 42


