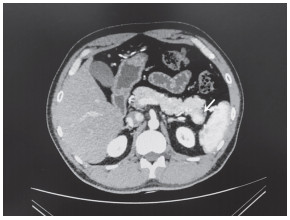
病例1,男,31岁,因“体检发现胰腺尾部占位2周”于2019年5月15日入院。患者于外院查增强MRI提示胰体尾富血供占位,考虑神经内分泌肿瘤(neuroendocrine neoplasm,NEN)可能,遂来我院就诊。患者无腹痛、腹胀、恶心、呕吐、发热、体重减轻等表现。腹部体格检查未见阳性体征。查肿瘤指标癌胚抗原、CA19-9均未见异常。CT检查示胰腺走行自然,胰体尾部见直径约1.7 cm的等高密度结节,增强后强化程度始终高于胰腺实质,与脾脏实质强化相仿,胰管未见扩展,胰周脂肪清晰,考虑NEN可能(图 1)。术前诊断为胰腺NEN。于2019年5月16日行机器人辅助胰体尾脾切除术。术中超声刀离断胃结肠韧带,充分显露胰腺后见肿物位于胰体尾部,直径约2 cm,与周围组织轻度粘连,切割闭合器离断胰腺后完整切除胰体尾部及脾脏。术后大体病理见胰体尾切除标本大小约6 cm×6 cm×2 cm,胰体尾部见一灰褐色结节,大小约2 cm×1.5 cm×1.3 cm,质地柔软,与周围组织分界清楚;另于脂肪组织内可见副脾1枚,直径约1.2 cm。术后病理诊断为(胰体尾及脂肪内结节)异位脾脏。术后予常规抗炎、补液治疗,患者恢复良好,于2019年5月21日出院。术后6个月时复查CT示胰体尾部脾脏切除术后,余未见异常。
|
图 1 病例1腹部增强CT检查示胰体尾部结节样强化病灶(箭头所示) CT:计算机断层扫描. |
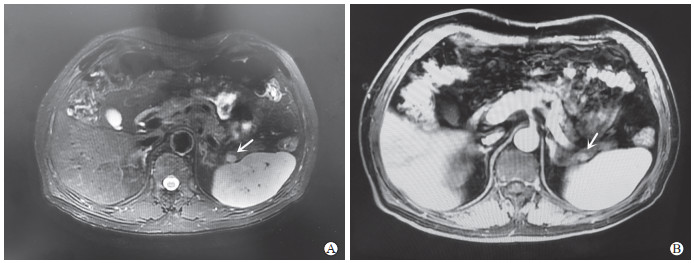
病例2,男,65岁,因“体检发现胰腺尾部占位20 d”于2019年6月26日入院。患者于外院查增强CT示胰体尾部强化结节,考虑NEN可能。患者无明显不适主诉及阳性体征。我院查癌胚抗原、CA19-9均未见异常。MRI检查显示胰腺形态大小正常,腺体信号均匀,胰体尾部见小结节影,直径约9 mm,呈T1低信号、T2高信号,弥散受限,增强后持续强化,胰管未见扩张,胰周脂肪清晰,考虑NEN可能性大(图 2)。PET-CT检查示胰体尾部见1枚稍低密度小结节,边界欠清,放射性摄取增高,考虑NEN可能。术前诊断胰腺NEN。于2019年6月27日行腹腔镜胰体尾脾切除术。术中见肿物位于胰体尾部,直径约1 cm,同法切除胰体尾脾脏。术后大体病理见胰体尾部结节,大小约1.2 cm×1.1 cm×1 cm,灰褐色,实性,质地中等,与周围组织分界清楚。术后病理诊断为(胰体尾)副脾。术后患者恢复顺利,无并发症,于2019年7月3日出院。术后7个月时复查CT示胰体尾脾脏切除术后,无明显不适主诉。
|
图 2 病例2腹部MRI检查图像 A:T2加权像示胰体尾部见一直径约9 mm的高信号结节影(箭头所示),与脾脏信号一致;B:增强检查示病灶(箭头所示)呈均匀强化. MRI:磁共振成像. |
2 讨论
胰腺内异位副脾(intrapancreatic accessory spleen,IPAS)是一种罕见的胰腺良性占位,多发生于胰腺尾部,因影像学表现与多种胰腺肿瘤重叠,常被误诊为胰腺肿瘤,尤其是NEN。副脾指正常脾脏外存在的具有正常结构、功能的脾组织,副脾的发生率约为10%,多位于脾门、胰体尾部,完全位于胰腺实质内的较少见[1]。副脾的发生原因可能是胚胎期胃背系膜脾芽融合失败或单个细胞分离发育而成[1]。本组病例1可见副脾同时合并IPAS,推测可能即为此原因所致。IPAS体积通常较小,无特异症状及体征,常于影像学检查时意外发现。确诊的IPAS一般不需要特殊处理,但因IPAS的影像学表现与胰腺肿瘤类似,因此临床上多由于术前误诊或无法明确诊断而进行切除。
超声是最常用的检查手段,但是胰体尾部通常被肠道遮挡,受气体干扰,普通超声往往不易探及。IPAS的CT平扫呈均匀等密度结节影,因为IPAS一般体积较小,增强扫描动脉期可能没有典型的脾脏“花斑样”强化的特点,通常表现为不均匀性强化,静脉期强化与脾脏一致,高于胰腺实质[2]。IPAS的MRI表现也与脾脏基本一致。脾脏组织内红髓含大量静脉性血窦,水分含量高,MRI T1加权像中病灶信号低于胰腺组织,T1加权像可以很好地显示病灶。T2加权像与弥散加权成像表现为脾脏等信号。由于脾组织网状内皮系统结构致密,增强动脉期可表现为“花斑样”或不均匀强化,平衡期强化均匀,呈现出前后不一的强化表现[3]。超声引导下细针穿刺活检具有很高的诊断价值,当穿刺获得病理明确为脾窦内皮组织时即可确诊IPAS。该方法依赖操作者技术,并对患者有一定的创伤,且具有潜在出血、感染、胰瘘等风险,但当影像学难以给出定论时,为避免不必要的手术干预和手术创伤,细针穿刺仍然值得考虑[4]。
NEN的影像学表现与IPAS非常相似,同样为动脉期明显强化,静脉期延迟强化。功能性NEN如胰岛素瘤、胃泌素瘤等常伴随相应症状,如皮肤潮红、低血糖、难治性消化道溃疡等,一般结合临床表现和影像学表现不难诊断。临床上IPAS常容易被误诊为无功能性胰腺神经内分泌肿瘤(non-functioning pancreatic neuroendocrine neoplasm,NFPNEN),本组2例患者均因此而行手术治疗。NFPNEN虽然可以合成并分泌激素类物质,但是由于合成后无法分泌、分泌量不足或激素本身无法引起症状,常常没有特异性临床表现;肿瘤较大时可出现腹痛、腹胀、腹部包块等症状,较小的NFPNEN常为体检时发现。指南对于直径 < 2 cm、未见恶性征象的NFPNEN推荐随访,但由于缺乏临床随访数据,对于年轻健康患者目前仍推荐切除[5]。NFPNEN的CT表现为动脉期明显强化,强化方式可为均匀或环形强化[5]。一般来说,IPAS病灶信号与同层面脾脏相近,内部均匀,多期增强显示为前后不一的强化。而NFPNEN的T2及弥散信号可高于脾脏信号,多期增强显示为前后一致的强化,且多见囊变,病灶内信号欠均,病灶边缘可见假包膜。
虽然IPAS与NFPNEN的影像学表现非常相似,鉴别困难,但是两者的生物学特性截然不同,核医学技术的进步为其鉴别诊断提供了新的解决方案。99mTc热变性红细胞显像(99mTc-heat-denatured red blood cell,HDRBC)利用脾脏网状内皮细胞拦截和破坏衰老变性红细胞的原理,将注入静脉的99mTc标记的热变性红细胞拦截在脾脏,使脾脏显影且影像清晰[6],副脾亦然。应用HDRBC可以选择性地显示脾和IPAS,对IPAS的确诊有重要价值。但是当病灶很小、距脾脏较近时,可能会被脾脏的放射性浓聚掩盖而导致漏诊[6]。此外,NFPNEN细胞表面会高度表达生长抑素受体,这为核医学生长抑素受体显像提供了分子基础。临床常应用68Ga-生长抑素类似物显像(68Ga somatostatin analogue imaging,68Ga-SSA)评估NFPNEN的生物学特性,为病灶筛查、治疗选择、疗效监测等提供信息。68Ga-SSA扫描呈现的肿瘤摄取程度取决于NFPNEN细胞生长抑素受体的表达程度。当肿瘤细胞生长抑素受体表达较高时,其68Ga-SSA图像中的摄取将显著高于脾脏。但是,当病灶位于胰体尾部且68Ga-SSA显示出与脾脏相似的摄取时,应该警惕其他诊断如IPAS的可能性[7]。因此,通过HDRBC和68Ga-SSA的应用可以有效分辨病灶性质。
需要指出的是,IPAS是一种临床罕见疾病,临床医师往往对胰腺高强化病灶先入为主地考虑为NFPNEN,而忽略了IPAS的可能。本组2例患者中,病例1补做了增强CT检查,病例2虽然也进行了MRI、PET-CT等检查,但是常规PET-CT使用的显像剂为18F-氟代脱氧葡萄糖(18F-fluorodeoxyglucose,18F-FDG),不同于68Ga-SSA,18F-FDG的显像依赖于病灶的葡萄糖代谢水平,而局部血流供应情况也是影响18F-FDG摄取的重要因素,因而IPAS与NEN均可出现高摄取,从而误导术前诊断[8]。
综上所述,IPAS无明显临床表现,随着诊疗技术的进步,越来越多的IPAS被发现。但是,因为其影像学表现与其他胰腺肿瘤类似,尤其与NFPNEN影像学表现极其相似,有可能会被误诊,在临床遇到胰体尾部肿瘤时应考虑到IPAS的可能性。应用CT、MRI、99mTc-HDRBC、68Ga-SSA等影像学手段有助于IPAS与其他肿瘤的鉴别诊断,必要时超声引导下细针穿刺也可帮助确诊。一旦确诊为IPAS,可以随诊观察,避免不必要的手术干预。
| [1] |
MOVITZ D. Accessory spleens and experimental splenosis. Principles of growth[J]. Chic Med Sch Q, 1967, 26: 183-187. |
| [2] |
KIM S H, LEE J M, HAN J K, LEE J Y, KIM K W, CHO K C, et al. Intrapancreatic accessory spleen: findings on MR imaging, CT, US and scintigraphy, and the pathologic analysis[J]. Korean J Radiol, 2008, 9: 162-174. DOI:10.3348/kjr.2008.9.2.162 |
| [3] |
卢明智, 王铁功, 邵成伟, 詹茜. 胰腺内副脾与G1级神经内分泌肿瘤的MRI鉴别诊断[J]. 中华胰腺病杂志, 2020, 20: 289-294. DOI:10.3760/cma.j.cn115667-20200116-00008 |
| [4] |
孙逢春, 张雅静. 胰腺内异位副脾的MSCT诊断及误诊分析(附2例报道)[J]. 影像研究与医学应用, 2021, 5: 189-190, 193. |
| [5] |
戴梦华, 王文倩. 无功能性胰腺神经内分泌肿瘤外科治疗[J]. 中国实用外科杂志, 2019, 39: 907-910. |
| [6] |
OTA T, TEI M, YOSHIOKA A, MIZUNO M, WATANABE S, SEKI M, et al. Intrapancreatic accessory spleen diagnosed by technetium-99m heat-damaged red blood cell SPECT[J]. J Nucl Med, 1997, 38: 494-495. |
| [7] |
SCHMID-TANNWALD C, SCHMID-TANNWALD C M, MORELLI J N, NEUMANN R, HAUG A R, JANSEN N, et al. Comparison of abdominal MRI with diffusion-weighted imaging to 68Ga-DOTATATE PET/CT in detection of neuroendocrine tumors of the pancreas[J]. Eur J Nucl Med Mol Imaging, 2013, 40: 897-907. DOI:10.1007/s00259-013-2371-5 |
| [8] |
赵帅, 程超, 左长京. 68Ga-SSA/18F-FDG PET/CT联合显像在神经内分泌肿瘤诊治中的应用价值[J]. 中华核医学与分子影像杂志, 2020, 40: 47-51. |
 2021, Vol. 42
2021, Vol. 42


