滤泡性淋巴瘤(follicular lymphoma,FL)是一种常见的非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL),在西方国家中占NHL的22%~35%,在我国所占比例较西方国家低,为8.1~23.5%[1-3]。FL临床呈现为惰性病程,对一线化疗反应敏感,总体预后较好,但绝大多数FL难以治愈或极易复发,个体之间的预后具有极大异质性[2]。因此,在利妥昔单抗(rituximab)时代需要对FL患者进行精确的预后评估以指导临床治疗。2004年Solal-Celigny等[4]通过回顾性研究建立了滤泡性淋巴瘤国际预后指数(follicular lymphoma international prognostic index,FLIPI),但FLIPI评分是基于利妥昔单抗使用前的数据,可能不足以反映利妥昔单抗时代FL的病程。为适应利妥昔单抗时代,同一工作组于2009年基于前瞻性研究又建立了FLIPI2预后评分模型,两者均为无进展生存(progress-free survival,PFS)的独立预测因素,并在多个独立队列中证实了有效性[5-6]。FLIPI和FLIPI2这2种预后评分模型均将年龄>60岁列为预后不良的一项因素,但有研究显示年龄对FL预后的影响尚无定论[7]。在剔除年龄因素后,2种FL预后评分模型的预测价值目前尚无报道。本研究回顾性分析了FLIPI和FLIPI2这2种FL预后评分模型的预测价值,以期更好地指导临床精准化治疗。
1 资料和方法 1.1 病例来源收集2007年11月16日至2019年6月1日海军军医大学(第二军医大学)长海医院血液科收治的初诊FL患者的临床资料。纳入标准:(1)经组织病理学确诊为FL初发患者,且符合WHO 2008年关于淋巴组织肿瘤分类标准;(2)年龄≥18岁;(3)既往无恶性肿瘤病史,无同时发生其他肿瘤;(4)接受标准治疗方案≥4个疗程,可行疗效评估。排除标准:(1)既往接受过化疗和/或造血干细胞移植等全身性或局部性治疗;(2)既往或同时并发其他恶性肿瘤病史;(3)伴有未控制的心脑血管疾病、凝血功能障碍性疾病、严重感染性疾病等;(4)左心室射血分数≤50%;(5)目前患有活动性肝病或胆道疾病。最终共107例FL患者纳入本研究。本研究通过海军军医大学(第二军医大学)长海医院医学伦理委员会审批。
1.2 治疗方法及疗效评估107例患者中52例接受含利妥昔单抗的化疗方案(利妥昔单抗联合化疗组),其中45例接受R-CHOP(E)方案(利妥昔单抗、环磷酰胺、多柔比星、长春新碱、依托泊苷、泼尼松)、7例接受RFC/RFND方案(利妥昔单抗、氟达拉滨、环磷酰胺、米托蒽醌、地塞米松);55例接受传统化疗方案(单纯化疗组),其中23例接受CHOP(E)方案、32例接受FC/FND方案。21 d为1个疗程,两组均完成至少4个疗程化疗。按照Lugano标准[8]进行疗效评估,完全缓解(complete remission,CR)指无临床、影像学或其他的淋巴瘤证据,肿瘤病灶完全消失达1个月以上;部分缓解(partial remission,PR)指肿瘤病灶的最大直径及其最大垂直横径的乘积缩小50%以上,其他病灶无增大,并且维持1个月以上,B症状消失;疾病稳定(stable disease,SD)指肿瘤病灶的最大直径及其最大垂直横径的乘积缩小不足50%,或病灶大小无明显变化;疾病进展(progressive disease,PD)指肿瘤病灶最大直径及其最大垂直横径的乘积至少增大25%或有新的病灶出现,或重新出现B症状而无其他解释。
1.3 随访对所有患者通过电话、查阅住院或门诊病历进行随访,随访时间截至2019年8月12日。本研究的主要观察终点是PFS,其定义为从明确诊断至PD、复发或任何原因引起的死亡的时间。
1.4 统计学处理应用SPSS 21.0软件进行数据分析。呈偏态分布的计量资料以中位数(范围)表示;计数资料以例数和百分数表示,组间比较采用χ2检验。生存分析采用Kaplan-Meier法并绘制生存曲线,各组生存曲线的比较采用log-rank检验。所有检验均为双侧检验,检验水准(α)为0.05。
2 结果 2.1 患者的一般临床特征107例患者中男60例、女47例,中位年龄为53(25~77)岁。年龄≤60岁组84例(78.5%),年龄>60岁组23例(21.5%)。Ann Arbor分期Ⅲ~Ⅳ期患者78例(72.9%),有B症状者24例(22.4%),美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分>1分者13例(12.1%),累及淋巴结最长径>7 cm者仅有3例,骨髓受累者23例(21.5%)。治疗有反应(CR+PR)者89例(83.2%),PD+SD者18例(16.8%),复发者17例(15.9%)。利妥昔单抗联合化疗组和单纯化疗组患者在年龄、性别、Ann Arbor分期、ECOG评分、累及淋巴结最长径>7 cm、有无骨髓累及、血红蛋白水平、β2-微球蛋白水平、FL病理分级、治疗反应、FLIPI评分和FLIPI2评分方面的差异均无统计学意义(P均>0.05)。与单纯化疗组相比,利妥昔单抗联合化疗组有更多的患者伴随B症状(χ2=4.044,P=0.044)、淋巴结侵犯(>4个)(χ2=6.996,P=0.008)、乳酸脱氢酶(lactate dehydrogenase,LDH)水平升高(χ2=5.250,P=0.022),且淋巴瘤国际预后指数(international prognostic index,IPI)评分高危组(评分≥3分)患者更多(χ2=6.542,P=0.038)。见表 1。
|
|
表 1 两组FL患者的临床特征 Tab 1 Clinical characteristics of FL patients in 2 groups |
2.2 生存分析
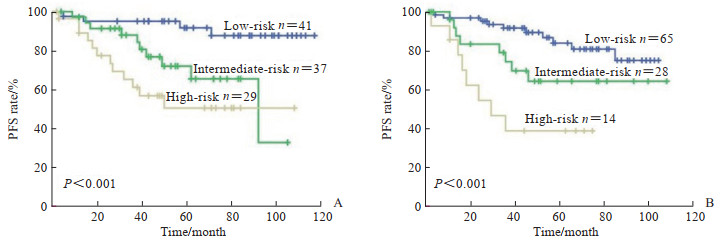
中位随访时间为50(2~117)个月,全组患者的3年和5年PFS率分别为83.8%和74.9%。根据FLIPI预后评分模型分组,低危(评分0~1分)41例(38.3%)、中危(评分2分)37例(34.6%)、高危(评分≥3分)29例(27.1%),3组患者的5年PFS率分别为91.7%、72.0%和50.4%(χ2=14.274,P < 0.001;图 1A)。根据FLIPI2预后评分模型分组,低危(评分0~1分)65例(60.7%)、中危(评分2分)28例(26.2%)、高危(评分≥3分)14例(13.1%),3组患者的5年PFS率分别为86.8%、64.4%和39.0%(χ2=16.675,P < 0.001;图 1B)。
|
图 1 根据FLIPI(A)和FLIPI2(B)评分分组的107例FL患者的PFS比较 Fig 1 Comparison of PFS according to FLIPI (A) and FLIPI2 (B) scores in 107 FL patients In both prognostic scoring models, the low-, intermediate-and high-risk were scored 0-1, 2 and ≥3, respectively. FLIPI: Follicular lymphoma international prognostic index; FL: Follicular lymphoma; PFS: Progress-free survival. |
亚组分析显示,利妥昔单抗联合化疗组和单纯化疗组患者的5年PFS率分别为84.8%和66.9%(χ2=4.333,P=0.037)。在利妥昔单抗联合化疗组,根据FLIPI预后评分模型分组,低危14例(26.9%)、中危22例(42.3%)、高危16例(30.8%),3组患者的5年PFS率分别为100.0%、83.3%和70.5%,差异无统计学意义(χ2=5.239,P=0.073;图 2A)。根据FLIPI2预后评分模型分组,低危30例(57.7%)、中危15例(28.8%)、高危7例(13.5%),3组患者的5年PFS率分别为96.0%、81.5%和35.7%,差异有统计学意义(χ2=21.597,P < 0.01;图 2B)。

|
图 2 根据FLIPI(A)和FLIPI2(B)评分分组的52例利妥昔单抗联合化疗组FL患者的PFS比较 Fig 2 Comparison of PFS according to FLIPI (A) and FLIPI2 (B) scores in 52 FL patients with rituximab combined chemotherapy In both prognostic scoring models, the low-, intermediate-and high-risk were scored 0-1, 2 and ≥3, respectively. FLIPI: Follicular lymphoma international prognostic index; FL: Follicular lymphoma; PFS: Progress-free survival. |
单纯化疗组患者FLIPI评分低、中、高危组患者分别为27例(49.1%)、15例(27.3%)、13例(23.6%),3组患者的5年PFS率分别为87.0%、56.1%和35.9%,差异有统计学意义(χ2=11.982,P=0.003;图 3A);FLIPI2评分低、中、高危组患者分别为35例(63.6%)、13例(23.6%)、7例(12.7%),3组患者的5年PFS率分别为79.1%、49.0%和42.9%,差异无统计学意义(χ2=3.825,P=0.148;图 3B)。

|
图 3 根据FLIPI(A)和FLIPI2(B)评分分组的55例单纯化疗组FL患者的PFS比较 Fig 3 Comparison of PFS according to FLIPI (A) and FLIPI2 (B) scores in 55 FL patients with chemotherapy alone In both prognostic scoring models, the low-, intermediate-and high-risk were scored 0-1, 2 and ≥3, respectively. FLIPI: Follicular lymphoma international prognostic index; FL: Follicular lymphoma; PFS: Progress-free survival. |
107例FL患者按年龄分组后,年龄≤60岁组(n=84)和年龄>60岁组(n=23)患者5年PFS率分别为77.4%和67.6%,差异无统计学意义(χ2=0.611,P=0.434)。在年龄≤60岁组,根据FLIPI预后评分模型分组,低危37例(44.0%)、中危31例(36.9%)、高危16例(19.0%),3组患者的5年PFS率分别为93.6%、75.8%和28.4%(χ2=24.004,P < 0.01)。根据FLIPI2预后评分模型分组,低危60例(71.4%)、中危17例(20.2%)、高危7例(8.3%),3组患者的5年PFS率分别为85.9%、70.7%和17.9%,差异有统计学意义(χ2=27.417,P < 0.01)。对于41例利妥昔单抗联合化疗且年龄≤60岁的患者,根据FLIPI预后评分模型分组,低危、中危和高危患者的5年PFS率分别为100.0%、88.0%、72.9%,差异无统计学意义(χ2=4.861,P=0.088;图 4A);根据FLIPI2预后评分模型分组,低危、中危和高危患者的5年PFS率分别为95.2%、87.5%和50.0%,差异有统计学意义(χ2=13.989,P < 0.001;图 4B)。在43例单纯化疗且年龄≤60岁组,根据FLIPI预后评分模型分组,低危25例(58.1%)、中危11例(25.6%)、高危7例(16.3%),3组患者的5年PFS率分别为90.0%、55.4%和0(χ2=26.789,P < 0.01);根据FLIPI2预后评分模型分组,低危34例(79.1%)、中危6例(14.0%)、高危3例(7.0%),3组患者的5年PFS率分别为78.6%、50.0%和0(χ2=13.668,P=0.001)。

|
图 4 根据FLIPI(A)和FLIPI2(B)评分分组的41例利妥昔单抗联合化疗且年龄≤60岁FL患者的PFS比较 Fig 4 Comparison of PFS according to FLIPI (A) and FLIPI2 (B) scores in 41 FL patients with rituximab combined chemotherapy and age≤60 years In both prognostic scoring models, the low-, intermediate-and high-risk were scored 0-1, 2 and ≥3, respectively. FLIPI: Follicular lymphoma international prognostic index; FL: Follicular lymphoma; PFS: Progress-free survival. |
3 讨论
FL是最常见的惰性淋巴瘤,病程发展缓慢,生存期长,治疗方法包括从观察和等待策略到利妥昔单抗联合化疗以及大剂量化疗联合自体造血干细胞移植,更增加了预后评估的难度[9-10]。目前临床上广泛应用FLIPI和FLIPI2预后评分模型对FL患者进行预后分层,然而关于两者的优劣尚无定论。本研究通过在利妥昔单抗联合化疗组和单纯化疗组分别比较FLIPI和FLIPI2的预后价值,以期确定中国FL患者接受免疫化疗的最佳预后模型,并在剔除年龄因素后再次比较了FLIPI和FLIPI2对预后的意义。
本组患者中位年龄为53岁,比国内报道(中位年龄50.5岁)稍高[11],但稍低于国外报道(中位年龄57岁)[12]。因FL起病隐匿,临床症状不典型,本组患者初诊时72.9%(78/107)的患者为Ann Arbor分期Ⅲ~Ⅳ期,且仅有22.4%(24/107)的患者有B症状,与文献报道[11, 13]相似。本研究按是否接受含有利妥昔单抗的化疗将全组患者分为两组,利妥昔单抗联合化疗组较单纯化疗组有更多的患者伴有B症状(P=0.044)、淋巴结侵犯(>4个)(P=0.008)、LDH水平升高(P=0.022),IPI评分高危组患者更多(P=0.038)。107例患者的治疗反应率为83.2%(89/107),利妥昔单抗联合化疗组和单纯化疗组的治疗反应率分别为84.6%(44/52)和81.8%(45/55),两组比较差异无统计学意义(P>0.05)。但利妥昔单抗联合化疗组有更高的5年PFS率(P=0.037),提示加用利妥昔单抗可改善患者预后,与国外研究报道[14]类似。
本研究中位随访时间为50个月,随访结束时绝大多数患者仍存活,且FLIPI和FLIPI2预后评分模型建立时即基于PFS数据,因此,本研究将PFS作为主要观察终点,这亦符合FL惰性发展的病程。本研究结果显示FLIPI和FLIP2均是有效且重要的预后模型,按两者预后分层后,两者低危、中危和高危组的5年PFS率分别为91.7%、72.0%、50.4%和86.8%、64.4%、39.0%,而Bachy等[15]报道FLIPI和FLIP2预后评分模型低危、中危、高危的5年PFS率分别为68%、58%、44%和75%、60%、41%。本研究结果优于国外报道[15],这可能与本组患者相对年轻和骨髓受累较少有关。Zhou等[16]报道利妥昔单抗时代FL患者3年和5年PFS率分别为76.6%、67.5%,本研究全组患者的3年(83.8%)和5年(74.9%)PFS率均优于此报道。该研究中患者的中位年龄[49(18~78)岁]较本组病例年轻,骨髓受累(15.1%)较少,但Ann Arbor分期Ⅲ~Ⅳ期患者占比(87.4%)高于本组(72.9%,78/107)。同时,按FLIPI和FLIPI2预后评分模型分组,低、中危组患者PFS率类似,而高危组5年PFS率略优于该报道(50.4% vs 40.7%和39.0% vs 19.3%)。本研究结果显示,利妥昔单抗联合化疗组FLIPI2的预后分层更优,对低、中和高危组患者的判别能力更强,而FLIPI对单纯化疗组的PFS预测作用更优,国外有类似结果的文献报道[17]。我国王楠等[18]报道在利妥昔单抗时代,FLIPI2相比FLIPI可更好地对FL患者总生存期(overall survival,OS)和PFS进行危险分层。此前国内亦有研究证实在利妥昔单抗时代,FLIPI2对FL患者是否需要利妥昔单抗维持治疗有更好的临床指导意义[19]。提示利妥昔单抗时代,我们或许可仅用FLIPI2对FL患者进行危险分层,简化临床预后判断,更好地指导临床治疗。Alig等[7]比较了FLIPI、FLIPI2和PRIMA预后指数(PRIMA-prognostic index,PRIMA-PI)预后评分模型,PRIMA-PI仅包括β2-微球蛋白水平(>3 mg/L)和骨髓浸润2个危险因素,采用R-CHOP方案作为一线化疗方案,并将其分为3组风险队列,5年PFS率分别为74%、59%和39%(P < 0.000 1),结果显示PRIMA-PI能更好地区分高危患者,尤其是在老年人群中。而本研究及国内其他研究[20]显示中国FL的临床特征是患者中位年龄偏小,骨髓受累比例较低(28.8%~32.6%)。因此,我们认为骨髓受累较少限制了PRIMA-PI的临床应用。因此,FLIPI2也许是一种更适用于中国FL患者的预后评分模型。
在FL中,年龄被认为是最重要的预后因素,诊断时年龄≥60岁在FLIPI和FLIPI2预后评分模型中均作为一个危险因素存在[4, 21]。有研究显示年龄>60岁是影响FL患者PFS和OS的不良预后因素,但多因素分析显示年龄并不是影响PFS的独立预后因素[18]。最近有研究结果显示年龄在FL中的预后作用受到挑战,Alig等[7]通过比较FLIPI、FLIPI2和PRIMA-PI预后评分模型,发现在年龄≤60岁组3种预后评分模型中高危患者的5年PFS和OS率相似;在年龄>60岁组,FLIPI和FLIPI2评分高危组患者的5年PFS和OS率均优于PRIMA-PI评分高危组患者,FLIPI和FLIPI2均高估了老年患者中高危患者的数量;提示高龄与标准免疫化疗效果不佳无关,而是与非复发死亡增加有关。本研究中,剔除年龄影响因素后,比较了FLIPI和FLIPI2预后评分模型评估FL患者PFS的预后价值,结果显示年龄>60岁组和≤60岁组患者5年PFS率差异无统计学意义(P=0.434)。而在年龄≤60岁组FLIPI和FLII2均能进行较好的预后分层,而>60岁组因病例数较少而未显示出明显的预后分层价值(数据未显示),但在利妥昔单抗联合化疗且年龄≤60岁组,仅FLIPI2能区分FL患者不同的预后分层,进一步证实利妥昔单抗时代,FLIPI2是更为合理、有效的预后评分模型,提示年龄可能不再是重要的预后因素,高龄同样可受益于免疫化疗,临床医师需根据患者身体状况进行综合评估以提供个体化治疗。
综上所述,在FL中FLIPI和FLIPI2均是有效的预后评分模型,在利妥昔单抗时代FLIPI2的预后分层意义优于FLIPI,年龄不再是影响FL患者PFS的因素。
| [1] |
TAN D, HORNING S J. Follicular lymphoma: clinical features and treatment[J]. Hematol Oncol Clin North Am, 2008, 22: 863-882. DOI:10.1016/j.hoc.2008.07.013 |
| [2] |
YANG Q P, ZHANG W Y, YU J B, ZHAO S, XU H, WANG W Y, et al. Subtype distribution of lymphomas in Southwest China: analysis of 6, 382 cases using WHO classification in a single institution[J/OL]. Diagn Pathol, 2011, 6: 77. DOI: 10.1186/1746-1596-6-77.
|
| [3] |
中华医学会血液学分会, 中国抗癌协会淋巴瘤专业委员会. 中国滤泡性淋巴瘤诊断与治疗指南(2013年版)[J]. 中华血液学杂志, 2013, 34: 820-824. DOI:10.3760/cma.j.issn.0253-2727.2013.09.020 |
| [4] |
SOLAL-CELIGNY P, ROY P, COLOMBAT P, WHITE J, ARMITAGE J O, ARRANZ-SAEZ R, et al. Follicular lymphoma international prognostic index[J]. Blood, 2004, 104: 1258-1265. |
| [5] |
FORMICA V, NORMAN A R, CUNNINGHAM D, WOTHERSPOON A, OATES J, CHONG G. Utility of the follicular lymphoma international prognostic index and the international prognostic index in assessing prognosis and predicting first-line treatment efficacy in follicular lymphoma patients[J]. Acta Haematol, 2009, 122: 193-199. DOI:10.1159/000253026 |
| [6] |
ARCAINI L, MERLI M, PASSAMONTI F, RIZZI S, FERRETTI V, RATTOTTI S, et al. Validation of follicular lymphoma international prognostic index 2(FLIPI2) score in an independent series of follicular lymphoma patients[J]. Br J Haematol, 2010, 149: 455-457. DOI:10.1111/j.1365-2141.2009.08065.x |
| [7] |
ALIG S, JURINOVIC V, PASTORE A, BARARIA D, HÄBE S, HELLMUTH J C, et al. Impact of age on genetics and treatment efficacy in follicular lymphoma[J/OL]. Haematologica, 2018, 103: e364-e367. DOI: 10.3324/haematol.2018.187773.
|
| [8] |
CHESON B D, FISHER R I, BARRINGTON S F, CAVALLI F, SCHWARTZ L H, ZUCCA E, et al. Recommendations for initial evaluation, staging, and response assessment of Hodgkin and non-Hodgkin lymphoma: the Lugano classification[J]. J Clin Oncol, 2014, 32: 3059-3068. DOI:10.1200/JCO.2013.54.8800 |
| [9] |
HIDDEMANN W, KNEBA M, DREYLING M, SCHMITZ N, LENGFELDER E, SCHMITS R, et al. Frontline therapy with rituximab added to the combination of cyclophosphamide, doxorubicin, vincristine, and prednisone (CHOP) significantly improves the outcome for patients with advanced-stage follicular lymphoma compared with therapy with CHOP alone: results of a prospective randomized study of the German Low-Grade Lymphoma Study Group[J]. Blood, 2005, 106: 3725-3732. |
| [10] |
MARCUS R, IMRIE K, BELCH A, CUNNINGHAM D, FLORES E, CATALANO J, et al. CVP chemotherapy plus rituximab compared with CVP as first-line treatment for advanced follicular lymphoma[J]. Blood, 2005, 105: 1417-1423. DOI:10.1182/blood-2004-08-3175 |
| [11] |
杜晓艳, 胡凯, 赵伟, 杨萍, 万伟, 景红梅, 等. 94例滤泡性淋巴瘤患者的临床特征及预后因素分析[J]. 中国实验血液学杂志, 2018, 26: 756-764. |
| [12] |
KIMBY E, LOCKMER S, HOLTE H, HAGBERG H, WAHLIN B E, BROWN P, et al. The simplified follicular lymphoma PRIMA-prognostic index is useful in patients with first-line chemo-free rituximab-based therapy[J]. Br J Haematol, 2020, 191: 738-747. DOI:10.1111/bjh.16692 |
| [13] |
LI Y, WANG Y, WANG Z, YI D, MA S. Racial differences in three major NHL subtypes: descriptive epidemiology[J]. Cancer Epidemiol, 2015, 39: 8-13. DOI:10.1016/j.canep.2014.12.001 |
| [14] |
HEROLD M, HAAS A, SROCK S, NESER S, AL-ALI K H, NEUBAUER A, et al. Rituximab added to first-line mitoxantrone, chlorambucil, and prednisolone chemotherapy followed by interferon maintenance prolongs survival in patients with advanced follicular lymphoma: an East German Study Group Hematology and Oncology Study[J]. J Clin Oncol, 2007, 25: 1986-1992. DOI:10.1200/JCO.2006.06.4618 |
| [15] |
BACHY E, MAURER M J, HABERMANN T M, GELAS-DORE B, MAUCORT-BOULCH D, ESTELL J A, et al. A simplified scoring system in de novo follicular lymphoma treated initially with immunochemotherapy[J]. Blood, 2018, 132: 49-58. |
| [16] |
ZHOU Y, QIN Y, HE X, LIU P, YANG J, ZHOU L, et al. Long-term survival and prognostic analysis of advanced stage follicular lymphoma in the rituximab era: a China single-center retrospective study[J]. Asia Pac J Clin Oncol, 2021, 17: 289-299. DOI:10.1111/ajco.13463 |
| [17] |
BUSKE C, HOSTER E, DREYLING M, HASFORD J, UNTERHALT M, HIDDEMANN W. The follicular lymphoma international prognostic index (FLIPI) separates high-risk from intermediate- or low-risk patients with advanced-stage follicular lymphoma treated front-line with rituximab and the combination of cyclophosphamide, doxorubicin, vincristine, and prednisone (R-CHOP) with respect to treatment outcome[J]. Blood, 2006, 108: 1504-1508. |
| [18] |
王楠, 许彭鹏, 王黎, 程澍, 赵维莅, 孙慧平. 利妥昔单抗联合化疗治疗229例滤泡性淋巴瘤患者的预后研究[J]. 中华血液学杂志, 2019, 40: 46-51. DOI:10.3760/cma.j.issn.0253-2727.2019.01.009 |
| [19] |
许彭鹏, 钱樱, 陈秋生, 李良群, 张莉, 赵维莅. 滤泡性淋巴瘤国际预后指数2在利妥昔单克隆抗体维持治疗滤泡性淋巴瘤患者中的预后意义[J]. 中国实验血液学杂志, 2017, 25: 426-430. |
| [20] |
YAN Y, LV R, XIONG W, LI Z, WANG Y, YU Y, et al. Subtype distribution, clinical features, and survival in B-cell chronic lymphoproliferative disorders in china: a review of 1592 cases[J/OL]. Clin Lymphoma Myeloma Leuk, 2020, 20: e270-e283. DOI: 10.1016/j.clml.2019.11.002.
|
| [21] |
FEDERICO M, BELLEI M, MARCHESELLI L, LUMINARI S, LOPEZ-GUILLERMO A, VITOLO U, et al. Follicular lymphoma international prognostic index 2:a new prognostic index for follicular lymphoma developed by the international follicular lymphoma prognostic factor project[J]. J Clin Oncol, 2009, 27: 4555-4562. DOI:10.1200/JCO.2008.21.3991 |
 2021, Vol. 42
2021, Vol. 42


