肝癌是常见的恶性肿瘤之一,全球死亡率高居肿瘤死亡的第4位,其中中国肝癌的发病人数和死亡人数约占全球的一半[1]。肝癌具有高转移及高复发的特点,治疗预后效果较差,严重影响人们的生命健康[2-3]。肝癌的危险因素主要有病毒性肝炎、酒精性肝炎和非酒精性脂肪肝等。肝细胞癌是肝癌中最常见的病理类型,约占肝癌的80% [4]。因此,研究肝细胞癌发生、发展及预后生存的新靶点和生物标志物具有重要意义。性别决定区Y框4(sex-determining region Y-box 4, SOX4)是转录调控因子SOX家族的一员,参与胚胎发育、细胞生长及基因转录调控等过程[5]。近年研究发现,SOX4基因的异常表达与肿瘤的发生、侵袭和转移密切相关,如沉默SOX4基因可以抑制胃癌细胞和肝癌细胞的增殖与转移,SOX4基因通过上皮间质转化促进肺癌细胞的增殖与转移[6-8]。此外,也有研究表明SOX4可以作为前列腺癌的预后标志物[9]。目前,SOX4基因与肝细胞癌的临床病理特征、复发及患者预后之间的关系尚不明确。本研究通过生物信息学方法分析、挖掘肿瘤基因公共数据库,评价SOX4基因在肝细胞癌中的表达变化及与肝细胞癌临床病理特征之间的关系,分析SOX4基因表达对肝细胞癌患者的总生存期和复发生存期的预后价值,并通过基因富集分析探讨SOX4基因在肝细胞癌发生、发展中可能的作用机制,为肝细胞癌的诊疗和预后判断提供参考。
1 资料和方法 1.1 数据来源与处理从基因表达汇编(Gene Expression Omnibus,GEO)数据库中检索肝细胞癌的基因表达数据,其中GSE14520数据集包含完整的肝细胞癌基因表达谱和临床预后资料(包括221例肝细胞癌组织和220例癌旁组织),采用R 3.6.3软件limma包对芯片数据进行标准化处理。检索美国癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库,获取肝细胞癌患者的mRNA表达谱及相应的临床信息(包括374例肝细胞癌组织和50例癌旁组织)。下载上述数据并提取SOX4基因的表达水平和临床信息用于后续分析。此外,检索人类蛋白质图谱(the Human Protein Atlas,HPA)数据库中有关SOX4蛋白的免疫组织化学染色结果[10],用于分析SOX4蛋白在正常肝组织和肝细胞癌组织间的表达差异。
1.2 SOX4基因表达与肝细胞癌临床病理特征的关系分别以肿瘤分期和肿瘤大小为分类变量对GSE14520数据集进行分析,研究SOX4基因表达与肝细胞癌临床病理特征之间的关系。
1.3 SOX4基因表达对肝细胞癌患者总生存期和无复发生存期的预后价值用R 3.6.3软件survminer包计算SOX4基因表达水平的临界值,并将患者分为SOX4高表达组和SOX4低表达组,采用Kaplan-Meier方法绘制生存曲线,用log-rank检验判断生存差异。由于肝细胞癌患者具有较强的异质性,采用亚组分析进一步评价SOX4基因的表达在肝细胞癌不同分期中的预后意义。此外,通过单因素和多因素Cox回归分析验证SOX4基因表达对肝细胞癌患者的独立预后价值。
1.4 SOX4基因相关的生物学过程和信号通路富集分析使用基因集富集分析(Gene Set Enrichment Analysis,GSEA)软件对SOX4基因高表达和低表达数据集进行相关的生物学过程和信号通路分析,富集的数据库为基因本体(Gene Ontology,GO;c5.go.bp.v7.2)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG;c2.cp.kegg.v7.2)数据库[11-12],显著富集基因组的筛选标准为P < 0.05。
1.5 统计学处理应用R 3.6.3软件进行统计学分析。服从正态分布的计量资料以x±s表示,两组间的比较采用独立样本t检验。绘制ROC曲线评估SOX4基因诊断肝细胞癌的价值。用Kaplan-Meier法绘制生存曲线,组间差异比较采用log-rank检验。检验水准(α)为0.05。
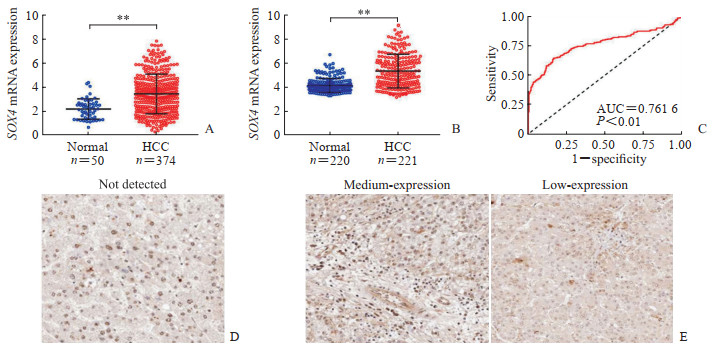
2 结果 2.1 SOX4在肝细胞癌组织中的表达检索TCGA数据库中SOX4 mRNA的表达水平,结果显示肝细胞癌组织中SOX4 mRNA表达水平高于癌旁组织(P < 0.01,图 1A)。检索GSE14520数据集中SOX4 mRNA的表达水平,结果也表明SOX4 mRNA在肝细胞癌组织中的表达上调(P < 0.01,图 1B)。在GSE14520数据集中,SOX4基因表达水平区分肝细胞癌与癌旁组织的ROC曲线分析结果显示AUC为0.761 6(图 1C)。HPA数据库中SOX4蛋白的免疫组织化学染色结果显示SOX4蛋白在3例正常肝脏组织中未检测出(图 1D);在12例肝细胞癌组织中,2例未检测出、4例为低水平表达、6例为中水平表达(图 1E),表明肝细胞癌组织中SOX4蛋白免疫反应阳性强于正常组织。
|
图 1 SOX4在肝细胞癌组织中的表达 Fig 1 Expression of SOX4 in HCC tissues A: Expression level of SOX4 mRNA in the TCGA HCC cohort (**P < 0.01. x±s); B: Expression level of SOX4 mRNA in the GSE14520 HCC cohort (**P < 0.01. x±s); C: The ROC curve of SOX4 in the GSE14520 HCC cohort; D: IHC staining of SOX4 in the normal liver tissues (50×); E: IHC staining of SOX4 in the HCC tissues (50×). SOX4: Sex-determining region Y-box 4; HCC: Hepatocellular carcinoma; AUC: Area under curve; TCGA: The Cancer Genome Atlas; ROC: Receiver operating characteristic; IHC: Immunohistochemistry. |
2.2 SOX4基因表达与肝细胞癌临床病理特征的关系
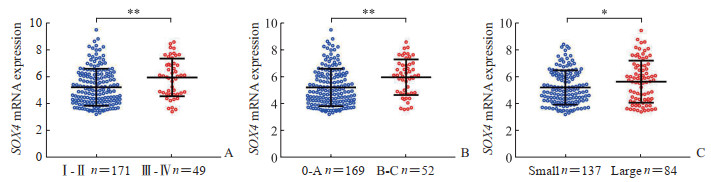
如图 2所示,美国癌症联合委员会(American Joint Committee on Cancer,AJCC)TNM分期Ⅲ~Ⅳ期肝细胞癌组织中SOX4 mRNA的表达高于Ⅰ~Ⅱ期(P < 0.01),巴塞罗那临床肝癌(Barcelona Clinic Liver Cancer,BCLC)分期B~C期肝细胞癌组织中SOX4 mRNA的表达高于0~A期(P < 0.01),大肿瘤的SOX4 mRNA表达高于小肿瘤(P < 0.05)。上述结果表明SOX4 mRNA表达与肝细胞癌的肿瘤分期和肿瘤大小有关,其可能是促进肝细胞癌发生、发展的关键基因。
|
图 2 SOX4基因在肝细胞癌不同临床病理特征中的表达(基于GSE14520数据集) Fig 2 Expression of SOX4 in HCC with different clinicopathological features (based on GSE14520 dataset) A: Expression of SOX4 mRNA in HCC with different AJCC TNM stages; B: Expression of SOX4 mRNA in HCC with different BCLC stages; C: Expression of SOX4 mRNA in HCC with different tumor sizes. *P < 0.05, **P < 0.01. x±s. SOX4: Sex-determining region Y-box 4; HCC: Hepatocellular carcinoma; AJCC: American Joint Committee on Cancer; BCLC: Barcelona Clinic Liver Cancer. |
2.3 SOX4基因表达对肝细胞癌患者总生存期和无复发生存期的预后价值
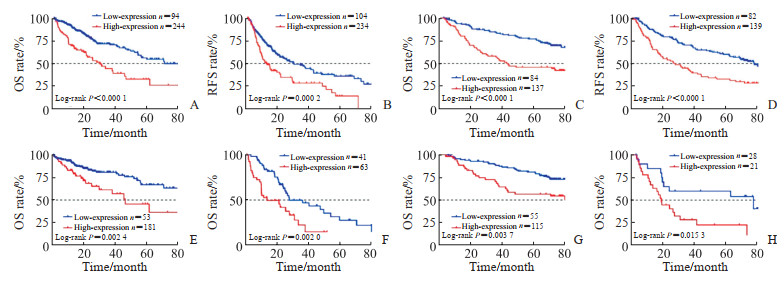
如图 3A、3B所示,在TCGA数据库中,SOX4低表达组总生存期中位时间为71.03个月,SOX4高表达组总生存期中位时间为29.97个月,差异有统计学意义(χ2=22.66,P < 0.000 1);SOX4低表达组无复发生存期中位时间为30.4个月,SOX4高表达组无复发生存期中位时间为12.87个月,差异有统计学意义(χ2=14.24,P=0.000 2)。GSE14520数据集也表明SOX4低表达组患者具有良好的预后,生存时间更长(图 3C、3D)。亚组分析结果(图 3E~3H)显示,在TCGA数据库和GSE14520数据集AJCC TNMⅠ~Ⅱ和Ⅲ~Ⅳ期肝细胞癌中,SOX4低表达组患者生存预后均好于SOX4高表达组。上述结果提示SOX4基因可以作为肝细胞癌总生存期和无复发生存期的预后生物标志物。
|
图 3 高、低表达SOX4的肝细胞癌患者总生存期和无复发生存期的Kaplan-Meier生存曲线 Fig 3 Kaplan-Meier survival curves of HCC patients with high- or low-expression of SOX4 for OS and RFS A: Survival analysis of SOX4 for OS in the TCGA HCC cohort; B: Survival analysis of SOX4 for RFS in the TCGA HCC cohort; C: Survival analysis of SOX4 for OS in the GSE14520 HCC cohort; D: Survival analysis of SOX4 for RFS in the GSE14520 HCC cohort; E: Survival analysis of SOX4 for OS based on AJCC TNM stage Ⅰ-Ⅱ in the TCGA HCC cohort; F: Survival analysis of SOX4 for OS based on AJCC TNM stage Ⅲ-Ⅳ in the TCGA HCC cohort; G: Survival analysis of SOX4 for OS based on AJCC TNM stage Ⅰ-Ⅱ in the GSE14520 HCC cohort; H: Survival analysis of SOX4 for OS based on AJCC TNM stage Ⅲ-Ⅳ in the GSE14520 HCC cohort. SOX4: Sex-determining region Y-box 4; HCC: Hepatocellular carcinoma; OS: Overall survival; RFS: Recurrence-free survival; TCGA: The Cancer Genome Atlas; AJCC: American Joint Committee on Cancer. |
2.4 SOX4基因表达对肝细胞癌患者预后价值的单因素和多因素Cox回归分析
如表 1所示,在GSE14520数据集中,单因素Cox回归分析结果显示肿瘤大小、是否肝硬化、甲胎蛋白(alpha-fetoprotein,AFP)水平、AJCC TNM分期和SOX4基因表达水平与肝细胞癌患者预后有关(P均 < 0.05);多因素Cox回归分析结果显示是否为多发性肿瘤、是否肝硬化和SOX4基因表达水平是肝细胞癌患者的独立预后因素(P均 < 0.05)。
|
|
表 1 SOX4基因表达对肝细胞癌患者预后价值的Cox回归分析(基于GSE14520数据集) Tab 1 Cox regression analyses of prognostic value of SOX4 expression in patients with HCC (based on GSE14520 dataset) |
2.5 SOX4基因相关的生物学过程和信号通路
结果如图 4A所示,在肝细胞癌中SOX4基因涉及的生物学过程主要有胞质分裂、DNA复制、染色体同源重组、肌醇需求酶1(inositol-requiring enzyme 1,IRE1)介导的未折叠蛋白反应、有丝分裂细胞周期中阻滞和自噬体组装调节等。如图 4B所示,SOX4基因相关的信号通路主要有表皮生长因子受体(epidermal growth factor receptor,EGFR)信号通路、酪氨酸激酶受体2(Erb-B2 receptor tyrosine kinase 2,ERBB2)信号通路、肿瘤蛋白p53(tumor protein p53,TP53)活性调节信号通路、肿瘤中Wnt信号通路、未折叠蛋白反应、血管内皮生长因子A(vascular endothelial growth factor A,VEGF-A)信号通路等。

|
图 4 肝细胞癌中SOX4基因的GSEA分析 Fig 4 GSEA analysis of SOX4 in HCC A: GO biological process of SOX4 in HCC; B: KEGG signaling pathway of SOX4 in HCC. SOX4: Sex-determining region Y-box 4; GSEA: Gene Set Enrichment Analysis; HCC: Hepatocellular carcinoma; GO: Gene Ontology; KEGG: Kyoto Encyclopedia of Genes and Genomes; IRE1: Inositol-requiring enzyme 1; EGFR: Epidermal growth factor receptor; ERBB2: Erb-B2 receptor tyrosine kinase 2; TP53: Tumor protein p53; VEGF-A: Vascular endothelial growth factor A. |
3 讨论
近年来,虽然肝细胞癌的治疗药物和技术方法取得了很大进步,但是其5年生存率和预后质量仍然较低,复发和转移是主要原因[2],因此寻找有效的生物标志物和药物治疗靶点是提高肝细胞癌预后水平的关键。SOX家族是一类重要的转录因子,广泛参与多种组织器官的发生发育过程。SOX4基因定位于第6号染色体,与肿瘤的发生、发展关系密切[13]。已有研究发现,SOX4在乳腺癌中的表达水平明显高于乳腺癌癌旁组织,且SOX4表达水平的升高与乳腺癌患者的不良预后显著相关[14]。研究报道SOX4在非小细胞肺癌组织中的表达水平明显高于正常组织,SOX4高表达患者的生存期短于低表达患者[15]。最近研究发现,沉默SOX4基因表达可以抑制肝细胞癌的侵袭与增殖能力[6],然而SOX4基因与肝细胞癌的临床病理特征及预后关系并不明确,其在肝细胞癌中的作用机制也不清楚。本研究采用生物信息学方法研究SOX4基因与肝细胞癌临床病理特征的关系,分析SOX4基因表达与肝细胞癌总生存期和无复发生存期的关系,探索SOX4基因在肝细胞癌发生、发展中的作用机制。
本研究结果表明,在TCGA数据库和GSE14520数据集中,SOX4基因在肝细胞癌组织中高表达,并且HPA数据库中肝细胞癌组织SOX4蛋白的免疫组织化学染色数据也证实了这一结果。通过分析SOX4基因表达与肝细胞癌临床病理特征的关系发现,AJCC TNM分期和BCLC分期越差的肝细胞癌组织中SOX4表达水平越高,同时SOX4基因表达水平与肿瘤大小有关,大肝癌中SOX4基因表达水平高于小肝癌。SOX4基因表达在TCGA数据库和GSE14520数据集中的预后价值分析表明,SOX4低表达患者的术后总生存期和术后肿瘤无复发生存期均长于高表达者。在不同的肝细胞癌分期中,SOX4基因均表现出相同的预后趋势。多因素Cox回归分析结果表明,SOX4基因表达水平是肝细胞癌患者的独立预后因素。通过GSEA分析发现肝细胞癌中SOX4基因涉及的生物学过程主要有胞质分裂、DNA复制、染色体同源重组、IRE1介导的未折叠蛋白反应、有丝分裂细胞周期阻滞和自噬体组装调节等,SOX4基因相关的信号通路主要有EGFR、ERBB2、TP53活性调节、肿瘤中Wnt信号通路、未折叠蛋白反应、VEGF-A等,但此结果仍需开展相关的分子生物学实验加以验证。
综上所述,SOX4基因在肝细胞癌组织中高表达,且与肝细胞癌的分期和肿瘤大小有关;SOX4基因低表达的患者具有较好的预后,SOX4基因表达水平是肝细胞癌患者的独立预后因素;SOX4基因可能通过调控DNA复制、IRE1介导的未折叠蛋白反应、有丝分裂细胞周期阻滞、TP53活性和Wnt信号通路等促进肝细胞癌的发生、发展。因此,下调SOX4蛋白的表达可能会抑制肝细胞癌发生、发展,达到减少肝细胞癌复发和延长肝细胞癌患者术后总生存期的目的,其有望成为肝细胞癌治疗的分子靶点和预后生物标志物。
| [1] |
YANG J D, HAINAUT P, GORES G J, AMADOU A, PLYMOTH A, ROBERTS L R. A global view of hepatocellular carcinoma: trends, risk, prevention and management[J]. Nat Rev Gastroenterol Hepatol, 2019, 16: 589-604. DOI:10.1038/s41575-019-0186-y |
| [2] |
BRUIX J, DA FONSECA L G, REIG M. Insights into the success and failure of systemic therapy for hepatocellular carcinoma[J]. Nat Rev Gastroenterol Hepatol, 2019, 16: 617-630. DOI:10.1038/s41575-019-0179-x |
| [3] |
LIU C Y, CHEN K F, CHEN P J. Treatment of liver cancer[J/OL]. Cold Spring Harb Perspect Med, 2015, 5: a021535. DOI: 10.1101/cshperspect.a021535.
|
| [4] |
FORNER A, REIG M, BRUIX J. Hepatocellular carcinoma[J]. Lancet, 2018, 391: 1301-1314. DOI:10.1016/S0140-6736(18)30010-2 |
| [5] |
JULIAN L M, MCDONALD A C, STANFORD W L. Direct reprogramming with SOX factors: masters of cell fate[J]. Curr Opin Genet Dev, 2017, 46: 24-36. DOI:10.1016/j.gde.2017.06.005 |
| [6] |
张岩, 马丽辉, 邓黎黎, 张壮苗. siRNA沉默SOX4基因抑制肝癌细胞增殖与侵袭能力[J]. 西部医学, 2020, 32: 971-975. DOI:10.3969/j.issn.1672-3511.2020.07.007 |
| [7] |
余坤, 李鸿生, 张琳玲, 杜亚茜, 李权, 王晓雄, 等. SOX4介导的EMT在肺癌中的作用及其机制[J]. 安徽医科大学学报, 2020, 55: 182-189. |
| [8] |
PENG X D, LIU G Y, PENG H X, CHEN A Q, ZHA L, WANG Z W. SOX4 contributes to TGF-β-induced epithelial-mesenchymal transition and stem cell characteristics of gastric cancer cells[J]. Genes Dis, 2018, 5: 49-61. DOI:10.1016/j.gendis.2017.12.005 |
| [9] |
WANG L, ZHANG J, YANG X, CHANG Y W, QI M, ZHOU Z, et al. SOX4 is associated with poor prognosis in prostate cancer and promotes epithelial-mesenchymal transition in vitro[J]. Prostate Cancer Prostatic Dis, 2013, 16: 301-307. DOI:10.1038/pcan.2013.25 |
| [10] |
PONTÉN F, JIRSTRÖM K, UHLEN M. The Human Protein Atlas: a tool for pathology[J]. J Pathol, 2008, 216: 387-393. DOI:10.1002/path.2440 |
| [11] |
SUBRAMANIAN A, TAMAYO P, MOOTHA V K, MUKHERJEE S, EBERT B L, GILLETTE M A, et al. Gene set enrichment analysis: a knowledge-based approach for interpreting genome-wide expression profiles[J]. Proc Natl Acad Sci USA, 2005, 102: 15545-15550. DOI:10.1073/pnas.0506580102 |
| [12] |
LIBERZON A, SUBRAMANIAN A, PINCHBACK R, THORVALDSDÓTTIR H, TAMAYO P, MESIROV J P. Molecular signatures database (MSigDB) 3.0[J]. Bioinformatics, 2011, 27: 1739-1740. DOI:10.1093/bioinformatics/btr260 |
| [13] |
HANIEH H, AHMED E A, VISHNUBALAJI R, ALAJEZ N M. SOX4:epigenetic regulation and role in tumorigenesis[J]. Semin Cancer Biol, 2020, 67: 91-104. DOI:10.1016/j.semcancer.2019.06.022 |
| [14] |
ZHANG J, XIAO C H, FENG Z B, GONG Y, SUN B H, LI Z Q, et al. SOX4 promotes the growth and metastasis of breast cancer[J/OL]. Cancer Cell Int, 2020, 20: 468. DOI: 10.1186/s12935-020-01568-2.
|
| [15] |
WANG D M, HAO T, PAN Y, QIAN X W, ZHOU D X. Increased expression of SOX4 is a biomarker for malignant status and poor prognosis in patients with non-small cell lung cancer[J]. Mol Cell Biochem, 2015, 402: 75-82. DOI:10.1007/s11010-014-2315-9 |
 2021, Vol. 42
2021, Vol. 42


