患者男,51岁,因“间断性腹痛2年余,加重伴血压升高5 d”于2019年7月27日入院。患者5 d前活动后出现腹痛,持续约5 min,伴大汗、心悸,自测血压为185/100 mmHg(1 mmHg=0.133 kPa),无头晕、视物模糊、晕厥等症状,自诉口服硝苯地平控释片后血压得到控制,休息后症状缓解。既往高血压病史4年,血压最高175/110 mmHg,不规律监测,自诉间断口服降压药物控制血压,外院肾脏超声检查未提示异常。入院后行腹部增强CT(图 1)示胰体尾部囊实性占位病变,大小约9.0 cm×8.3 cm×8.0 cm,囊腺癌可能。腹部彩色多普勒超声(图 2)检查示左侧腹区胰体尾部一囊性为主的混合回声包块,边界清,大小约7.9 cm×8.9 cm×9.3 cm。癌胚抗原9.02 ng/mL(>5 ng/mL)。肾脏、肾上腺区超声及影像学检查未见明显异常,血、尿儿茶酚胺等各项实验室检验结果均未见明显异常,入院后上述症状未发作。术前诊断:腹腔肿物待查?

|
图 1 患者腹部增强CT检查结果 腹部增强CT示胰体尾部囊实性占位病变,大小约9.0 cm×8.3 cm×8.0 cm.CT:计算机断层扫描. |
|
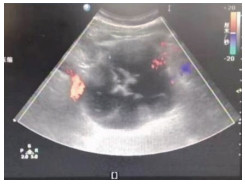
图 2 患者腹部彩色多普勒超声检查结果 腹部彩色多普勒超声检查示左侧腹区胰体尾部一囊性为主的混合回声包块,边界清,大小约7.9 cm×8.9 cm×9.3 cm. |
2019年8月1日全身麻醉下行腹腔包块探查术,顺利麻醉诱导及机械通气后,行桡动脉置管监测动脉血压,诱导期间血流动力学尚平稳。术中探查十二指肠、胰腺时,血压突然升至180/110 mmHg,探查肿块时,血压继续升至280/160 mmHg,瞬时最高血压达330/180 mmHg,立即停止一切操作,予乌拉地尔10 mg、丙泊酚30 mg静脉推注,七氟烷吸入浓度增至3% 加深麻醉。根据术中突发状况,考虑嗜铬细胞瘤可能性大。立即开放右侧颈内静脉通路,予乌拉地尔5 mg、酚妥拉明5 mg间断分次静脉推注,将硝普钠50 mg溶于5% 葡萄糖溶液500 mL(100 μg/mL)静脉滴注,血压控制在160~180/90~110 mmHg,心率维持110~125 min-1。与术者商议,决定扩大术野尽快切除肿瘤。探查过程中曾出现一过性低血压,予麻黄碱6 mg静脉推注,去甲肾上腺素备用,中心静脉通路监测中心静脉压(central venous pressure,CVP)和扩容,防止瘤体切除后低血压。维持患者血压于160/80 mmHg水平时,结扎瘤体血管,顺利切除肿瘤,术中切取大小约8 cm×7 cm×6 cm肿瘤组织送检。免疫组织化学染色结果:S-100(+)、嗜铬粒蛋白A(+)、突触素(+)、CD56(+)、细胞角蛋白(-)、结蛋白(-)、CD34(-)、D2-40(-)、Ki-67增殖指数1%,病理诊断符合嗜铬细胞瘤。肿瘤取出后,患者未见明显血压降低,予乌拉地尔泵注至手术结束。术后安全返回外科监护室,患者生命体征良好,血压正常,10 d后于2019年8月7日出院。出院后多次门诊随访,停用降压药物后血压正常,影像学检查均未提示肿瘤复发。
2 讨论 2.1 本例术前漏诊嗜铬细胞瘤的原因嗜铬细胞瘤是一种起源于肾上腺髓质的神经内分泌肿瘤,约90% 位于肾上腺髓质内,另10% 源于肾上腺区之外,如腹主动脉旁、膀胱、头颈部等,称为异位嗜铬细胞瘤[1-2]。异位的嗜铬细胞瘤容易漏诊且有恶变倾向,恶变率可达23%~36%[2-3],但若及时诊治,患者可通过手术切除而痊愈。近年来,有多起围手术期出现儿茶酚胺危象的报道[4-6]。相关文献指出,术前准备充分的嗜铬细胞瘤患者围手术期死亡事件接近于0,而术前未确诊者围手术期死亡事件的发生率可上升至43%[7]。因此,避免漏诊是降低嗜铬细胞瘤围手术期风险的重要前提。术后思考本病例,总结漏诊原因可能有以下几点。
(1)瘤体起源位置异常。术前检查均提示胰体尾部起源的囊性包块,相较于嗜铬细胞瘤约90%起源于肾上腺髓质[1-2]的特点来讲,本例胰体尾部的囊性包块可能更易倾向于诊断为胰腺肿瘤或囊肿。(2)患者术前症状不明显,缺乏特异性。根据病史,患者于就诊前5 d出现活动后腹痛,持续约5 min,伴大汗、心悸,自测血压185/100 mmHg,除此之外无其他症状,口服降压药物及休息后症状缓解。由于嗜铬细胞瘤临床表现差异较大,因此上述症状不具备特异性,在问诊欠深入时,易被认为是剧烈运动后不适引起的腹痛、心悸、大汗等症状。(3)既往及此次入院检查结果未见异常。患者自诉既往肾脏超声检查未提示明显异常,入院后腹部增强CT、彩色多普勒超声检查提示胰体尾部占位,而肾上腺区超声及影像学检查则未见占位病变,血、尿儿茶酚胺检验结果均未见明显异常。嗜铬细胞瘤表现为阵发性高血压者,仅在发作后血、尿儿茶酚胺水平高于正常,本例患者入院后未再次发作,未能收集到发作后标本获取正确的诊断依据,并且本例不符合嗜铬细胞瘤常规起源于肾上腺区的特点,故进一步加大了诊断难度。
2.2 避免漏诊措施有文献指出,约8%的嗜铬细胞瘤患者无症状[8],通常是在影像学检查时偶然发现,这种情况下血、尿儿茶酚胺诊断特异性较差,故较易漏诊,异位起源者更是如此,如本例患者。术前访视应充分询问病史,并与手术医师密切沟通,同时拓宽临床思维,除头痛、心悸、出汗等常见表现外,发现胸腹痛、乏力、面色苍白等不典型表现伴近期血压控制不佳者应联想到该病可能。一旦怀疑,可行血、尿儿茶酚胺水平测定及肾上腺区CT、MRI、超声检查等进行排查,必要时扩大范围,同时结合生化检查、临床表现综合分析,最大程度避免漏诊。
2.3 对术前未确诊的嗜铬细胞瘤的处理 2.3.1 继续手术未确诊的嗜铬细胞瘤患者术前通常无明显的血压升高及症状,或既往高血压控制良好,并未出现血压急剧升高,理论上推断可能该类患者的瘤体平时释放的儿茶酚胺量少,甚至不释放。因此该类患者血管收缩和低容量的状态可能并不明显,术中及时应用α-受体阻滞剂、钙通道受体阻滞剂等可对抗瘤体瞬间释放的儿茶酚胺。因此在患者术前一般情况良好,术中应对措施完备的情况下可继续手术。除上述原因外,本例术中瞬时最高血压达330/180 mmHg,病情凶险,考虑到异位嗜铬细胞瘤恶变率较高,暂停手术可能会延误病情,不利于患者预后,故决定继续手术。
2.3.2 暂停手术术中对瘤体的刺激会引起儿茶酚胺的大量释放,导致血管极度收缩,诱发高血压危象。极度紊乱的循环可显著加重心肌耗氧,进而诱发急性左心衰竭、心律失常、心肌梗死,甚至脑出血[9]。据报道,相比于术前未确诊者围手术期高达43%的死亡率,术前接受α-受体阻滞剂准备的确诊嗜铬细胞瘤患者的死亡率显著降低(3%)[7]。因此术中突发高血压危象时,麻醉医师应结合患者一般及术中情况全面评估靶器官功能,当患者心肺功能较差,或出现血流动力学紊乱、心力衰竭、心律失常、肾功能衰竭等不易纠正时,应及时停止手术,避免在未充分术前准备的情况下贸然切除瘤体,增加术中风险。
2.4 术中未确诊嗜铬细胞瘤突发高血压危象的处理术中一旦确认嗜铬细胞瘤可能性大,应迅速采取针对其生理学特点的处理方案:(1)暂停与刺激瘤体相关的一切操作;(2)迅速给予乌拉地尔、酚妥拉明等降压药物静脉推注;(3)建立包括中心静脉在内至少2条静脉通路;(4)利多卡因、艾司洛尔等抗心律失常药物和除颤仪备用,以应对血流动力学急剧改变。
切除瘤体前,麻醉医师应持续监测患者生命体征,与术者保持密切沟通,确保术者在结扎及切除瘤体前控制血压相对平稳,术者在轻柔操作的前提下尽快分离并切除肿瘤。但需注意:(1)探查或结扎瘤体血管时,血压常突然上升,可提前加深麻醉,或予硝普钠等药物控制血压;(2)经中心静脉通路监测CVP,在其指导下及时补液扩容,同时配置去甲肾上腺素、麻黄碱等血管活性药物备用,预防瘤体切除后的严重低血压;(3)瘤体切除过程中需注意术野渗血量,以调整血压水平及补液速度。
当结扎肿瘤周围血管和瘤体切除后,儿茶酚胺释放水平急剧减少,同时由于长期血管收缩造成的低血容量状态,可共同导致严重低血压。因此,应密切关注血压有无剧降,可提前停止降压措施,予补液扩容,必要时应用去甲肾上腺素静脉滴注迅速升压,待血压维持稳定后逐渐停用。在本例中,瘤体切除后血压并无明显下降,考虑可能与以下因素有关:(1)瘤体本身可能释放儿茶酚胺较少,引起的血管收缩和低容量状态并不明显,机体容量相对充足;(2)术前未长期予α-受体阻滞剂术前准备,使受体敏感性下调;(3)术中及时的扩容和良好的麻醉管理。
相比于一般内科急诊抢救,术中发现的未确诊嗜铬细胞瘤可通过手术切除病灶,而对于不具备手术条件的病房患者,通常予控制性降压,适当补充容量,择期手术切除。其次,全身麻醉下的患者血压更便于管理,除常用降压药物外,丙泊酚、艾司洛尔等也可用于血压及心率的调控。此外,去甲肾上腺素、麻黄碱等升压药物以及抗心律失常药物和除颤仪的准备也尤为重要,以应对循环急剧紊乱的情况,从而保证瘤体切除前后的血流动力学平稳。总之,无论是何种情况,抢救设备和血管活性药物均应准备充分,有创动脉压和中心静脉通路的建立有助于实时指导控制性降压及补液,为突发情况的抢救提供有力支持。
| [1] |
ANDERSON N E, CHUNG K, WILLOUGHBY E, CROXSON M S. Neurological manifestations of phaeochromocytomas and secretory paragangliomas: a reappraisal[J]. J Neurol Neurosurg Psychiatry, 2013, 84: 452-457. DOI:10.1136/jnnp-2012-303028 |
| [2] |
BONATI L, RUBINI P, GUARESCHI C. [Diagnosis and treatment of pheochromocytoma][J]. Minerva Chir, 2000, 55: 333-340. |
| [3] |
CHEN H, SIPPEL R S, O'DORISIO M S, VINIK A I, LLOYD R V, PACAK K, et al. The North American Neuroendocrine Tumor Society consensus guideline for the diagnosis and management of neuroendocrine tumors: pheochromocytoma, paraganglioma, and medullary thyroid cancer[J]. Pancreas, 2010, 39: 775-783. DOI:10.1097/MPA.0b013e3181ebb4f0 |
| [4] |
KOHNO M, NAGAMINE Y, GOTO T. [A case of undiagnosed extra-adrenal pheochromocytoma in an adult patient with single ventricle circulation after the bidirectional Glenn operation][J]. Masui, 2015, 64: 985-988. |
| [5] |
RAMANI N S, STOPPACHER R, MORANI A C, CATANESE C. Undiagnosed pheochromocytoma simulating malignant hyperthermia[J]. Am J Forensic Med Pathol, 2017, 38: 262-265. DOI:10.1097/PAF.0000000000000326 |
| [6] |
SONNTAGBAUER M, KOCH A, STROUHAL U, ZACHAROWSKI K, WEBER C F. Catecholamine crisis during induction of general anesthesia: a case report[J]. Anaesthesist, 2018, 67: 209-215. DOI:10.1007/s00101-018-0409-6 |
| [7] |
JIANG C S, ZHAO J G, SUN L, CAI B. A case report of rare ectopic pheochromocytoma adjacent to pancreas[J/OL]. Medicine (Baltimore), 2020, 99: e20858. DOI: 10.1097/MD.0000000000020858.
|
| [8] |
KOTA S K, KOTA S K, PANDA S, MODI K D. Pheochromocytoma: an uncommon presentation of an asymptomatic and biochemically silent adrenal incidentaloma[J]. Malays J Med Sci, 2012, 19: 86-91. |
| [9] |
PRYS-ROBERTS C. Phaeochromocytoma-recent progress in its management[J]. Br J Anaesth, 2000, 85: 44-57. DOI:10.1093/bja/85.1.44 |
 2021, Vol. 42
2021, Vol. 42


