2. 海军军医大学(第二军医大学)长征医院胃肠外科, 上海 200003
2. Department of Gastrointestinal Surgery, Changzheng Hospital, Naval Medical University(Second Military Medical University), Shanghai 200003, China
胃癌是全球癌症相关死亡人数中排第4位的肿瘤[1]。胃癌的预后很差,其5年总生存率仅为25%~31%[2-3]。晚期胃癌患者术后复发和转移率高,部分患者仅采取手术治疗并不能获得令人满意的疗效[4]。将手术与化疗结合的治疗策略已成为当前的临床治疗共识[5]。新辅助化疗(neoadjuvant chemotherapy,NAT)作为围手术期治疗的重要组成部分,在临床上具有广泛的应用,但在不同的患者之间存在明显的个体差异,且不同时期胃癌患者的临床疗效也存在较大差异[6-7]。本研究通过回顾性分析我院收治的进展期胃癌患者资料,构建了预测NAT疗效的列线图模型,现报告如下。
1 资料和方法 1.1 临床资料回顾性分析我院2010年2月至2016年4月收治的接受手术治疗的进展期胃癌患者的临床资料,严格按照下述纳入标准及排除标准筛选出病历资料齐全、诊疗记录详细、相关检查指标完整的256例患者,包括NAT组128例和基本资料匹配的对照组(进行手术治疗但未接受NAT)128例。病例纳入标准[8]:(1)组织病理学检查诊断为胃癌,并通过CT、超声内镜检查评估为Ⅱ~Ⅲ期;(2)年龄为18~75岁;(3)WHO体能状态评分为0或1分;(4)5年内无其他原发性肿瘤。NAT组病例还需满足接受NAT后行D2胃癌根治术且活检淋巴结个数≥16个。排除标准:(1)既往因其他肿瘤接受过放射治疗和/或化学治疗;(2)实验室、影像学及病理学检查资料不完善者;(3)手术期间因出现并发症死亡、随访时间不超过3个月的患者。本研究经我院医学伦理委员会审批。
1.2 围手术期SOX化学治疗方案SOX化学治疗方案为第1天行静脉滴注奥沙利铂130 mg/m2,第1~14天每天分2次早晚餐后口服替吉奥80 mg/m2,每3周为1个周期,重复1次[9]。对于需要接受术前NAT的患者,为患者提供2~6个周期的SOX方案治疗,并根据有效性和患者耐受性调整剂量或治疗周期。根据原发肿瘤大小及内镜、超声内镜检查和增强CT三维重建显示的肿瘤变化情况,评估肿瘤对NAT的反应。预计可达到R0切除时行胃癌根治术,术后再进行2~6个周期的相同方案化学治疗。对于不需要接受术前NAT的患者,如无明显禁忌证,术后行6~8个周期的SOX方案治疗。建议共进行6~8个周期的化学治疗,术前和术后化学治疗周期为计划总周期数。
1.3 研究指标本研究分析的指标包括化学治疗前患者的年龄、性别、吸烟史、饮酒史、肿瘤大小、肿瘤部位、组织学类型、Borrmann分型、中性粒细胞与淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)、血小板与淋巴细胞比值(platelet-to-lymphocyte ratio,PLR)、癌胚抗原(carcinoembryonic antigen,CEA)、CA 19-9、临床T分期和临床N分期。肿瘤大小、Borrmann分型和组织学类型分别由2名内镜医师(副主任医师、主治医师各1名)、2名放射科医师(均为副主任医师)和3名病理学家(副主任医师2名、主治医师1名)独立严格评估,诊断有争议时,通过内部讨论达成一致。临床T分期和N分期,根据第8版美国癌症联合委员会原发性肿瘤标准[10]进行评估。
1.4 随访第1~2年每3个月随访1次,第3年开始每6个月随访1次。随访方式为医师面对面访问或电话联系,如未能联系到患者,则通过联系患者家属或社区医师获取相关信息。每例患者建立随访日志,记录患者出院后的预后情况。根据随访结果,计算患者的总生存期。总生存期定义为确诊至患者死亡或随访结束时间。随访截止日期为2021年4月30日。
1.5 统计学处理应用SPSS 26.0和R 3.6.2软件进行统计学分析。计数资料以例数和百分数表示,两组间比较采用χ2检验。采用寿命表法对患者的生存时间进行分析,计算中位生存时间,绘制生存曲线并进行log-rank检验。采用单因素及多因素Cox比例风险回归模型分析预后的影响因素,并基于多因素分析筛选出的变量采用列线图建立预测模型,并对模型进行验证。检验水准(α)为0.05。
2 结果 2.1 两组患者基线资料比较NAT组胃癌患者128例,其中男88例、女40例,年龄为20~75岁。对照组胃癌患者128例,其中男85例、女43例,年龄为19~74岁。两组患者的基本资料比较差异均无统计学意义(P均>0.05),见表 1。
|
|
表 1 两组进展期胃癌患者基线资料比较 Tab 1 Comparison of baseline data of advanced gastric cancer patients in 2 groups |
2.2 两组患者总生存情况比较
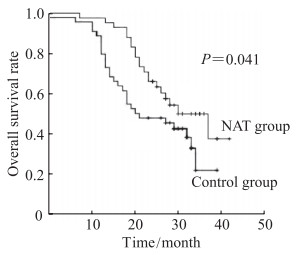
所有患者均获得定期随访,随访结果生成的总生存曲线如图 1所示,NAT组患者的中位生存时间为31个月,对照组为21个月,两组比较差异有统计学意义(P < 0.05)。
|
图 1 NAT组与对照组进展期胃癌患者的生存曲线比较 Fig 1 Comparison of survival curves of advanced gastric cancer patients between NAT group and control group NAT: Neoadjuvant chemotherapy. |
2.3 NAT疗效的影响因素分析
单因素Cox比例风险回归模型分析显示,性别、年龄、肿瘤位置、肿瘤大小、Borrmann分型、CEA、CA 19-9、PLR、临床T分期、临床N分期、是否有淋巴结转移及是否接受SOX方案NAT是胃癌患者术后总生存期的影响因素(P均 < 0.05)。多因素Cox比例风险回归模型分析显示,年龄、肿瘤位置、肿瘤大小、CEA、CA 19-9、临床T分期、临床N分期、淋巴结转移及未接受SOX方案NAT是胃癌患者预后的独立危险因素(P均 < 0.05)。见表 2。
|
|
表 2 进展期胃癌患者总生存期影响因素的单因素和多因素Cox比例风险回归分析及列线图预测模型得分 Tab 2 Univariate and multivariate Cox proportional hazard regression analyses of influencing factors of overall survival in advanced gastric cancer patients and nomogram points |
2.4 NAT疗效的列线图预测模型
基于多因素Cox比例风险回归模型分析结果,生成了胃癌患者预后的列线图预测模型(图 2),各变量得分见表 2。经内部验证该模型符合率良好,有较好的区分度和准确度。通过比较预测模型与TNM分期对预后的预测结果发现,列线图预测模型具有较高的灵敏度和特异度(图 3)。

|
图 2 进展期胃癌患者术后NAT预后预测列线图 Fig 2 Nomogram for predicting prognosis of postoperative NAT in advanced gastric cancer patients NAT: Neoadjuvant chemotherapy; CA 19-9: Carbohydrate antigen 19-9; CEA: Carcinoembryonic antigen. |

|
图 3 进展期胃癌患者预后的列线图预测模型与TNM分期的预测价值曲线 Fig 3 Predictive value curves of nomogram prediction model versus TNM stage for prognosis of advanced gastric cancer patients |
3 讨论
胃癌是一种分子和表型高度异质性的肿瘤[11],目前胃癌的临床诊断主要依靠内镜活检后进行的组织病理学诊断,并使用CT、超声内镜、正电子发射断层显像和腹腔镜检查进行分期[12-13]。早期胃癌的治疗方法主要是内镜切除术,非早期、可手术的胃癌常采用手术治疗,术中应包含D2淋巴结清扫(包括胃周围肠系膜和腹腔动脉分支的淋巴结站)[13]。导致胃癌发病的因素主要有幽门螺杆菌感染、年龄、高盐摄入及低水果和蔬菜摄入等[14],其中幽门螺杆菌感染是报道较多的危险因素[15]。减少高盐食物的摄入,大量摄入新鲜水果和蔬菜有利于抑制幽门螺杆菌生成,降低转化成胃癌的风险[16]。另外约有10%的胃癌病例表现出家族聚集性,1%~3%的患者伴有遗传突变[17]。围手术期的NAT可提高Ⅱ期或更晚期肿瘤患者的生存率已成为全球共识,越来越多的研究表明术前的NAT可增加手术切除治愈肿瘤的机会[18-19]。研究表明,在可手术的胃或食管下段腺癌患者中,围手术期化学治疗可降低肿瘤大小和分期,并显著提高患者无进展生存期和总生存期[20]。NAT方案的优势是见效快、疗效好、不良反应少,目前多采用联合方案。我国常用的NAT方案包括SOX方案、XELOX方案及FLOT方案等,但尚无统一的化学治疗方案。谢兴江等[21]的一项meta分析结果显示,XELOX方案及SOX方案NAT均对进展期胃癌有效,能使患者获益。
本研究结合进展期胃癌患者治疗前常规检查指标构建预测NAT疗效的列线图预测模型。与传统的TNM分期相比,列线图预测模型显示出优越的预测性能,表明基于预处理参数的列线图预测模型可能是一种可行的、可定量的预测工具。研究表明单核细胞计数与多种恶性肿瘤患者的生存率低有关,但其潜在机制尚不清楚[22-23]。单核细胞抑制免疫系统并促进肿瘤增殖、血管生成和进展[24]。淋巴细胞在防御肿瘤细胞方面发挥着重要作用,并反映出躯体无法介导有效的细胞免疫来启动肿瘤细胞死亡[25]。目前,NAT方案的确定主要基于T和N分期,而本研究发现CEA>5 ng/mL、CA 19-9>37 U/mL、肿瘤最大径>5 cm和患者年龄>60岁等参数也可以作为NAT方案选择的附加参考值。在日本进行的JCOG1002研究数据还表明,胃癌患者的预后与淋巴结肿大、肿瘤直径>7 cm相关[26]。也有研究证实炎症和免疫相关因素对生存预测具有价值[27]。刘怡等[28]在一项纳入176例接受NAT的胃癌患者的研究中发现,化学治疗总反应率为59.7%,疾病控制率为94.3%,表明NAT治疗有效;另外该研究通过危险因素分析发现年龄、临床T分期及化学治疗前肿瘤直径是NAT有效性的独立影响因素,这一结果与本研究结果一致。
综上所述,本研究发现年龄、肿瘤大小、肿瘤部位、CEA、CA 19-9、临床T分期、临床N分期、淋巴结转移及未接受SOX治疗是影响进展期胃癌患者总生存期的危险因素,并基于这些指标成功构建了列线图预后预测工具,经验证该模型符合率良好。通过该预测模型,可以在确定治疗计划之前,向每例患者提供指示风险等级的总分,准确判断患者的预后。此外,该预测模型提供了一种可行的、可定量的、实用的预测工具来区分不同的患者风险组,有利于快速制订针对新诊断的胃癌患者的个体化治疗方案。这有助于临床医师更好地针对患者进行NAT,具有一定的应用价值。然而,本研究受限于样本量及单中心研究等因素,需要更大的样本量对列线图预测模型进行外部验证。
| [1] |
SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2020[J]. CA Cancer J Clin, 2020, 70: 7-30. DOI:10.3322/caac.21590 |
| [2] |
SMYTH E C, NILSSON M, GRABSCH H I, VAN GRIEKEN N C, LORDICK F. Gastric cancer[J]. Lancet, 2020, 396: 635-648. DOI:10.1016/S0140-6736(20)31288-5 |
| [3] |
TAKAHARI D, MIZUSAWA J, KOIZUMI W, HYODO I, BOKU N. Validation of the JCOG prognostic index in advanced gastric cancer using individual patient data from the SPIRITS and G-SOX trials[J]. Gastric Cancer, 2017, 20: 757-763. DOI:10.1007/s10120-017-0702-0 |
| [4] |
马东. SOX新辅助化疗方案联合胃癌根治术治疗进展期胃癌的临床评价[J]. 医学理论与实践, 2020, 33: 3032-3034. |
| [5] |
CHEN L, HAO Y, ZHU L, LI S, ZUO Y, ZHANG Y, et al. Monocyte to lymphocyte ratio predicts survival in patients with advanced gastric cancer undergoing neoadjuvant chemotherapy[J]. Onco Targets Ther, 2017, 10: 4007-4016. DOI:10.2147/OTT.S140118 |
| [6] |
王辉, 孟松, 李超, 姚立彬, 洪健, 邵永, 等. SOX方案新辅助化疗在进展期胃癌中的疗效[J]. 临床医学研究与实践, 2019, 4: 7-9. |
| [7] |
PAVEL M, ÖBERG K, FALCONI M, KRENNING E P, SUNDIN A, PERREN A, et al. Gastroenteropancreatic neuroendocrine neoplasms: ESMO clinical practice guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2020, 31: 844-860. DOI:10.1016/j.annonc.2020.03.304 |
| [8] |
WEI L, SUN J J, ZHANG N S, ZHENG Y, WANG X W, LV L, et al. Noncoding RNAs in gastric cancer: implications for drug resistance[J]. Mol Cancer, 2020, 19: 1-17. DOI:10.1186/s12943-019-1085-0 |
| [9] |
刘书豪, 侯新月, 张宪祥, 刘广伟, 信芳杰, 王继刚, 等. 进展期胃癌神经侵犯列线图预测模型的构建与验证[J]. 中华胃肠外科杂志, 2020, 23: 1059-1066. DOI:10.3760/cma.j.cn.441530-20200103-00004 |
| [10] |
YANG H K, JI J F, HAN S U, TERASHIMA M, LI G X, KIM H H, et al. Extensive peritoneal lavage with saline after curative gastrectomy for gastric cancer (EXPEL): a multicentre randomised controlled trial[J]. Lancet Gastroenterol Hepatol, 2021, 6: 120-127. DOI:10.1016/S2468-1253(20)30315-0 |
| [11] |
FORD A C, YUAN Y, MOAYYEDI P. Helicobacter pylori eradication therapy to prevent gastric cancer: systematic review and meta-analysis[J]. Gut, 2020, 69: 2113-2121. DOI:10.1136/gutjnl-2020-320839 |
| [12] |
陈施图. SPA和SOX方案用于进展期胃癌新辅助化疗的小样本回顾性研究[D]. 杭州: 浙江大学, 2016.
|
| [13] |
冯道夫, 何向辉, 章志翔. 进展期胃癌SOX新辅助化疗敏感性相关基因及信号通路的生物信息学分析[J]. 中国普通外科杂志, 2017, 26: 468-472. DOI:10.3978/j.issn.1005-6947.2017.04.011 |
| [14] |
CHEN T, ZHANG C G, LIU Y Q, ZHAO Y Y, LIN D Y, HU Y F, et al. A gastric cancer lncRNAs model for MSI and survival prediction based on support vector machine[J/OL]. BMC Genomics, 2019, 20: 846. DOI: 10.1186/S12864-019-6135-X.
|
| [15] |
VENERITO M, LINK A, ROKKAS T, MALFERTHEINER P. Gastric cancer-clinical and epidemiological aspects[J]. Helicobacter, 2016, 21(Suppl 1): 39-44. |
| [16] |
ZENG D, ZHOU R, YU Y, LUO Y, ZHANG J, SUN H, et al. Gene expression profiles for a prognostic immunoscore in gastric cancer[J]. Br J Surg, 2018, 105: 1338-1348. DOI:10.1002/bjs.10871 |
| [17] |
JIANG Y M, ZHANG Q, HU Y F, LI T J, YU J, ZHAO L Y, et al. ImmunoScore signature: a prognostic and predictive tool in gastric cancer[J]. Ann Surg, 2018, 267: 504-513. DOI:10.1097/SLA.0000000000002116 |
| [18] |
张守国, 孙玉宝, 陈小军, 刘栋. 进展期胃癌患者新辅助化疗效果及氟尿嘧啶水平与疗效的关系[J]. 中国肿瘤临床与康复, 2017, 24: 319-321. |
| [19] |
CHOI I J, KIM C G, LEE J Y, KIM Y I, KOOK M C, PARK B, et al. Family history of gastric cancer and Helicobacter pylori treatment[J]. N Engl J Med, 2020, 382: 427-436. DOI:10.1056/NEJMoa1909666 |
| [20] |
CUNNINGHAM D, ALLUM W H, STENNING S P, THOMPSON J N, VAN DE VELDE C J, NICOLSON M, et al. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer[J]. N Engl J Med, 2006, 355: 11-20. DOI:10.1056/NEJMoa055531 |
| [21] |
谢兴江, 彭强, 侯松林, 陈佳, 李利发, 周何, 等. SOX和XELOX在进展期胃癌新辅助化疗中疗效及不良反应差异的meta分析[J]. 医学信息, 2021, 34: 67-73. |
| [22] |
HATTA W, TSUJI Y, YOSHIO T, KAKUSHIMA N, HOTEYA S, DOYAMA H, et al. Prediction model of bleeding after endoscopic submucosal dissection for early gastric cancer: BEST-J score[J]. Gut, 2021, 70: 476-484. DOI:10.1136/gutjnl-2019-319926 |
| [23] |
王民开, 夏亚兰, 吴忠亮, 张兴发, 李强. 两种新辅助化疗方案联合手术治疗进展期胃癌的疗效比较[J]. 重庆医学, 2018, 47: 3709-3710, 3712. |
| [24] |
竺水银, 康骁弘, 汪东杰, 谢凯钢. 新辅助化疗(SOX方案)对局部进展期胃癌的疗效评估[J]. 浙江创伤外科, 2018, 23: 500-501. DOI:10.3969/j.issn.1009-7147.2018.03.041 |
| [25] |
JANG M, AN J, OH S W, LIM J Y, KIM J, CHOI J K, et al. Matrix stiffness epigenetically regulates the oncogenic activation of the Yes-associated protein in gastric cancer[J]. Nat Biomed Eng, 2021, 5: 114-123. DOI:10.1038/s41551-020-00657-x |
| [26] |
ITO S, SANO T, MIZUSAWA J, TAKAHARI D, KATAYAMA H, KATAI H, et al. A phase Ⅱ study of preoperative chemotherapy with docetaxel, cisplatin, and S-1 followed by gastrectomy with D2 plus para-aortic lymph node dissection for gastric cancer with extensive lymph node metastasis: JCOG1002[J]. Gastric Cancer, 2017, 20: 322-331. DOI:10.1007/s10120-016-0619-z |
| [27] |
LI Z, LI S, YING X, ZHANG L, SHAN F, JIA Y, et al. The clinical value and usage of inflammatory and nutritional markers in survival prediction for gastric cancer patients with neoadjuvant chemotherapy and D2 lymphadenectomy[J]. Gastric Cancer, 2020, 23: 540-549. DOI:10.1007/s10120-019-01027-6 |
| [28] |
刘怡, 张珂诚, 郗洪庆, 崔建新, 高云鹤, 梁文全, 等. 胃癌新辅助化疗疗效及影响因素分析[J]. 解放军医学院学报, 2018, 39: 117-121. DOI:10.3969/j.issn.2095-5227.2018.02.008 |
 2021, Vol. 42
2021, Vol. 42


