2. 海军905医院心血管内科, 上海 200050;
3. 宁夏医科大学基础医学院生理学教研室, 银川 750004
2. Department of Cardiovasology, No. 905 Hospital of PLA Navy, Shanghai 200050, China;
3. Department of Physiology, College of Basic Medical Sciences, Ningxia Medical University, Yinchuan 750004, Ningxia Hui Autonomous Region, China
近年来,我国冠心病的发病率呈上升趋势[1]。冠心病是以动脉粥样硬化导致的血管狭窄为主要病理过程的血管性疾病。介入治疗和冠状动脉旁路移植术有效地改善了多种复杂和危重型冠心病的临床症状[2],然而血管病变部位的再狭窄仍然是目前困扰临床的主要问题之一。在动脉粥样硬化和血管成形术后再狭窄的病理过程中,内皮细胞在压力和炎症等因素的作用下发生损伤,引起血管平滑肌细胞异常增殖并由收缩型平滑肌细胞向分泌型平滑肌细胞转变,进而导致血管壁增厚和管腔狭窄[3]。在高血压等病理状态下,血管平滑肌受到不同的剪切力也会发生表型转化,进而导致血管重塑[4-5]。探讨血管稳态和病理状态下这些细胞事件的分子机制,理解血管平滑肌细胞由收缩型向分泌型转化的分子基础,明确各类分子或药物在血管损伤性重塑中的功能和机制,能够为血管相关疾病的病理与药理学研究及潜在临床治疗靶点的发现提供重要的理论基础。
血管损伤重塑是目前血管生物学研究的新方向[4]。血管损伤重塑研究离不开动物模型,目前主要应用的血管重塑模型包括大鼠颈动脉球囊损伤模型、小鼠动脉导丝损伤模型和小鼠颈动脉结扎模型[6-8]。其中大鼠颈动脉球囊损伤模型使大鼠颈总动脉内膜剥脱和新生内膜增生导致管腔狭窄,小鼠动脉导丝损伤模型利用导丝损伤股动脉或颈总动脉内膜引起内膜增生和血管狭窄。这2种模型都建立在内膜剥落过程的基础上,与人体血管损伤重塑的病理过程存在较大差异[9]。小鼠颈动脉结扎模型通过结扎颈动脉引起动脉血管狭窄,与临床上的血管再狭窄的病理机制也不完全一致。结扎法完全阻断血流,不仅妨碍对循环血中各种细胞及骨髓来源干细胞在再狭窄形成中作用的观察,而且难以判断结扎后机械刺激所引起的分子变化对病理改变的影响。另外取材部位距离结扎位点的远近也是影响血管重塑程度评估的一个重要因素,这导致颈动脉结扎模型很难在不同小鼠间进行结扎后血管重塑程度的比较[6, 10]。
本研究将硅胶微导管套在颈总动脉上并进行结扎,使颈总动脉缩窄构建血管重塑模型,通过组织病理学观察和分子标志物检测等手段观察该方法的有效性和可行性。
1 材料和方法 1.1 实验动物12只体重约25 g、12周龄的C57BL/6品系雄性小鼠购自上海斯莱克实验动物有限责任公司[生产许可证号:SCXK(沪)2017-0005]。饲养于海军军医大学(第二军医大学)实验动物中心SPF级动物饲养室,给予小鼠每天12 h光照,使用普通饲料喂养,自由取食、饮水。本研究获得海军军医大学(第二军医大学)动物伦理委员会审批,遵守使用和爱护实验室动物的规范操作。
1.2 小鼠颈总动脉套管导致血管狭窄模型12只C57BL/6小鼠经异氟烷麻醉后取仰卧位,用胶条固定四肢。小鼠喉部用脱毛膏进行脱毛后乙醇消毒,在无菌条件下取颈正中切口,用微型手术剪沿喉中线剪开皮肤,分离皮下脂肪及组织,充分暴露左、右两侧颈总动脉。在解剖镜下,用显微镊子分离左、右两侧颈总动脉。左侧颈总动脉行缩窄术,在颈总动脉分叉下方放置7-0丝线,穿过颈总动脉;将长度为1 cm、内径为0.3 mm的硅胶微导管用微型手术剪纵向剖开并在套管一侧剪一个缺口,从缺口处套入颈总动脉,待硅胶微导管包在分离好的颈总动脉后,用7-0丝线在套管两端扎紧90%左右固定套管;待套管中间丝线扎紧套管后,再将两端丝线扎紧。整理、复位切开的组织,缝合皮肤。小鼠右侧颈总动脉为假手术对照侧,只分离颈总动脉,但不放置硅胶微导管,不进行缩窄术。于小鼠常规饲养第2周和4周时分别处死6只小鼠,其中3只用于组织学病理学观察,3只用于RNA和蛋白提取。
1.3 小鼠血管切片制作及H-E染色颈总动脉缩窄术后2周和4周,每个时间点取3只小鼠,经异氟烷麻醉后开胸暴露心脏,自心尖处灌注4%多聚甲醛溶液,待组织充分固定后剪开颈部组织,分离颈总动脉,取双侧颈总动脉,于4%多聚甲醛溶液中固定备用。血管经水冲洗清除固定液,依次用浓度递增的乙醇进行梯度脱水,二甲苯去除乙醇,使组织块透明;浸蜡2~3 h,将浸透好的样本切面向下放入含有石蜡的包埋器内,静置包埋。将石蜡包埋的组织块切片,切好的蜡带放到40 ℃左右的温水中展平,用涂有蛋白甘油附贴剂的载玻片捞片。切片依次放入二甲苯(2次,每次5~10 min)和浓度递减的乙醇中脱蜡至水,用去离子水洗净。处理好的切片放入苏木精染液染色10 min,用自来水冲洗去除多余的染液;放入酸性乙醇分化液约10 s分化,至细胞核着色较深、其他结构无色时为宜;放入自来水约20 min使苏木精蓝化,细胞核呈蓝色;经去离子水先后,放入1%伊红染液中染色约10 min,用蒸馏水洗去多余的伊红。染色完成后,将切片用浓度递增的乙醇进行梯度脱水,二甲苯透明(2次,每次约5 min),滴加1~2滴树胶封片。
1.4 免疫组织化学染色将小鼠颈总动脉石蜡切片置于二甲苯中浸泡10 min,无水乙醇中浸泡5 min,95%乙醇中浸泡5 min,70%乙醇中浸泡5 min。在沸水浴中,将切片置于0.01 mol/L枸橼酸钠缓冲液(pH 6.0)中浸泡5 min进行抗原热修复。用PBS清洗切片2次,每次5 min;用5%山羊血清封闭液室温封闭20 min。滴加增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)抗体(货号AB0051,上海Abways公司)50 μL(稀释比例1∶100),室温静置2 h;PBS清洗切片3次,每次5 min;滴加HRP标记的二抗(货号G1215-3,武汉赛维尔生物科技有限公司)50 μL,室温静置1 h;PBS清洗切片3次,每次5 min;DAB显色5~10 min,在显微镜下观察掌握染色程度;PBS冲洗10 min;苏木精复染2 min,盐酸乙醇分化液分化;自来水冲洗10 min;脱水、透明、封片。
1.5 qRT-PCR检测颈总动脉缩窄术后2周和4周,每个时间点取3只小鼠,麻醉后取两侧颈总动脉,采用TRIzol法提取总RNA。取1 μL RNA进行浓度测定后,采用反转录试剂盒(日本TOYOBO公司)进行反转录。反转录产物用去离子水稀释10倍后作为qRT-PCR的模板。qRT-PCR采用Sybgreen方法,用2×real-time qPCR Master Mix试剂盒(货号FSQ-101,日本TOYOBO公司)进行扩增反应,通过LC-480荧光定量PCR仪(瑞士Roche公司)获取目的基因的荧光信号,以GAPDH为内参,通过2-ΔΔCt法[Ct为循环阈值(cycle threshold)]计算目的基因的相对表达量。所用引物序列如下:钙调理蛋白1(calponin 1,CNN1)上游引物为5′-CTTTTCTATTTCACTGGAGCACAAT-3′,下游引物为5′-TTTACTAGCTCTGAGCCATCTCACT-3′,片段大小为167 bp;平滑肌肌动蛋白α2(actin alpha 2, smooth muscle;ACTA2)上游引物为5′-CTGACAGAGGCACCACTGAA-3′,下游引物为5′-CATCTCCAGAGTCCAGCACA-3′,片段大小为160 bp;GAPDH上游引物为5′-GGCAAATTCAA-CGGCACAGT-3′,下游引物为5′-AGATGGTGATG-GGCTTCCC-3′,片段大小为70 bp。
1.6 蛋白质印迹法检测取小鼠两侧颈总动脉组织置入RIPA裂解液中,通过液氮研磨法提取总蛋白,蛋白样品经定量后进行SDS-PAGE。电泳结束后,100 V转膜2 h将蛋白转移到PVDF膜上。将膜用5%脱脂牛奶封闭2 h后置于摇床上,与TBST稀释的一抗4 ℃孵育过夜。次日,室温下将膜用TBST清洗4次,每次8 min。将膜置于用5%脱脂牛奶稀释的HRP标记的二抗中,室温孵育2 h,室温下将膜用TBST清洗4次,每次8 min。ECL法显影,获得蛋白表达信号。所用的抗体信息如下:周期蛋白A2(cyclinA2)抗体(货号:#91500)、周期蛋白D1(cyclinD1)抗体(货号:#2922)均购自美国CST公司,PCNA抗体(货号:Ab0051)、GAPDH抗体(货号:Ab0037)和HRP标记的山羊抗兔IgG二抗(货号:Ab0101)均购自上海Abways公司。
1.7 统计学处理采用GraphPad Prism 8软件进行统计学分析。符合正态分布的计量资料以x±s表示,组间比较采用非配对t检验。检验水准(α)为0.05。
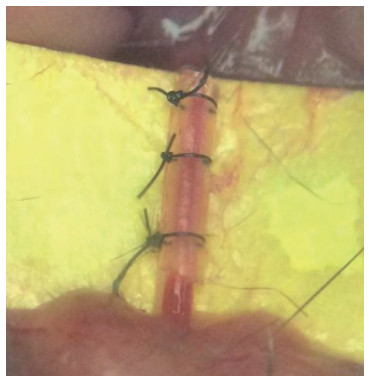
2 结果 2.1 硅胶微导管套管致小鼠颈总动脉缩窄采用自身左、右两侧颈总动脉对照的方法,一共对12只小鼠进行左侧颈总动脉硅胶微导管套管缩窄术,至取材时小鼠全部存活,无明显异常表现。套管扎紧后即刻,可见小鼠左侧颈总动脉血管管腔狭窄,但血流未被阻断(图 1)。
|
图 1 小鼠左侧颈总动脉硅胶微导管套管缩窄术(套管内径0.3 mm) Fig 1 Left common carotid artery constriction with a silicone microcatheter cannula in mice (internal diameter of 0.3 mm) |
2.2 硅胶微导管套管缩窄术后小鼠颈总动脉组织病理学变化
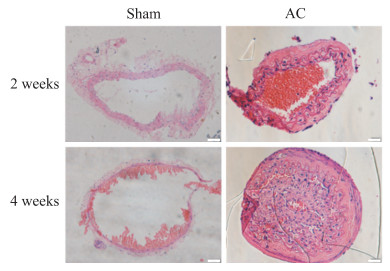
H-E染色结果(图 2)显示,术后2周时,小鼠左侧颈总动脉血管外膜组织明显增生,并伴有炎症细胞浸润,但内皮细胞仍完整地附着于血管腔表面,说明该方法可导致小鼠颈总动脉血管重塑但不破坏内皮细胞的完整性;术后4周时,血管中膜和内膜明显增生,管腔狭窄,说明随术后时间延长小鼠颈总动脉的血管重塑程度加重。
|
图 2 H-E染色观察硅胶微导管套管缩窄术后小鼠颈总动脉组织病理学变化 Fig 2 Histopathological changes of common carotid artery after cannula constriction in mice observed by H-E staining The AC of the artery caused the over-growth of the outer layer of the blood vessels 2 weeks after surgery and led to severe neointima formation 4 weeks after surgery. Scale bar=50 μm. H-E: Hematoxylin-eosin; AC: Arterial constriction. |
2.3 硅胶微导管套管缩窄术后小鼠颈总动脉血管平滑肌细胞增殖情况
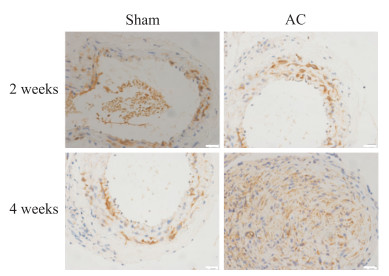
免疫组织化学染色结果(图 3)显示,套管缩窄术后2周,小鼠左侧颈总动脉外膜和中膜的平滑肌细胞的PCNA表达水平较右侧假手术组明显增高;术后第4周,缩窄血管的中膜和内膜平滑肌细胞的PCNA表达水平明显增加,说明颈总动脉套管能够促进血管平滑肌细胞增殖。
|
图 3 免疫组织化学染色检测硅胶微导管套管缩窄术后小鼠颈总动脉组织中PCNA的表达 Fig 3 Expression of PCNA in common carotid artery of mice after cannula constriction detected by immunochemical staining PCNA expression showing the proliferation of smooth muscle cells in the common carotid arteries with AC. Scale bar=20 μm. PCNA: Proliferating cell nuclear antigen; AC: Arterial constriction. |
2.4 硅胶微导管套管缩窄术后小鼠颈总动脉血管平滑肌细胞收缩型标志分子的表达
qRT-PCR检测结果显示,与仅假手术的右侧颈总动脉相比,套管缩窄术后2周和4周时,小鼠左侧颈总动脉血管平滑肌细胞收缩型标志分子CNN1、ACTA2的mRNA表达水平均降低,其中术后2周时CNN1的mRNA表达水平及术后4周时CNN1、ACTA2的mRNA表达水平与假手术组相比差异均有统计学意义(P均 < 0.01,图 4)。该结果说明在套管诱发的血管重塑过程中,血管平滑肌细胞的收缩表型受到明显抑制。

|
图 4 qRT-PCR检测硅胶微导管套管缩窄术后小鼠颈总动脉血管平滑肌细胞表型转化相关分子的表达 Fig 4 Expression of molecules related to smooth muscle phenotype switch of mouse common carotid arteries after cannula constriction detected by qRT-PCR **P < 0.01. n=3, x±s. qRT-PCR: Quantitative real-time polymerase chain reaction; ACTA2: Actin alpha 2, smooth muscle; CNN1: Calponin 1; AC: Arterial constriction. |
2.5 硅胶微导管套管缩窄术后小鼠颈总动脉增殖相关分子的表达情况
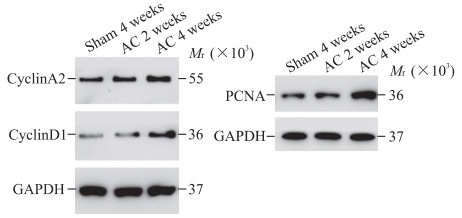
蛋白质印迹法检测结果显示,套管缩窄术后2周和4周时,小鼠左侧颈总动脉血管中周期蛋白A2、周期蛋白D1和PCNA的表达水平均升高,且这些分子的表达水平随缩窄时间的延长而升高(图 5)。
|
图 5 蛋白质印迹法检测硅胶微导管套管缩窄术后小鼠颈总动脉组织中细胞增殖相关分子的表达 Fig 5 Expression of cell proliferation related molecules in mouse common carotid arteries after cannula constriction detected by Western blotting GAPDH: Glyceraldehyde-3-phosphate dehydrogenase; PCNA: Proliferating cell nuclear antigen; AC: Arterial constriction. |
3 讨论
大血管的血管壁分为内膜、中膜和外膜三部分,是由血管平滑肌细胞、成纤维细胞等和细胞外基质通过有序排列组成的有机整体。细胞外基质蛋白交织成网状结构,为细胞行使正常的生理功能提供了一个稳定的细胞外微环境,从而共同维持血管的正常结构与生理功能。在血流剪切力、炎症或损伤的作用下,血管内膜发生损伤,血管中膜的平滑肌细胞在结构和功能会发生改变,血管平滑肌细胞由正常的收缩表型向分泌型逐渐转化,从而影响血管收缩、分泌等基本功能,进而引起或促进多种心血管疾病的发生、发展。关于平滑肌细胞如何维持正常的收缩表型、如何在疾病发生过程中发生表型转化,相关病理学基础目前知之甚少,仍是血管生物学研究的主要方向之一。探讨血管平滑肌细胞表型转化的分子机制将为血管疾病的预防和靶向治疗提供重要的理论基础[11]。
大鼠颈动脉球囊损伤模型、小鼠动脉导丝损伤模型是目前具有代表性的血管损伤模型[12]。大鼠颈动脉球囊损伤模型成功率较高,在该模型中,内皮细胞在损伤后7 d有散在覆盖,14 d时内皮呈片状覆盖,28 d时完全覆盖;损伤后7 d,内膜已开始增生,14~28 d增生最快[13-14]。在小鼠颈动脉导丝损伤模型中,术后7、14 d可见明显的炎症细胞浸润,术后14、28 d可见大量氧化损伤细胞;术后平滑肌细胞发生去分化,血管壁可检测到大量平滑肌细胞增殖[15]。既往报道显示,小鼠股动脉导丝拉伤可引起血管平滑肌的大面积死亡,从而导致股动脉发生严重损伤[16]。在股动脉发生严重损伤模型中,平滑肌细胞会由收缩型向分泌型转化。有研究表明,位于血管外膜的平滑肌细胞在动脉严重损伤后分化为平滑肌细胞并大量增殖,参与血管修复与再生[17]。
微导管损伤模型植入模型起源于日本学者在兔颈动脉上开发的血管损伤模型[18]。既往在载脂蛋白E(apolipoprotein E,ApoE)或低密度脂蛋白受体(low-density lipoprotein receptor,LDLR)基因敲除鼠中,有学者应用颈动脉套管模型研究动脉粥样硬化的病理生理过程[19-21]。这是一种由高脂和血流动力学2种因素的叠加效应所致的模型,主要用于研究血流压力对血管内膜损伤后脂质沉积的影响。本研究没有选择ApoE或LDLR基因敲除小鼠加高脂饮食的造模方法,而是选择野生型小鼠加普通饮食进行建模。目前尚未见在野生型小鼠颈动脉血管重塑中应用硅胶微导管建模的报道,我们首次尝试利用硅胶微导管套管使血管缩窄的方法建立血管重塑模型。采用野生型小鼠在普通饮食的状态下进行建模更接近于疾病发生的真实状态,可以观察到在不损害血管内膜的情况下血流动力学改变能否导致血管平滑肌出现表型转化。
本研究采用硅胶微导管套管缩窄术建立小鼠颈总动脉血管重塑模型,2周后观察到血管外膜组织明显增生,并伴有大量的炎症细胞浸润。术后4周可见明显外膜、中膜和内膜增生,病变部位主要由平滑肌细胞构成,内皮细胞仍完整地附着于血管腔表面。该方法不破坏内皮细胞的完整性,可以用来研究单纯的血流动力学改变引起的血管平滑肌细胞表型转化的分子机制,或用于筛选血压改变导致的平滑肌细胞表型转化的相关小分子药物。
在技术层面上,通过硅胶微导管套管缩窄术建立小鼠颈总动脉血管重塑模型需要注意以下要点:(1)在分离颈总动脉时尽量不要伤及伴行的神经组织;(2)在套管纵向剖开后,对套管一侧剪一个缺口,便于将颈总动脉套入套管中;(3)在丝线结扎过程中,在套管两端扎紧90%左右固定套管;待套管中间丝线扎紧套管后,再将两端丝线扎紧,防止套入的血管从套管中滑出。
利用硅胶微导管套管缩窄术建立颈总动脉血管重塑模型具有以下优点:(1)硅胶微导管模型较金属导丝颈总动脉损伤模型和直弹簧丝股动脉损伤模型在操作技术上难度稍小。(2)套管法对年龄和体重较小的小鼠也可成功造模。(3)硅胶微导管套管缩窄术不阻断血流,套管后颈总动脉的各个部位处于较大的血流压力中且受力均匀,这种稳定的血管重塑模型可用于比较不同小鼠间的血管重塑程度。(4)本模型不需要对内膜进行剥离,不损伤血管内皮细胞,与临床自然病程密切相关,因此该模型在探讨平滑肌重塑中可能具有一定的价值。然而,硅胶微导管套管缩窄术建立的血管重塑模型从血管外膜重塑开始,随着时间的延长逐渐导致中膜、内膜增生,这在生理病理机制上与动脉粥样硬化相关的血管重塑存在不同,可能并不适用于动脉粥样硬化性血管疾病的机制研究。此外,本研究仅采用组织学染色、血管标志分子检测等对造模效果进行评价,并未对局部血流动力学相关指标进行检测,而后者对于理解血流动力学改变如何直接影响血管病变的进展情况具有重要意义。
| [1] |
ZHAO D, LIU J, WANG M, ZHANG X G, ZHOU M G. Epidemiology of cardiovascular disease in China: current features and implications[J]. Nat Rev Cardiol, 2019, 16: 203-212. DOI:10.1038/s41569-018-0119-4 |
| [2] |
SILVAIN J, RAKOWSKI T, LATTUCA B, LIU Z Y, BOLOGNESE L, GOLDSTEIN P, et al. Interval from initiation of prasugrel to coronary angiography in patients with non-ST-segment elevation myocardial infarction[J]. J Am Coll Cardiol, 2019, 73: 906-914. |
| [3] |
LI L, WANG S, HUANG H L, CAI Y, XI Y T, BAI Y, et al. Effects of rosuvastatin and aspirin on retinal vascular structures in hypercholesterolemic patients with low-to-moderate risk of coronary artery disease[J]. Am J Cardiovasc Drugs, 2019, 19: 415-420. DOI:10.1007/s40256-019-00330-y |
| [4] |
GIFRE-RENOM L, JONES E A V. Vessel enlargement in development and pathophysiology[J/OL]. Front Physiol, 2021, 12: 639645. DOI: 10.3389/fphys.2021.639645.
|
| [5] |
BROWN I A M, DIEDERICH L, GOOD M E, DELALIO L J, MURPHY S A, CORTESE-KROTT M M, et al. Vascular smooth muscle remodeling in conductive and resistance arteries in hypertension[J]. Arterioscler Thromb Vasc Biol, 2018, 38: 1969-1985. DOI:10.1161/ATVBAHA.118.311229 |
| [6] |
LINDNER V, FINGERLE J, REIDY M A. Mouse model of arterial injury[J]. Circ Res, 1993, 73: 792-796. DOI:10.1161/01.RES.73.5.792 |
| [7] |
NOMURA-KITABAYASHI A, KOVACIC J C. Mouse model of wire injury-induced vascular remodeling[J]. Methods Mol Biol, 2018, 1816: 253-268. |
| [8] |
KIMURA K, RAMIREZ K, NGUYEN T A V, YAMASHIRO Y, SADA A, YANAGISAWA H. Contribution of PDGFRα-positive cells in maintenance and injury responses in mouse large vessels[J/OL]. Sci Rep, 2021, 11: 8683. DOI: 10.1038/s41598-021-88126-6.
|
| [9] |
ROQUE M, FALLON J T, BADIMON J J, ZHANG W X, TAUBMAN M B, REIS E D. Mouse model of femoral artery denudation injury associated with the rapid accumulation of adhesion molecules on the luminal surface and recruitment of neutrophils[J]. Arterioscler Thromb Vasc Biol, 2000, 20: 335-342. DOI:10.1161/01.ATV.20.2.335 |
| [10] |
HUI D Y. Intimal hyperplasia in murine models[J]. Curr Drug Targets, 2008, 9: 251-260. DOI:10.2174/138945008783755601 |
| [11] |
ZERNECKE A, SCHOBER A. Chemokines in vascular remodeling[J]. Thromb Haemost, 2007, 97: 730-737. DOI:10.1160/TH07-02-0085 |
| [12] |
TAKAYAMA T, SHI X D, WANG B W, FRANCO S, ZHOU Y F, DIRENZO D, et al. A murine model of arterial restenosis: technical aspects of femoral wire injury[J/OL]. JoVE, 2015(97): 52561. DOI: 10.3791/52561.
|
| [13] |
RAMESHRAD M, BABAEI H, AZARMI Y, FOULADI D F. Rat aorta as a pharmacological tool for in vitro and in vivo studies[J]. Life Sci, 2016, 145: 190-204. DOI:10.1016/j.lfs.2015.12.043 |
| [14] |
BOWEN-POPE D F, ROSS R, SEIFERT R A. Locally acting growth factors for vascular smooth muscle cells: endogenous synthesis and release from platelets[J]. Circulation, 1985, 72: 735-740. DOI:10.1161/01.CIR.72.4.735 |
| [15] |
SHAGDARSUREN E, BIDZHEKOV K, MAUSE S F, SIMSEKYILMAZ S, POLAKOWSKI T, HAWLISCH H, et al. C5a receptor targeting in neointima formation after arterial injury in atherosclerosis-prone mice[J]. Circulation, 2010, 122: 1026-1036. DOI:10.1161/CIRCULATIONAHA.110.954370 |
| [16] |
TANG J, WANG H X, HUANG X Z, LI F, ZHU H, LI Y, et al. Arterial Sca1+ vascular stem cells generate de novo smooth muscle for artery repair and regeneration[J/OL]. Cell Stem Cell, 2020, 26: 81-96. e4. DOI: 10.1016/j.stem.2019.11.010.
|
| [17] |
MORI Y, GONZALEZ MEDINA M, LIU Z W, GUO J N, DINGWELL L S, CHIANG S, et al. Roles of vascular endothelial and smooth muscle cells in the vasculoprotective effect of insulin in a mouse model of restenosis[J/OL]. Diabetes Vasc Dis Res, 2021, 18: 147916412110273. DOI: 10.1177/14791641211027324.
|
| [18] |
HIROSUMI J, NOMOTO A, OHKUBO Y, SEKIGUCHI C, MUTOH S, YAMAGUCHI I, et al. Inflammatory responses in cuff-induced atherosclerosis in rabbits[J]. Atherosclerosis, 1987, 64(2/3): 243-254. |
| [19] |
SASAKI T, KUZUYA M, NAKAMURA K, CHENG X W, SHIBATA T, SATO K, et al. A simple method of plaque rupture induction in apolipoprotein E-deficient mice[J]. Arterioscler Thromb Vasc Biol, 2006, 26: 1304-1309. DOI:10.1161/01.ATV.0000219687.71607.f7 |
| [20] |
CHENG C, TEMPEL D, VAN HAPEREN R, VAN DER BAAN A, GROSVELD F, DAEMEN M J A P, et al. Atherosclerotic lesion size and vulnerability are determined by patterns of fluid shear stress[J]. Circulation, 2006, 113: 2744-2753. DOI:10.1161/CIRCULATIONAHA.105.590018 |
| [21] |
VON DER THUÜSEN J H, VAN BERKEL T J C, BIESSEN E A L. Induction of rapid atherogenesis by perivascular carotid collar placement in apolipoprotein E-deficient and low-density lipoprotein receptor-deficient mice[J]. Circulation, 2001, 103: 1164-1170. DOI:10.1161/01.CIR.103.8.1164 |
 2021, Vol. 42
2021, Vol. 42


