妊娠期甲状腺功能减退(以下简称甲减)的发病率逐年上升,该病可引起多种母婴并发症,严重威胁母婴健康[1]。妊娠期甲减最主要的病因之一是自身免疫性甲状腺疾病(autoimmune thyroid disease,AITD)[2]。甲状腺过氧化物酶抗体(thyroperoxidase antibody,TPOAb)是诊断AITD的最灵敏、最准确的生物学指标之一,且其水平与甲状腺功能密切相关[3],TPOAb的升高预示着疾病的不良进展[4]。
Strieder等[5]研究发现AITD患者亲属的小肠结肠炎耶尔森菌感染率更高,AITD的易感基因也可能导致小肠结肠炎耶尔森菌感染,提示小肠结肠炎耶尔森菌可能在AITD的发生中起作用。Kiseleva等[6]的研究证明TPOAb与肠道菌群密切相关并存在相互作用。但目前TPOAb与肠道菌群相互作用的具体机制尚不明确。有文献报道TPOAb异常的孕妇胎膜早破、流产、胎儿窘迫的发生率均显著高于正常孕妇,提示TPOAb异常与不良妊娠结局密切相关[7]。本研究探讨妊娠晚期甲减合并TPOAb异常患者肠道菌群的组成和多样性特征及其与母婴结局指标的相关性。
1 资料和方法 1.1 研究对象随机选择2018年9月至2019年10月在郑州大学第三附属医院产科门诊就诊的妊娠晚期甲减合并TPOAb水平异常患者20例(TPOAb阳性组)及妊娠晚期甲减且TPOAb水平正常患者20例(TPOAb阴性组)。纳入标准:(1)孕周为37~41周;(2)妊娠晚期甲减患者的甲状腺功能指标符合2017年美国甲状腺协会妊娠期和产后甲状腺疾病诊断和管理指南中妊娠期甲减的诊断标准[8],并结合郑州大学第三附属医院检验科制定的特异性临界值参考值范围,即游离甲状腺素(free thyroxine,FT4)<11.5 pmol/L、促甲状腺激素(thyroid stimulating hormone,TSH)>3.0 mIU/L;(3)TPOAb阳性组患者符合上述妊娠期甲减的诊断且TPOAb水平>35 IU/mL,否则为TPOAb阴性组;(4)无其他妊娠合并症。排除标准:(1)年龄<18岁;(2)孕前患有甲减或桥本甲状腺炎、高血压、糖尿病等内分泌及代谢性疾病;(3)有严重的应激性事件发生;(4)严重焦虑、抑郁症患者;(5)合并其他妊娠期并发症;(6)伴有循环系统疾病、消化系统疾病等病史者;(7)伴有严重的肠道疾病或曾接受过肠道手术者;(8)近4周内服用过抗生素或调节肠道菌群药物;(9)近2周内使用过止泻药、益生菌;(10)有每天服用酸奶或益生菌制品等习惯;(11)粪便常规检查异常者。本研究通过郑州大学第三附属医院伦理委员会审批(2017医伦审第93号),所有患者均自愿参加并签署书面知情同意书。
1.2 标本收集(1)粪便标本:排便后立即用无菌棉签采集粪便标本200~300 mg置于无菌冻存管内,存放于-80 ℃冰箱,24 h内进行标本分析。(2)血液标本:孕妇空腹8 h以上,清晨7:00采静脉血约8 mL,845×g离心10 min,分离血浆和血细胞,取上清液,4 h内进行标本分析。
1.3 数据收集收集两组孕妇产前(入组时)身高、年龄、体重、BMI、孕周、血常规、CRP、甲状腺功能指标、细胞因子、孕期增加体重、产后CRP、产后血红蛋白,胎盘重量,新生儿的体重、头围、身长、1 min和5 min阿普加评分及转科、羊水污染、窒息、窘迫、畸形的发生率等临床数据。详细了解两组孕妇的既往胚胎停育和自然流产病史、既往高血压病史、既往糖尿病病史、产后发热、产后出血量、产后感染、伤口炎症等相关数据。
1.4 肠道菌群16S rRNA测序对所有研究对象的粪便样本提取DNA,样品质量检测合格后构建测序文库。回收目的扩增产物片段,用T4 DNA聚合酶、Klenow DNA聚合酶和T4多核苷酸激酶修复黏性末端,再通过3′-端加碱基A,使得DNA片段能与3′-端带有T碱基的特殊接头连接。设计合成含有测序接头的双Index融合引物,以样品的总DNA为模板,采用PCR扩增16S rRNA v4高变区,磁珠法筛选目的扩增产物片段,并用合格的文库进行集群的制备和测序。随后,将下机数据滤除低质量的读长,通过读长之间的重叠关系将读长拼接成序列标签。在97%序列相似性条件下将序列标签聚成操作分类单元,比对操作分类单元与数据库进行物种注释分析。基于操作分类单元和物种注释结果进行样品物种复杂度α多样性[物种丰富度指数、Chao指数、Ace指数、Shannon指数、Simpson指数、测序深度指数样品文库的覆盖率(Good’s coverage)]、β多样性(Bray-Curtis、Unweighted-UniFrac、Weighed-UniFrac)及组间物种差异线性判别分析效应大小(linear discriminate effect size,LEfSe)等分析。16S rRNA基因测序由武汉华大基因测序公司完成。
1.5 DNA提取和qRT-PCR验证从TPOAb阳性和阴性组各随机选取5例标本,针对双歧杆菌属和毛螺菌属进行qRT-PCR验证。解冻冻存在-80 ℃的200~300 mg粪便标本,使用DNA easy PoweSoil isolation Kit(德国QIAGEN公司)严格按试剂盒要求提取样品中的总细菌DNA。所有操作均在冰上进行,避免粪便中菌群的种类和丰度因受环境温度的影响而发生变化。取1 μL总DNA测定D260并定量。采用美国ABI公司ViiA7型定时荧光定量PCR仪进行PCR扩增,每个样品进行3次平行实验,取平均值。循环阈值(cycle threshold,Ct)数据的采集采用校正的阈值设定,绝对定量分析设置标准品的拷贝数,绘制标准曲线后可直接生成样品的拷贝数。引物序列:双歧杆菌上游引物5′-CTCCTGGAAACGGGTGG-3′,下游引物5′-GGTGTTCTTCCCGATATCTACA-3′;毛螺菌属上游引物5′-GCAGTGGGGAATATTGCAC-3′,下游引物5′-GGAATTCCACTTACCTCTCC-3′。反应体系(16 μL):H2O 6.6 μL,2×PCR混合物[天根生化科技(北京)有限公司]8 μL,50 pmol/μL上、下游引物各0.2 μL,DNA模板1 μL。反应条件:95 ℃ 2 min,94 ℃ 10 s、60 ℃ 10 s、72 ℃40 s共40个循环。
1.6 临床检验指标测量(1)炎性指标:使用BS-220型全自动生化分析仪(南京贝登医疗股份有限公司)、全自动细胞计数仪(北京赛百奥科技有限公司)检测血常规;采用乳胶免疫比浊法检测CRP,仪器为日立7600全自动生化分析仪,相关试剂由上海申索佑福公司提供。(2)甲状腺功能:采用放射免疫分析法检测FT4、TSH、TPOAb。(3)细胞因子:使用FACSCalibur型流式细胞仪(美国BD公司)和人细胞因子检测试剂盒(杭州联科生物技术股份有限公司)测定血清IL-2、IL-4、IL-6、IL-10、TNF-α。以上所有操作流程,检测人员均需严格按照仪器及实验室操作标准进行。
1.7 统计学处理应用SPSS 23.0软件和R 3.51软件进行统计学分析。呈正态分布的计量资料以x±s表示,两组间比较采用独立样本t检验。呈偏态分布的计量资料以中位数(四分位数间距)表示,两组间比较采用Mann-Whitney U检验。计数资料用频数和构成比表示,两组间比较采用χ2检验。采用Pearson相关分析方法对TPOAb阳性和阴性组的差异菌属与临床检验指标进行相关性分析。检验水准(α)为0.05。
2 结果 2.1 一般资料比较TPOAb阳性和阴性组孕妇各20例,年龄分别为25~38和19~43岁,产前TPOAb水平分别为36~82和5~9 IU/mL。TPOAb阳性组和TPOAb阴性组孕妇的年龄、身高、入组时体重、入组时孕周、入组时BMI差异均无统计学意义(P均>0.05,表 1)。
|
|
表 1 TPOAb阳性与阴性组妊娠晚期甲状腺功能减退孕妇的一般临床资料 Tab 1 General clinical data of pregnant women with hypothyroidism during the third trimester in TPOAb positive and negative groups |
2.2 两组孕妇肠道菌群16S rRNA测序结果分析 2.2.1 物种注释分析
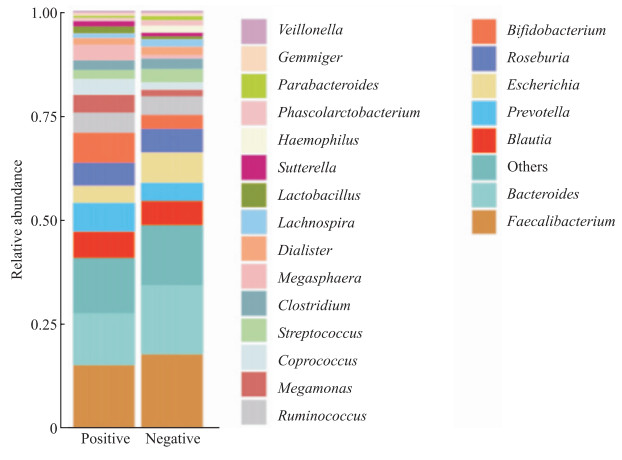
由物种注释分析图(图 1)可见,在属水平,TPOAb阳性和阴性组孕妇肠道菌群中的优势属均为粪杆菌属、拟杆菌属、布劳特菌属、普雷沃菌属、埃希菌属。
|
图 1 TPOAb阳性与阴性组妊娠晚期甲状腺功能减退孕妇肠道菌群的物种注释分析图 Fig 1 Species annotation of intestinal flora of pregnant women with hypothyroidism during the third trimester in TPOAb positive and negative groups TPOAb: Thyroperoxidase antibody. |
2.2.2 α多样性的比较
TPOAb阳性与阴性组孕妇肠道菌群的物种丰富度指数、Chao指数、Ace指数、Shannon指数、Simpson指数和测序深度指数样品文库的覆盖率分别为194.65(47.65)vs 199.85(60.79)、234.89(55.90)vs 243.31(64.38)、239.30(61.17)vs 247.49(65.95)、3.07(0.36)vs 3.10(0.48)、0.11(0.04)vs 0.11(0.06)和1.00(0.00)vs 1.00(0.00),两组间差异均无统计学意义(P均>0.05)。
2.2.3 β多样性的比较UniFrac是利用系统进化的信息比较样品间的物种群落差异。基于Weighted UniFrac的β多样性分析结果显示,TPOAb阳性组孕妇肠道菌群的物种多样性低于TPOAb阴性组[0.44(0.16)vs 0.48(0.21)],差异有统计学意义(P=0.011)。偏最小二乘法判别分析(partial least squares discrimination analysis,PLS-DA)可将主成分分析和多元回归的功能相结合,更适于比较组间差异。基于操作分类单元的PLS-DA结果显示,TPOAb阳性组和TPOAb阴性组样本在X轴和Y轴上存在明显的分离,表明TPOAb阳性组和TPOAb阴性组孕妇肠道菌群的组成结构存在明显的物种差异(图 2)。

|
图 2 TPOAb阳性和阴性组妊娠晚期甲状腺功能减退孕妇肠道菌群的OTU PLS-DA图 Fig 2 OTU PLS-DA diagram of intestinal flora of pregnant women with hypothyroidism during the third trimester in TPOAb positive and negative groups TPOAb: Thyroperoxidase antibody; OTU: Operational taxonomic unit; PLS-DA: Partial least squares discrimination analysis. |
2.2.4 组间物种差异分析
对两组样本进行LEfSe分析以找出组间差异有统计学意义的生物标志物。LEfSe分析结果提示TPOAb阳性组孕妇肠道菌群中双歧杆菌属的相对丰度明显增加,TPOAb阴性组毛螺菌属、嗜血杆菌属等的相对丰度明显高于TPOAb阳性组(图 3)。

|
图 3 TPOAb阳性和阴性组妊娠晚期甲状腺功能减退孕妇肠道菌群的LEfSe分析结果图 Fig 3 LEfSe diagram of intestinal flora of pregnant women with hypothyroidism during the third trimester in TPOAb positive and negative groups TPOAb: Thyroperoxidase antibody; LEfSe: Linear discriminant effect size; LDA: Linear discriminant analysis. |
2.2.5 蛋白质直系同源簇(clusters of orthologous groups of proteins,COG)二级分类代谢通路功能预测
利用PICRUSt2软件对两组孕妇肠道菌群的COG代谢途径进行预测,结果显示TPOAb阳性组孕妇肠道菌群中核苷酸转运和代谢及细胞运动2个通路的活性明显高于TPOAb阴性组,但经多次比较调整后两组之间代谢通过活动性的差异不再明显(图 4)。

|
图 4 TPOAb阳性和阴性组妊娠晚期甲状腺功能减退孕妇肠道菌群的COG二级分类代谢通路图 Fig 4 COG secondary metabolic pathway of intestinal flora of pregnant women with hypothyroidism during the third trimester in TPOAb positive and negative groups TPOAb: Thyroperoxidase antibody; COG: Clusters of orthologous groups of proteins; FDR: False discovery rate. |
2.3 qRT-PCR分析结果
PCR扩增熔解曲线仅呈现一个熔解峰,证明无引物二聚体产生和非特异性扩增,提示引物的特异性较好。以10倍梯度稀释的双歧杆菌属和毛螺菌属基因组DNA为模板,不同扩增曲线平行位移,扩增效率一致。不同稀释倍数模板DNA的Ct值与双歧杆菌属和毛螺菌属含量呈线性负相关(R2分别为0.98、0.99),多次检验后,标准曲线重复性良好。TPOAb阳性和阴性组各5例粪便样本双歧杆菌属和毛螺菌属的qRT-PCR分析结果如表 2所示,与TPOAb阴性组相比,TPOAb阳性组孕妇肠道菌群中双歧杆菌属含量较高、毛螺菌属含量较低。
|
|
表 2 TPOAb阳性和阴性组孕妇粪便样本中双歧杆菌属和毛螺菌属的qRT-PCR分析结果 Tab 2 qRT-PCR analysis of Bifidobacterium and Lachnospira in stool samples of pregnant women in TPOAb positive and negative groups |
2.4 两组孕妇检验指标的比较
TPOAb阳性组孕妇产前(入组时)、产后CRP水平均高于TPOAb阴性组(P < 0.01、P=0.02)。两组孕妇的产前白细胞、中性粒细胞比例、产前和产后血红蛋白、产前血细胞比容差异均无统计学意义(P均>0.05)。TPOAb阳性和阴性组孕妇的产前甲状腺功能指标FT4和TSH水平差异均无统计学意义(P均>0.05)。TPOAb阳性组孕妇的血清IL-2和IL-6水平均高于TPOAb阴性组(P=0.02、P < 0.01)。见表 3。
|
|
表 3 TPOAb阳性和阴性组妊娠晚期甲状腺功能减退孕妇的检验指标 Tab 3 Laboratory indexes of pregnant women with hypothyroidism during the third trimester in TPOAb positive and negative groups |
2.5 肠道菌群相对丰度与检验指标的相关性
两组孕妇肠道菌群中双歧杆菌属相对丰度与血清TPOAb水平呈正相关(r=0.55,P < 0.01),毛螺菌属相对丰度与血清IL-6水平呈负相关(r=-0.37,P=0.02)。
2.6 母婴结局指标比较 2.6.1 孕妇结局指标比较TPOAb阳性组孕妇妊娠期体重增加值大于TPOAb阴性组(P < 0.01)。TPOAb阳性组患者既往胚胎停育次数和自然流产次数均多于TPOAb阴性组(P=0.04、0.02),既往高血压病史和糖尿病病史、产后感染发生率、会阴伤口或剖宫产伤口炎症发生率、产后发热发生率及产后出血量与TPOAb阴性组相比差异均无统计学意义(P均>0.05)。见表 4。
|
|
表 4 TPOAb阳性和阴性组妊娠晚期甲状腺功能减退孕妇及新生儿的临床指标 Tab 4 Clinical indexes of pregnant women with hypothyroidism during the third trimester and newborns between TPOAb positive and negative groups |
2.6.2 新生儿出生时临床信息比较
TPOAb阳性组新生儿的体重、头围均低于TPOAb阴性组(P均 < 0.01)。TPOAb阳性组分娩时新生儿窒息、窘迫的发生率均高于TPOAb阴性组(P均=0.04)。TPOAb阳性组新生儿1 min阿普加评分低于TPOAb阴性组(P < 0.01),新生儿转科发生率高于TPOAb阴性组(P=0.04)。在新生儿畸形方面,TPOAb阳性组1例肺部发育畸形,TPOAb阴性组1例先天无肛门畸形。见表 4。
3 讨论肠道是最复杂的微生态系统,包含1 200多种细菌,编码约330万个基因,被称为人体的“第二基因组”[9]。肠道菌群的生态失调会促进炎症反应及免疫失衡,导致自身免疫性疾病[10]。Virili和Centanni[11]通过无菌动物肠道营养不良干扰甲状腺代谢的研究指出,肠道菌群的组成可能参与了甲状腺稳态的关键途径。Kiseleva等[12]研究发现,在患自身免疫性甲状腺疾病TPOAb阳性患者的血清中检测到双歧杆菌、乳杆菌抗原的概率是TPOAb阴性血清样本的3倍,提示TPOAb与肠道菌群可能密切相关,但相关研究较少且两者的相互作用机制尚不明确。
在本研究中,LEfSe分析结果提示TPOAb阳性组肠道菌群中双歧杆菌属含量高,TPOAb阴性组中毛螺菌属、嗜血杆菌属等含量高。Kiseleva等[12]研究指出双歧杆菌属和TPOAb相关,与本研究相关性分析结果一致。两者可能的相互作用机制为:(1)甲状腺过氧化物酶的氨基酸序列和双歧杆菌蛋白质具有同源性(可能是这些抗原的B细胞和T细胞的抗原表位),这是它们相互作用的分子基础[5];(2)当肠道菌群失调时,肠道黏膜屏障功能被破坏,双歧杆菌、乳杆菌等菌属某些特定菌株蛋白透过肠道黏膜屏障进入血液,并通过分子模拟等机制打破免疫耐受状态,引起针对甲状腺的自身免疫反应,从而诱发自身免疫性疾病;(3)双歧杆菌、乳杆菌的一些蛋白组分在其他抗体含量过多的情况下,可选择性地与TPOAb和甲状腺球蛋白抗体相互作用,并竞争甲状腺过氧化物酶和甲状腺球蛋白,导致T细胞和B细胞出现自身反应性克隆,从而引发自身免疫性疾病。
本研究结果显示,TPOAb阳性组孕妇产前、产后CRP水平均高于TPOAb阴性组,提示妊娠晚期甲减TPOAb阳性可能和轻度炎症有关。研究表明甲减的发生、发展和CRP、IL-6等密切相关[13]。本研究相关性分析结果也显示毛螺菌属相对丰度和IL-6呈负相关。CRP是全身性炎症标志物[14],一方面,在钙的存在下,其与微生物表面的多糖如磷酸胆碱结合,并通过激活补体C1q触发固有免疫的经典补体途径[15];另一方面,CRP与Fc受体结合并相互作用,引起促炎症细胞因子如IL-2、IL-6等释放[16]。Türemen等[14]比较了37例亚临床甲减患者和23名健康志愿者的血清TNF-α、IL-6和CRP水平,观察到自身免疫性甲状腺炎患者的血清IL-6和TNF-α水平与对照组相比明显较高。本研究测定了TPOAb阳性和阴性组孕妇的血清细胞因子水平,TPOAb阳性组IL-2、IL-6水平均高于TPOAb阴性组。这一结果提示甲减合并TPOAb异常患者可能呈现一种低度的炎症状态,且TPOAb可能参与免疫反应。这是因为TPOAb可促进甲状腺过氧化物酶诱导的吞噬细胞释放促炎细胞因子,以及T细胞对甲状腺过氧化物酶的应答;其中促炎细胞因子TNF-α、IL-6和γ干扰素及抗炎细胞因子IL-10均与TPOAb含量有关[17]。在本研究中,TPOAb阳性组IL-6水平高于TPOAb阴性组,支持上述结论。原因可能包括:一方面,氧化应激可能是引起炎症进展的重要机制,而甲状腺激素起保护作用,调节抗氧化剂的水平;另一方面,甲减会加重氧化应激,引起组织炎症,产生的IL使脱碘酶表达减少,从而诱导三碘甲腺原氨酸水平降低,进一步加重甲减[18]。
对妊娠晚期甲减合并TPOAb异常研究的意义还在于TPOAb浓度的升高可能预示着一系列不良的母婴结局。单纯甲状腺自身抗体的存在与胎盘早剥[19]、胎膜早破[20]、围产期死亡[21]等有关。甲状腺自身抗体也被认为与自然流产和早产的发生率独立相关[22]。在本研究中,TPOAb阳性组孕妇既往胚胎停育次数、自然流产次数均多于TPOAb阴性组,提示妊娠期TPOAb异常可增加胚胎停育和自然流产的风险。目前的这些研究结果证实了TPOAb异常与妊娠流产之间存在关联,两者相互作用的机制可能为:(1)甲状腺抗体的存在是一种潜在的自身免疫失衡,可导致胎儿耐受力降低[23],例如原因不明的反复妊娠流产的妇女经常表现出效应性T细胞和调节性T细胞之间的失衡[24];(2)甲状腺抗体阳性的妇女甲状腺功能低下的程度会影响其生殖能力[23]。
Saki等[25]的研究指出妊娠期甲状腺自身抗体与不孕、早产、妊娠期糖尿病和新生儿出生体重低的风险有关。与TPOAb阴性的母亲相比,TPOAb阳性的母亲更常娩出低出生体重儿[21]。Derakhshan等[26]的研究也指出孕妇的亚临床甲减与小于胎龄儿和较低出生体重儿有关,本研究数据也表明,TPOAb阳性组新生儿体重低于TPOAb阴性组。出生体重是胎儿生长、发育、营养和其他宫内暴露的重要标志。甲状腺激素在整个妊娠过程中调节着母亲和胎儿的代谢过程。它通过促进胎盘生长,调节新陈代谢、胎儿葡萄糖、氧气消耗等控制胎儿生长[26]。其中胎儿和胎盘的生长受到甲状腺功能障碍和自身免疫的影响[21]。
在新生儿窒息、窘迫发生率方面,TPOAb阳性组均高于TPOAb阴性组。TPOAb阳性组1 min阿普加评分低于TPOAb阴性组。提示TPOAb阳性组孕妇在新生儿结局方面比TPOAb阴性组差。Pradhan等[27]研究了196例甲减妇女资料,TPOAb阳性组可能有先兆流产、自然流产、早产、胎儿畸形、胎儿生长受限及其他一系列不良胎儿结局,且阿普加评分低于正常参考值。甲状腺抗体可能与甲状腺功能指标的轻微降低有关,反映了免疫系统的普遍激活,特别是胎儿-母亲界面处免疫系统的活性失调[28]。此外,由于甲状腺抗体异常的孕妇娩出的新生儿对缺血、缺氧的耐受力更差,因此增加了新生儿窒息及新生儿窘迫的发生率,新生儿转科的发生率也升高。这与本研究结果一致。因此,临床需要对TPOAb做好监测,可从肠道菌群方面入手加深对TPOAb的认识和干预。
本研究是对妊娠晚期甲减合并TPOAb异常孕妇肠道菌群特征的分析,这方面的研究尚未见报道。由于整个妊娠期的影响因素多,肠道菌群变化大,本研究选择妊娠晚期,尽可能地减少干扰因素。此外,本研究从妊娠前的既往病史追踪到分娩时母婴情况,可更好地观察妊娠晚期TPOAb异常对母婴结局的影响。本研究也存在不足之处:(1)为了减少妊娠这个混杂因素对研究结果的影响,选择了更接近分娩期的孕37~41周的甲减孕妇,造成样本量不多,但研究结果可能更准确。(2)没有在两组中增加对与TPOAb相关的镁和硒的研究。(3)研究对象均为同一地域的人群,可能具有区域局限性。
综上所述,本研究揭示了妊娠晚期甲减合并TPOAb异常孕妇的肠道菌群特征,发现相较TPOAb阴性组,妊娠晚期甲减TPOAb阳性组患者肠道菌群中双歧杆菌属更高、毛螺菌属更低。妊娠晚期甲减孕妇TPOAb异常与肠道菌群密切相关,也与不良的新生儿结局存在密切联系,其中肠道双歧杆菌属和毛螺菌属可能成为妊娠晚期甲减TPOAb异常的无创生物标志物。
| [1] |
SHRESTHA A, TRIPATHI P, DONGOL A. Pregnancy outcomes in patients with hypothyroidism[J]. Kathmandu Univ Med J (KUMJ), 2019, 17: 57-60. |
| [2] |
CHAHARDOLI R, SABOOR-YARAGHI A A, AMOUZEGAR A, KHALILI D, VAKILI A Z, AZIZI F. Can supplementation with vitamin D modify thyroid autoantibodies (anti-TPO ab, anti-TG ab) and thyroid profile (T3, T4, TSH) in hashimoto's thyroiditis? A double blind, randomized clinical trial[J]. Horm Metab Res, 2019, 51: 296-301. DOI:10.1055/a-0856-1044 |
| [3] |
BROMIŃSKA B, BROMIŃSKI G, OWECKI M, MICHALAK M, CZARNYWOJTEK A, WAŚKO R, et al. Anti-thyroidal peroxidase antibodies are associated with thyrotropin levels in hypothyroid patients and in euthyroid individuals[J]. Ann Agric Environ Med, 2017, 24: 431-434. |
| [4] |
VANDERPUMP M P, TUNBRIDGE W M, FRENCH J M, APPLETON D, BATES D, CLARK F, et al. The incidence of thyroid disorders in the community: a twenty-year follow-up of the Whickham Survey[J]. Clin Endocrinol (Oxf), 1995, 43: 55-68. |
| [5] |
STRIEDER T G, WENZEL B E, PRUMMEL M F, TIJSSEN J G, WIERSINGA W M. Increased prevalence of antibodies to enteropathogenic Yersinia enterocolitica virulence proteins in relatives of patients with autoimmune thyroid disease[J]. Clin Exp Immunol, 2003, 132: 278-282. DOI:10.1046/j.1365-2249.2003.02139.x |
| [6] |
KISELEVA E P, MIKHAILOPULO K I, SVIRIDOV O V, NOVIK G I, KNIREL Y A, SZWAJCER DEY E. The role of components of Bifidobacterium and Lactobacillus in pathogenesis and serologic diagnosis of autoimmune thyroid diseases[J]. Benef Microbes, 2011, 2: 139-154. |
| [7] |
FELDTHUSEN A D, LARSEN J, PEDERSEN P L, TOFT KRISTENSEN T, KVETNY J. Pregnancy-induced alterations in mitochondrial function in euthyroid pregnant women and pregnant women with subclinical hypothyroidism; relation to adverse outcome[J/OL]. J Clin Transl Endocrinol, 2014, 1: e13-e17. DOI: 10.1016/j.jcte.2013.12.003.
|
| [8] |
ALEXANDER E K, PEARCE E N, BRENT G A, BROWN R S, CHEN H, DOSIOU C, et al. 2017 guidelines of the American Thyroid Association for the diagnosis and management of thyroid disease during pregnancy and the postpartum[J]. Thyroid, 2017, 27: 315-389. |
| [9] |
CHIOVATO L, BASSI P, SANTINI F, MAMMOLI C, LAPI P, CARAYON P, et al. Antibodies producing complement-mediated thyroid cytotoxicity in patients with atrophic or goitrous autoimmune thyroiditis[J]. J Clin Endocrinol Metab, 1993, 77: 1700-1705. |
| [10] |
BOGNER U, SCHLEUSENER H, WALL J R. Antibody-dependent cell mediated cytotoxicity against human thyroid cells in Hashimoto's thyroiditis but not Graves' disease[J]. J Clin Endocrinol Metab, 1984, 59: 734-738. |
| [11] |
VIRILI C, CENTANNI M. Does microbiota composition affect thyroid homeostasis?[J]. Endocrine, 2015, 49: 583-587. |
| [12] |
KISELEVA E P, MIKHAILOPULO K I, NOVIK G I, SZWAJCER DEY E, ZDOROVENKO E L, SHASHKOV A S, et al. Isolation and structural identification of glycopolymers of Bifidobacterium bifidum BIM B-733D as putative players in pathogenesis of autoimmune thyroid diseases[J]. Benef Microbes, 2013, 4: 375-391. |
| [13] |
李红岩, 刘静, 张靖宇, 王洪生. 甲减和亚临床甲减患者血清IL-2、IL-6、IL-8水平变化的研究[J]. 国际检验医学杂志, 2019, 40: 475-477. |
| [14] |
TÜREMEN E E, ÇETINARSLAN B, AHIN T, CANTÜRK Z, TARKUN İ. Endothelial dysfunction and low grade chronic inflammation in subclinical hypothyroidism due to autoimmune thyroiditis[J]. Endocr J, 2011, 58: 349-354. |
| [15] |
VOLANAKIS J E. Human C-reactive protein: expression, structure, and function[J]. Mol Immunol, 2001, 38: 189-197. |
| [16] |
SANTA CRUZ A, MENDES-FRIAS A, OLIVEIRA A I, DIAS L, MATOS A R, CARVALHO A, et al. Interleukin-6 is a biomarker for the development of fatal severe acute respiratory syndrome coronavirus 2 pneumonia[J/OL]. Front Immunol, 2021, 12: 613422. DOI: 10.3389/fimmu.2021.613422.
|
| [17] |
NIELSEN C H, BRIX T H, LESLIE R G, HEGEDÜS L. A role for autoantibodies in enhancement of pro-inflammatory cytokine responses to a self-antigen, thyroid peroxidase[J]. Clin Immunol, 2009, 133: 218-227. |
| [18] |
HARIBABU A, REDDY V S, PALLAVI C H, BITLA A R, SACHAN A, PULLAIAH P, et al. Evaluation of protein oxidation and its association with lipid peroxidation and thyrotropin levels in overt and subclinical hypothyroidism[J]. Endocrine, 2013, 44: 152-157. |
| [19] |
ABBASSI-GHANAVATI M, CASEY B M, SPONG C Y, MCINTIRE D D, HALVORSON L M, CUNNINGHAM F G. Pregnancy outcomes in women with thyroid peroxidase antibodies[J]. Obstet Gynecol, 2010, 116: 381-386. |
| [20] |
刘利平, 邹艳芬. 单纯TPOAb阳性对孕妇胎膜早破、羊水异常、胎儿宫内窘迫、妊娠期糖尿病及高血压的影响[J]. 中国妇幼保健, 2018, 33: 4623-4625. |
| [21] |
MÄNNISTÖ T, VÄÄRÄSMÄKI M, POUTA A, HARTIKAINEN A L, RUOKONEN A, SURCEL H M, et al. Perinatal outcome of children born to mothers with thyroid dysfunction or antibodies: a prospective population-based cohort study[J]. J Clin Endocrinol Metab, 2009, 94: 772-779. |
| [22] |
YUAN N, SUN J, LI Z, CHAI S, ZHANG X, JI L. Relationship between anti-thyroid peroxidase antibody positivity and pregnancy-related and fetal outcomes in euthyroid women: a single-center cohort study[J/OL]. BMC Pregnancy Childbirth, 2020, 20: 491. DOI: 10.1186/s12884-020-03176-4.
|
| [23] |
TWIG G, SHINA A, AMITAL H, SHOENFELD Y. Pathogenesis of infertility and recurrent pregnancy loss in thyroid autoimmunity[J]. J Autoimmun, 2012, 38: J275-J281. |
| [24] |
LEE S K, KIM J Y, HUR S E, KIM C J, NA B J, LEE M, et al. An imbalance in interleukin-17-producing T and Foxp3+ regulatory T cells in women with idiopathic recurrent pregnancy loss[J]. Hum Reprod, 2011, 26: 2964-2971. |
| [25] |
SAKI F, DABBAGHMANESH M H, GHAEMI S Z, FOROUHARI S, RANJBAR OMRANI G, BAKHSHAYESHKARAM M. Thyroid function in pregnancy and its influences on maternal and fetal outcomes[J/OL]. Int J Endocrinol Metab, 2014, 12: e19378. DOI: 10.5812/ijem.19378.
|
| [26] |
DERAKHSHAN A, PEETERS R P, TAYLOR P N, BLIDDAL S, CARTY D M, MEEMS M, et al. Association of maternal thyroid function with birthweight: a systematic review and individual-participant data meta-analysis[J]. Lancet Diabetes Endocrinol, 2020, 8: 501-510. |
| [27] |
PRADHAN M, ANAND B, SINGH N, MEHROTRA M. Thyroid peroxidase antibody in hypothyroidism: it's effect on pregnancy[J]. J Matern Fetal Neonatal Med, 2013, 26: 581-583. |
| [28] |
THANGARATINAM S, TAN A, KNOX E, KILBY M D, FRANKLYN J, COOMARASAMY A. Association between thyroid autoantibodies and miscarriage and preterm birth: meta-analysis of evidence[J/OL]. BMJ, 2011, 342: d2616. DOI: 10.1136/bmj.d2616.
|
 2021, Vol. 42
2021, Vol. 42


