2. 超声分子影像重庆市重点实验室, 重庆 400010;
3. 省部共建国家重点实验室培育基地——重庆市超声医学工程重点实验室, 重庆 400010
2. Chongqing Key Laboratory of Ultrasound Molecular Imaging, Chongqing 400010, China;
3. State Key Laboratory of Ultrasound Engineering in Medicine Co-Founded by Chongqing and the Ministry of Science and Technology, Chongqing 400010, China
诊疗纳米粒是一种多功能纳米制剂,同时兼具成像和治疗的作用[1],广泛用于疾病的诊断、药物的递送和诊疗效果的监测等方面,将对未来个性化医疗起重大作用[2]。心血管疾病是全球范围导致死亡的最主要原因[3],而血栓栓塞是造成该疾病相关死亡的主要原因[4]。针对血栓的诊断和治疗问题,制备一种靶向血栓的诊疗纳米粒很有必要。有研究表明,使用低强度聚焦超声辐照包载全氟戊烷(perfluoropentane,PFP)的纳米粒,其内部的PFP会发生相变,即载液态氟碳纳米粒出现声致相变(acoustic droplet vaporization,ADV)效应[5]。相变产生的生物学效应(如空化效应、声孔效应)可以促进血栓结构破坏,达到溶栓的目的[6]。本实验利用ADV效应结合近红外荧光碘化物(1, 1’-dioctadecyl-3, 3, 3’, 3’-tetramethylindotricarbocyanine iodide,DiR)的光声成像特质[7],制备血栓诊疗纳米粒,并对其体内外血栓靶向效果、光声成像能力和溶栓效果进行探究。
1 材料和方法 1.1 主要试剂和仪器羧基封端聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA,分子量8 000,聚合比75∶25]购自济南岱罡生物材料有限公司,DiR购于重庆蒙博生物科技有限公司。PFP、聚乙烯醇(polyvinyl alcohol,PVA)、2-吗啉代乙烷磺酸(2-morpholinoetlanesulfonic acid,MES)、1-乙基-3-(3-二甲基氨丙基)碳二亚胺盐酸盐[1-ethyl-3-(3-dimethylaminopropyl) carbodiimide hydrochloride,EDC]、N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS)均购自美国Sigma公司。二氯甲烷购自上海麦克林生化科技有限公司,cCGPRPPC环肽由吉尔生化(上海)有限公司合成。其他试剂均为分析纯。
VCY-500超声波处理器(上海研永超声设备有限公司)、Ti2-U光学显微镜(日本尼康公司)、流式细胞仪(美国BD公司)、Nano ZS90激光粒径仪(英国马尔文仪器有限公司)、UV-2550紫外分光光度计(日本岛津公司)、Nikon A1R激光共聚焦显微镜[尼康仪器(上海)有限公司]、Vevo LAZR光声成像系统(加拿大Visual Sonics公司)、低能聚焦超声仪(重庆海扶医疗科技股份有限公司)。
1.2 纳米粒的制备及性质使用参数调整后的双乳化法及碳二亚胺技术制备PLGA纳米粒[8]。称量50 mg PLGA和0.5 mg DiR溶于2 mL二氯甲烷中,再加200 μL PFP,超声振荡3 min(功率为150 W,时间间隔5 s)后得到初乳。加入5 mL 4%的PVA,超声振荡3 min(功率为150 W,时间间隔5 s)后加入10 mL 2%的异丙醇即得到复乳。将复乳置于磁力搅拌器中搅动3 h,得到的悬浊液经低温离心机离心3次(9 000 r/min,离心半径为100 mm),即得DiR-PFP-PLGA纳米粒(NP)。
采用碳二亚胺法将cCGPRPPC环肽连接于NP上。将NP分散于0.1 mol/L MES溶液(pH=6)中,加入过量的EDC与MES活化其羧基,1 h后用双蒸水洗去未反应的EDC和MES。将活化后的NP分散于0.1 mol/L MES缓冲液(pH=8)中。向溶液中加入5 mg的cCGPRPPC环肽,置于摇床上反应过夜。最后离心(9 000 r/min,离心半径为100 mm)获得cCGPRPPC-DiR-PFP-PLGA纳米粒(TNP)。以上制备过程均在4 ℃环境下进行。cCGPRPPC-DiR-PLAG纳米粒制备流程相同,以200 μL生理盐水(saline)替代200 μL PFP。本实验中其他纳米粒(cCGPRPPC-PFP-PLAG纳米粒、saline-PLAG纳米粒、cCGPRPPC-saline-PLAG纳米粒)制备流程也相同,制备过程中不加入DiR。含生理盐水的纳米粒是以200 μL生理盐水代替200 μL PFP作为内核。
1.2.1 理化性质检测将离心后获得的纳米粒沉淀使用PBS稀释,观察其溶液外观。取少量悬浊液在光学显微镜下观察纳米粒的形状及分散性。使用低能聚焦超声仪辐照(5 W/cm2,1 s脉冲)纳米粒悬浊液,于1和3 min时取少许纳米粒悬浊液在光镜下观察其相变过程中的形态和相变后的形态。将TNP稀释成0.05 mg/mL的纳米粒悬浊液,取1 mL溶液用激光粒径仪测量纳米粒的粒径、zeta电位和多聚分散系数(polydispersity index,PDI)。将DiR用DMSO溶解成不同的浓度(0. 5、1、2、3、4、5 mg/L),用紫外分光光度计检测其吸光特性,计算DiR的包封率。
1.2.2 环肽携带率检测将50 mg PLGA溶于2 mL二氯甲烷,加入0.01 mg细胞膜红色荧光探针(1, 1’-dioctadecyl-3, 3, 3’, 3’-tetramethylindocarbocyanine perchlorate,DiI),制备具有红色荧光标记的纳米粒,使用FITC标记的cCGPRPPC环肽对纳米粒进行修饰。其余步骤与1.2节下TNP的制备完全相同。采用激光共聚焦显微镜检测纳米粒(DiI红色荧光标记)与环肽(FITC绿色荧光标记)的结合情况。将NP设置为对照组,TNP作为实验组(cCGPRPPC携带FITC标记),用流式细胞仪分别检测其FITC荧光强度。
1.2.3 体外靶向实验本动物实验经重庆医科大学附属第二医院动物伦理委员会批准,并根据重庆医科大学动物保护利用委员会指导原则进行。用无添加剂的干燥真空管对SD大鼠[购自重庆医科大学实验动物中心,动物生产许可证号:SCXK(渝)2018-0003]进行心脏采血。所得的血液样本在37 ℃水浴3 h使其形成血栓。将血栓分成质量为100 mg的小块后分为4组(n≥3),分别置于10 mg/mL的saline-PLGA纳米粒、cCGPRPPC-saline-PLGA纳米粒、NP和TNP悬浊液中(环肽皆为FITC标记的环肽,PLGA外壳均使用DiI染色),并使用低能聚焦超声仪辐照10 min(5 W/cm2,1 s脉冲)。最后用生理盐水反复冲洗血栓,在-25 ℃下将血栓制备成冰冻切片,用共聚焦显微镜观察血栓冰冻切片上纳米粒的附着情况。
1.2.4 体外光声成像实验将生理盐水、cCGPRPPC-PFP-PLGA纳米粒、TNP分别加至容积为200 μL的琼脂凝胶模型中。使用光声成像仪在680~970 nm波段对其进行扫描。再由扫描分析出的最佳波长处采集不同浓度TNP的光声图像,计算光声强度与浓度间的关系。
1.2.5 体外溶栓实验制备体外血栓(制备方法同前),随机分成4组(n≥3)。这些血栓分别用于生理盐水组、cCGPRPPC-saline-PLGA纳米粒组、cCGPRPPC-DiR-PLGA纳米粒组和TNP组的实验中。将生理盐水与等量质量浓度为10 mg/mL的3组纳米粒悬浊液加入到12孔培养板中,再将血栓放入液体中,并使用低能聚焦超声仪辐照30 min(5 W/cm2,1 s脉冲)。于30 min内,每隔5 min对血凝块进行称重,计算其溶栓率。
1.3 大鼠血栓模型建立用戊巴比妥钠麻醉SD大鼠(体重为300~350 g),打开大鼠腹腔,游离下腔静脉,将浸有10%三氯化铁溶液的滤纸片覆盖在下腔静脉上3 min,用生理盐水冲洗腹腔。20 min后即得到相对稳定的大鼠下腔静脉血栓模型。
1.4 纳米粒体内靶向实验将下腔静脉血栓大鼠分成2组,每组3只。分别通过尾静脉向2组大鼠体内注入1 mL质量浓度为5 mg/mL的DiI染色的NP悬浊液(非靶向组)和DiI染色TNP悬浊液(靶向组),待纳米粒在体内循环20~25 min后取下血栓段血管。将该段血管制备为10 μm厚的冰冻切片,在荧光显微镜下观察纳米粒对大鼠体内血栓的靶向作用。
1.5 纳米粒体内光声成像实验构建SD大鼠血栓模型(n=3)。通过尾静脉向大鼠体内注射1 mL质量浓度为5 mg/mL的TNP悬浊液。使用光声成像仪以740 nm波长激发大鼠血栓部位1 min,再使用低能聚焦超声仪辐照(5 W/cm2,1 s脉冲)血栓部位,分别于辐照前及辐照后10、30、50、70 min时获取血栓光声图像。
1.6 统计学处理使用GraphPad Prism 7.0软件进行数据分析处理。计量资料进行正态性检验和方差齐性检验,以x±s表示。在DiR包封率检测实验中,利用线性回归分析法分析纳米粒浓度与光密度的相关性。在体外光声实验中,采用线性回归分析法将纳米粒浓度和对应的光声强度进行线性相关分析。体外溶栓实验中各时间点2组间血栓质量和溶栓率分别采取独立样本t检验进行比较。检验水准(α)为0.05。
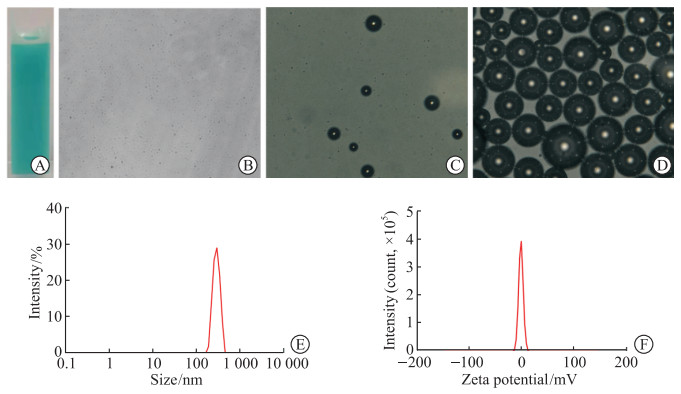
2 结果 2.1 纳米粒的理化性质TNP水溶液呈蓝绿色悬浊液(图 1A),光学显微镜下纳米粒为圆形,其大小均一,分散性好(图 1B)。经低能聚焦超声仪处理后,TNP在光镜下呈相变空泡(图 1C、1D)。测得TNP平均粒径为(262.67±23.46)nm(图 1E),zeta电位为(-1.97±0.68)mV(图 1F),PDI为0.06±0.05。
|
图 1 cCGPRPPC-DiR-PFP-PLGA纳米粒(TNP)的表征 Fig 1 Characteristics of cCGPRPPC-DiR-PFP-PLGA nanoparticles (TNP) A: Photograph of nanoparticles suspension; B: Optical microscopic image of TNP before LIFU irradiation (400×); C: Optical microscopic image of TNP after 1-min LIFU irradiation (400×); D: Optical microscopic image of TNP after 3-min LIFU irradiation (400×); E: Size distribution of TNP; F: Zeta potential distribution of TNP. DiR: 1, 1'-dioctadecyl-3, 3, 3', 3'-tetramethylindotricarbocyanine iodide; PFP: Perfluoropentane; PLGA: Poly(lactic-co-glycolic acid); LIFU: Low-intensity focused ultrasound. |
2.2 DiR的包封率
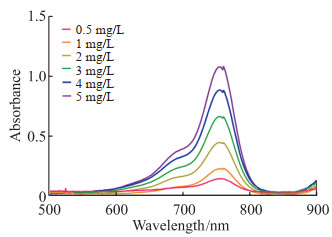
DiR溶液紫外吸收光谱显示浓度越高光密度越大,且不同浓度溶液均在761 nm波长处光密度达到峰值(图 2),DiR溶液浓度(x)与光密度值(y)的线性方程为y=0.212 40x+0.027 16(R2=0.999 6),计算得DiR包封率为(82.00±0.03)%。
|
图 2 不同浓度DiR的紫外吸收光谱 Fig 2 Ultraviolet absorbance spectra of DiR at different concentrations DiR: 1, 1'-dioctadecyl-3, 3, 3', 3'-tetramethylindotricarbocyanine iodide. |
2.3 纳米粒与环肽的连接情况
共聚焦图片(图 3A~3C)显示,FITC-cCGPRPPC呈绿色荧光,DiI染色的NP呈红色荧光,二者叠加呈现出黄色荧光。流式细胞仪检测结果(图 3D)显示,TNP的FITC荧光携带率为(99.58±0.47)%。

|
图 3 纳米粒共聚焦图片及流式细胞仪分析结果 Fig 3 Confocal images of nanoparticles and flow cytometry results A: FITC-labeled cCGPRPPC peptide (400×); B: DiI-labeled nanoparticles (400×); C: Merged image (400×); D: Conjugation rate of FITC-cCGPRPPC peptide with nanoparticles analyzed by flow cytometry. NP: DiR-PFP-PLGA nanoparticle; TNP: cCGPRPPC-DiR-PFP-PLGA nanoparticle; FITC: Fluorescein isothiocyanate; DiI: 1, 1'-dioctadecyl-3, 3, 3', 3'-tetramethylindocarbocyanine perchlorate; DiR: 1, 1'-dioctadecyl-3, 3, 3', 3'-tetramethylindotricarbocyanine iodide; PFP: Perfluoropentane; PLGA: Poly(lactic-co-glycolic acid). |
2.4 纳米粒体外血栓靶向性
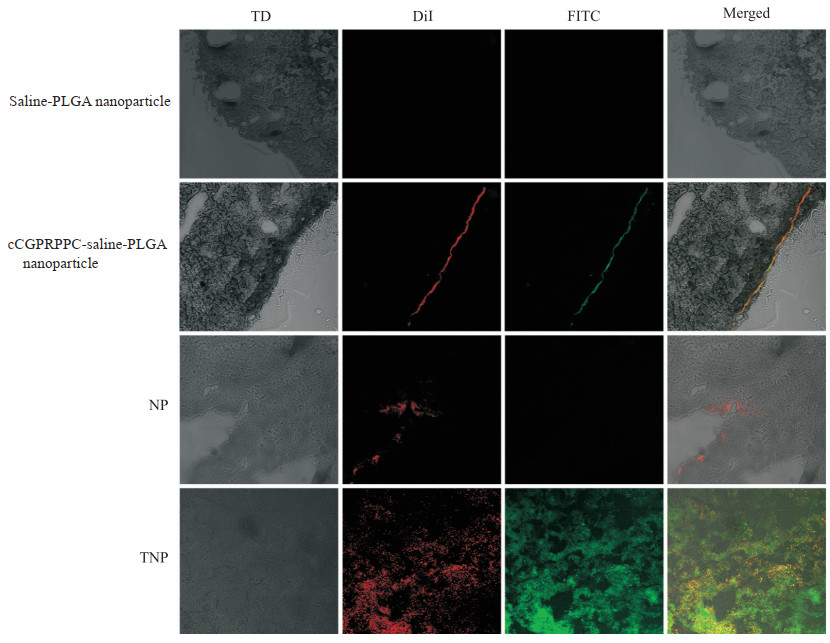
共聚焦显微镜显示,未连接环肽的saline-PLGA纳米粒组和NP组的血栓冰冻切片上均未见明显的红色荧光和绿色荧光信号,仅NP组在边缘存在少许红色荧光;在cCGPRPPC-saline-PLGA纳米粒组血栓冰冻切片边缘上可观察到红、绿荧光和重叠的黄色荧光;TNP组血栓冰冻切片上可观察到大量红、绿荧光以及重叠的黄色荧光信号,其中绿色荧光较红色荧光信号多。见图 4。
|
图 4 共聚焦显微镜观察体外血栓靶向效果(200×) Fig 4 Effect of targeting thrombus in vitro observed under confocal microscope (200×) NP: DiR-PFP-PLGA nanoparticle; TNP: cCGPRPPC-DiR-PFP-PLGA nanoparticle; TD: Transmitted light detector; DiI: 1, 1'-dioctadecyl-3, 3, 3', 3'-tetramethylindocarbocyanine perchlorate; FITC: Fluorescein isothiocyanate; DiR: 1, 1'-dioctadecyl-3, 3, 3', 3'-tetramethylindotricarbocyanine iodide; PFP: Perfluoropentane; PLGA: Poly(lactic-co-glycolic acid). |
2.5 纳米粒体外光声成像
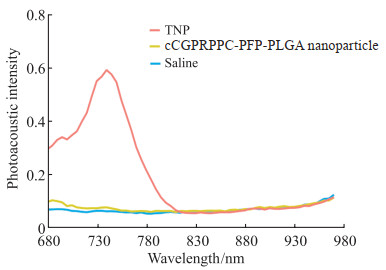
在680~970 nm激发波长下,TNP悬浊液在735 nm波长处光声信号最强(图 5),生理盐水组和cCGPRPPC-PFP-PLGA纳米粒组都没有出现明显的波峰。在735 nm波长激发下TNP的光声效果(y)随着其浓度(x)增大而增强,线性方程为y=0.181 40 x-0.081 83(R2=0.993)。
|
图 5 TNP的体外光声成像 Fig 5 In vitro photoacoustic imaging of TNP TNP: cCGPRPPC-DiR-PFP-PLGA nanoparticle; DiR: 1, 1’-dioctadecyl-3, 3, 3’, 3’-tetramethylindotricarbocyanine iodide; PFP: Perfluoropentane; PLGA: Poly(lactic-co-glycolic acid). |
2.6 纳米粒体外溶栓效果
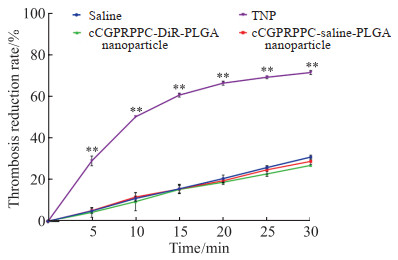
在溶栓实验中,生理盐水组最终的血栓质量为(69.17±0.97)mg,溶栓率为(30.83±0.01)%;cCGPRPPC-saline-PLGA纳米粒组最终的血栓质量为(71.25±1.62)mg,溶栓率为(28.75±0.02)%;cCGPRPPC-DiR-PLGA纳米粒组最终的血栓质量为(73.15 ±0.45)mg,溶栓率为(26.85±0.01)%;TNP组最终的血栓质量为(28.57±1.00)mg,溶栓率为(71.43±1.00)%。在各时间点上,cCGPRPPC-saline-PLGA纳米粒组、cCGPRPPC-DiR-PLGA纳米粒组的血栓质量和溶栓率分别与生理盐水组相比,差异均无统计学意义(P均>0.05);低能聚焦超声仪辐照后,TNP组与生理盐水组的血栓质量和溶栓率比较差异均有统计学意义(P均 < 0.01)。见图 6。
|
图 6 不同时间点TNP的体外溶栓率结果 Fig 6 Thrombolysis rates of TNP in vitro at different time points **P < 0.01 vs saline group. n=3, x±s. TNP: cCGPRPPCDiR-PFP-PLGA nanoparticle. DiR: 1, 1'-dioctadecyl-3, 3, 3', 3'-tetramethylindotricarbocyanine iodide; PFP: Perfluoropentane; PLGA: Poly(lactic-co-glycolic acid). |
2.7 纳米粒体内血栓靶向性
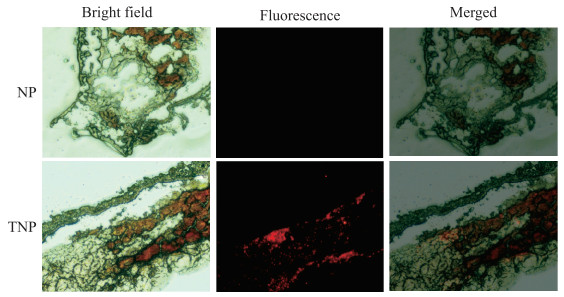
荧光显微镜结果(图 7)显示,NP组血栓冰冻切片上未见红色荧光,而在TNP组血栓冰冻切片上观察到大量的红色荧光信号。
|
图 7 荧光显微镜观察体内血栓靶向效果(40×) Fig 7 Targeting thrombus effect in vivo observed under fluorescence microscope (40×) NP: DiR-PFP-PLGA nanoparticle; TNP: cCGPRPPC-DiR-PFP-PLGA nanoparticle; DiR: 1, 1'-dioctadecyl-3, 3, 3', 3'-tetramethylindotricarbocyanine iodide; PFP: Perfluoropentane; PLGA: Poly(lactic-co-glycolic acid). |
2.8 体内血栓光声成像
光声图像(图 8)显示,随低能聚焦超声仪辐照时间延长血栓部位光声信号强度不断降低。在0、10、30、50和70 min时,大鼠血栓部位光声信号强度分别为1.08±0.13、0.66±0.02、0.49±0.01、0.48±0.03和0.36±0.02。

|
图 8 不同辐照时间体内血栓的光声成像结果 Fig 8 Photoacoustic imaging of thrombus in vivo at different irradiation times A-E: 0, 10, 30, 50 and 70 min under low-intensity focused ultrasound irradiation, respectively. |
3 讨论
血栓是心血管疾病致残、致死的主要原因[9],因此探索更加优化的血栓诊断和治疗方法仍是研究的热点。本实验制备了靶向血栓的TNP,并进行体外、体内实验对其靶向血栓能力、光声成像作用和溶栓效果进行探究。该纳米粒在光镜下为圆形,大小均一,粒径为(262.67±23.46)nm。Zhong等[10]制备了以全氟己烷为内核的纳米粒用于血栓的诊疗,粒径为(311.3±4.3)nm,大于TNP的粒径。研究表明,纳米粒粒径越大就越容易被网状内皮系统捕获,减小纳米粒粒径可增加其血液循环时间,而且更容易进入组织内部[11]。然而纳米粒粒径越小相变难度越大。唐琴等[12]证明,PFP内核纳米粒与全氟己烷内核纳米粒相比仅需更低能量就可出现ADV现象。本实验采用PFP为纳米粒内核,使小粒径纳米粒在低能聚焦超声仪辐照后成功相变。光镜下观察到TNP经低能聚焦超声仪辐照后呈空泡状,证明PFP成功包载在TNP内,且低能聚焦超声仪辐照后PFP内核产生液-气相变,实现空化效应。
本实验用cCGPRPPC环肽修饰NP得到TNP,用共聚焦激光显微镜观查TNP呈黄色荧光,用流式细胞仪检测其环肽的携带率高达(99.58±0.47)%,证明环肽成功地连接在纳米粒上,其携带率与宣吉晴等[13]使用碳二亚胺法修饰纳米粒所得环肽携带率(99.66%)相近。多肽的修饰能够赋予纳米粒靶向性[14],cCGPRPPC是一种可以靶向血栓的多肽,它可以与血栓纤维蛋白结合[15]。Ma等[16]对比了靶向血栓血小板的微泡和纳米粒的血栓穿透深度,结果显示后者粒径更小,在超声的作用下比微泡更易进入血栓内部。由于TNP粒径约为262.67 nm,理论上该纳米粒可以与血栓表面的纤维蛋白结合并进入血栓深部,本实验又以低能聚焦超声仪辐照TNP,其产生的相变作用可造成血栓破坏,使血栓与纳米粒有更大的接触面积,纳米粒更容易进入血栓内部。在体外血栓靶向性实验中,未经环肽修饰的空白纳米粒(saline-PLGA纳米粒)组和载药纳米粒(NP)组的血栓冰冻切片上均未见明显的红色荧光和绿色荧光信号,仅NP组在边缘存在少许分散红色荧光;经过环肽修饰的空白纳米粒(cCGPRPPC-saline-PLGA纳米粒)组和TNP组血栓冰冻切片可观察到红、绿荧光和重叠的黄色荧光。这可以证明cCGPRPPC环肽的修饰可赋予纳米粒对血栓的靶向能力。与cCGPRPPC-saline-PLGA纳米粒组相比,TNP组纳米粒穿透深度更深,这证明由PFP导致的相变会使血栓破坏,血栓能够更大面积地接触到纳米粒。另外,实验发现与TNP组纳米粒孵育的血栓冰冻切片上绿色荧光较红色荧光多,这是由于低能聚焦超声仪的辐照使纳米粒相变破裂,破裂的纳米粒经生理盐水反复冲洗后掉落,但环肽可能还结合在纤维蛋白上(显示绿色荧光)。综上,TNP成功地包载了PFP,并被cCGPRPPC环肽修饰,环肽修饰后的纳米粒对体外血栓具有靶向能力。
TNP载有近红外荧光染料DiR,包封率达到(82.00±0.03)%。光声成像实验证明TNP具有良好的光声效果,且其光声信号强度与浓度呈线性关系。在血栓形成过程中,血栓局部血红蛋白量会明显减少,造成血栓部位的光声信号较正常血流的光声信号低[17]。Li等[18]利用这种光声信号差异对血栓进行间接成像。而本实验合成的TNP可靶向血栓且具备光声成像能力,使血栓部位直接产生光声信号,血栓的检测更加直观。
体外溶栓实验结果表明,cCGPRPPC-saline-PLGA纳米粒组、cCGPRPPC-DiR-PLGA纳米粒组与生理盐水组相比血栓质量未见明显减少,溶栓效果不明显。然而TNP组血栓质量较生理盐水组减少明显(P < 0.01),且TNP组溶栓率随低能聚焦超声仪辐照时间的延长而不断增高,这表明TNP对血栓的溶解作用依赖于PFP相变产生的空化效应。空化效应可促进血栓纤维蛋白断裂[19],使血栓体积减小。TNP具有良好的溶栓效果,但并未包载溶栓药物,这避免了溶栓药物引起全身性出血的风险,同时也避免了介入治疗取栓等操作带来的损伤[20]。
在体内血栓靶向性实验中,NP组血栓切片上未见红色荧光信号,而TNP组血栓切片上可观察到明显的红色荧光信号,这证明cCGPRPPC环肽修饰的纳米粒在大鼠体内对血栓也具有靶向性,与体外靶向实验结果一致。在体内光声成像实验中,大鼠血栓部位可见明显的光声信号,且光声信号强度随低能聚焦超声仪辐照时间的延长不断减弱,可以认为TNP使大鼠血栓部位出现光声信号,且在低能聚焦超声仪的辐照下对体内血栓有一定的溶解作用。
综上,本实验成功制备了靶向血栓的诊疗纳米粒TNP,其具有良好的体内外血栓靶向、光声成像和溶栓能力,具有广阔的临床应用前景。本研究仍存在一些不足,TNP的溶栓机制、体内药物代谢动力学情况、体内安全性等问题仍需进一步探究。
| [1] |
LAMMERS T, AIME S, HENNINK W E, STORM G, KIESSLING F. Theranostic nanomedicine[J]. Acc Chem Res, 2011, 44: 1029-1038. DOI:10.1021/ar200019c |
| [2] |
XIE J, LEE S, CHEN X. Nanoparticle-based theranostic agents[J]. Adv Drug Deliv Rev, 2010, 62: 1064-1079. DOI:10.1016/j.addr.2010.07.009 |
| [3] |
LOPEZ A D, MATHERS C D, EZZATI M, JAMISON D T, MURRAY C J. Global and regional burden of disease and risk factors, 2001:systematic analysis of population health data[J]. Lancet, 2006, 367: 1747-1757. DOI:10.1016/S0140-6736(06)68770-9 |
| [4] |
MACKMAN N. Triggers, targets and treatments for thrombosis[J]. Nature, 2008, 451: 914-918. DOI:10.1038/nature06797 |
| [5] |
LIU J, SHANG T, WANG F, CAO Y, HAO L, REN J, et al. Low-intensity focused ultrasound (LIFU)-induced acoustic droplet vaporization in phase-transition perfluoropentane nanodroplets modified by folate for ultrasound molecular imaging[J]. Int J Nanomedicine, 2017, 12: 911-923. DOI:10.2147/IJN.S122667 |
| [6] |
XU J, ZHOU J, ZHONG Y, ZHANG Y, LIU J, CHEN Y, et al. Phase transition nanoparticles as multimodality contrast agents for the detection of thrombi and for targeting thrombolysis: in vitro and in vivo experiments[J]. ACS Appl Mater Interfaces, 2017, 9: 42525-42535. DOI:10.1021/acsami.7b12689 |
| [7] |
LI Y H, WU Y X, CHEN J T, WAN J L, XIAO C, GUAN J K, et al. A simple glutathione-responsive turn-on theranostic nanoparticle for dual-modal imaging and chemo-photothermal combination therapy[J]. Nano Lett, 2019, 19: 5806-5817. DOI:10.1021/acs.nanolett.9b02769 |
| [8] |
DENG L, CAI X, SHENG D, YANG Y, STROHM E M, WANG Z, et al. A laser-activated biocompatible theranostic nanoagent for targeted multimodal imaging and photothermal therapy[J]. Theranostics, 2017, 7: 4410-4423. DOI:10.7150/thno.21283 |
| [9] |
WOLBERG A S, ROSENDAAL F R, WEITZ J I, JAFFER I H, AGNELLI G, BAGLIN T, et al. Venous thrombosis[J/OL]. Nat Rev Dis Primers, 2015, 1: 15006. DOI: 10.1038/nrdp.2015.6.
|
| [10] |
ZHONG Y X, ZHANG Y, XU J, ZHOU J, LIU J, YE M, et al. Low-intensity focused ultrasound-responsive phase-transitional nanoparticles for thrombolysis without vascular damage: a synergistic nonpharmaceutical strategy[J]. ACS Nano, 2019, 13: 3387-3403. DOI:10.1021/acsnano.8b09277 |
| [11] |
ZHOU Y, WANG Z, CHEN Y, SHEN H, LUO Z, LI A, et al. Microbubbles from gas-generating perfluorohexane nanoemulsions for targeted temperature-sensitive ultrasonography and synergistic HIFU ablation of tumors[J]. Adv Mater, 2013, 25: 4123-4130. DOI:10.1002/adma.201301655 |
| [12] |
唐琴, 朱深银, 常淑芳, 崔健毓, 田中华, 孙江川, 等. 两种相变型多功能纳米粒的制备及体外特性比较[J]. 中国介入影像与治疗学, 2016, 13: 636-641. |
| [13] |
宣吉晴, 陈瑜莉, 敖梦, 王志刚, 郑元义, 汪朝霞, 等. 携带cRGD肽的靶向纳米粒超声造影剂的制备以及体外寻靶实验研究[J]. 中国医学影像技术, 2017, 33: 810-815. |
| [14] |
LIU M Z, ZHANG P, DENG L M, GUO D, TAN M X, HUANG J, et al. IR780-based light-responsive nanocomplexes combining phase transition for enhancing multimodal imaging-guided photothermal therapy[J]. Biomater Sci, 2019, 7: 1132-1146. DOI:10.1039/C8BM01524D |
| [15] |
REZAEIANPOUR S, BOZORGI A H, MOGHIMI A, ALMASI A, BALALAIE S, RAMEZANPOUR S, et al. Synthesis and biological evaluation of cyclic[99mTc]-HYNIC-CGPRPPC as a fibrin-binding peptide for molecular imaging of thrombosis and its comparison with[99mTc]-HYNIC-GPRPP[J]. Mol Imaging Biol, 2017, 19: 256-264. DOI:10.1007/s11307-016-1004-3 |
| [16] |
MA L, WANG Y, ZHANG S, QIAN X, XUE N, JIANG Z, et al. Deep penetration of targeted nanobubbles enhanced cavitation effect on thrombolytic capacity[J]. Bioconjug Chem, 2020, 31: 369-374. DOI:10.1021/acs.bioconjchem.9b00653 |
| [17] |
CUI C, YANG Z, HU X, WU J, SHOU K, MA H, et al. Organic semiconducting nanoparticles as efficient photoacoustic agents for lightening early thrombus and monitoring thrombolysis in living mice[J]. ACS Nano, 2017, 11: 3298-3310. DOI:10.1021/acsnano.7b00594 |
| [18] |
LI B, FU C, MA G S, FAN Q L, YAO Y Y. Photoacoustic imaging: a novel tool for detecting carotid artery thrombosis in mice[J]. J Vasc Res, 2017, 54: 217-225. |
| [19] |
BRÜßLER J, STREHLOW B, BECKER A, SCHUBERT R, SCHÜMMELFEDER J, NIMSKY C, et al. Nanoscaled ultrasound contrast agents for enhanced sonothrombolysis[J]. Colloids Surf B Biointerfaces, 2018, 172: 728-733. DOI:10.1016/j.colsurfb.2018.09.037 |
| [20] |
KLUFT C, SIDELMANN J J, GRAM J B. Assessing safety of thrombolytic therapy[J]. Semin Thromb Hemostasis, 2017, 43: 300-310. |
 2021, Vol. 42
2021, Vol. 42


