2. 温州医科大学附属第一医院针推理疗科, 温州 325000
2. Department of Acupuncture, Tuina and Physiotherapy, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou 325000, Zhejiang, China
类风湿关节炎(rheumatoid arthritis, RA)是一种慢性进行性自身免疫性疾病,目前其发病机制尚不明确,但病理改变严重,可造成关节滑膜炎、血管翳形成及进行性关节软骨和骨破坏,最终会产生关节畸形和功能丧失等不可逆损害。我国RA发病率为0.42%,总患病人群约500万,男女患病比例约为1∶4[1]。RA关节不可逆损害的主要原因在于破骨细胞造成的多关节局灶性骨侵蚀[2]。NF-κB/p38 MAPK信号通路及活化T细胞核因子1(nuclear factor-activated T cell 1, NFATc1)的顺序活化和去磷酸化可刺激诱导破骨细胞分化成熟[3-5],是研究RA发病机制和治疗靶点的重要思路。
中国传统针灸以其安全、有效的特点逐渐成为全球RA患者主要的替代疗法之一[6]。动物和细胞实验研究发现,持续电针刺激可上调胞外腺苷激活腺苷A2A受体(A2A adenosine receptor, A2AR)产生抗炎镇痛效应及减轻关节损害作用,并且A2AR竞争性抑制了p38 MAPK信号通路[7-9]。本课题组前期研究发现电针能通过激活A2AR抑制RA大鼠体内ERK1/2、NF-κB来减少破骨细胞生成,但该变化可被A2AR拮抗剂逆转[10]。本研究通过观察电针对胶原诱导性关节炎(collagen-induced arthritis, CIA)大鼠模型关节的病理形态学及滑膜组织中A2AR、p38、磷酸化p38(phosphorylated p38, P-p38)、NF-κB、NFATc1表达水平的影响,并以RA经典药物甲氨蝶呤(methotrexate, MTX)作为阳性对照药物,探讨电针改善CIA大鼠关节炎症及骨侵蚀的作用机制。
1 材料和方法 1.1 实验动物SPF级成年雄性SD大鼠(体重200~250 g),由北京维通利华实验动物技术有限公司提供[实验动物生产许可证号:SCXK(京)2016-0011]。饲养环境室温为22~25 ℃、相对湿度为50%左右、合理光照强度,大鼠自由饮用过滤自来水、摄取普通饲料。实验过程遵循国家动物伦理相关规范,并通过温州医科大学实验动物中心管理与伦理委员会审查(wydw2019-0961)。动物实验结束后严格按照中华人民共和国科技部2006年颁布的《关于善待实验动物的指导性意见》[11],对所有大鼠尸体进行及时、统一、无害化处理。
1.2 主要试剂及仪器设备主要试剂:不完全弗氏佐剂(美国Chondrex公司,货号:7002),完全弗氏佐剂(美国Chondrex公司,货号:7023),胎牛Ⅱ型胶原(美国Chondrex公司,货号:20022),H-E染色试剂盒(北京索莱宝科技有限公司,货号:G1120-100),改良番红O-固绿染色试剂盒(北京索莱宝科技有限公司,货号:G1371-100),抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase, TRAP)染色试剂盒(北京索莱宝科技有限公司,货号:G1492),BCA蛋白浓度测定试剂盒(上海碧云天生物科技有限公司,货号:P0010),β-actin抗体(武汉三鹰生物技术有限公司,货号:20536-1-AP),NF-κB p65抗体(英国Abcam公司,货号:ab16502),NFAT2抗体(英国Abcam公司,货号:ab175134),p38抗体[M138](英国Abcam公司,货号:ab31828),P-p38[phospho Y182]抗体(英国Abcam公司,货号:ab47363),A2AR抗体(英国Abcam公司,货号:ab3461),山羊抗兔HRP-IgG H & L(英国Abcam公司,货号:ab205718),山羊抗小鼠IgG H & L(英国Abcam公司,货号:ab205719),MTX(美国MCE公司,货号:HY-14519),IL-1β ELISA试剂盒(上海梓正生物科技有限公司,货号:BP-E30419-48t)。主要仪器设备:KWD-808电针仪(常州市武进长城医疗器械有限公司),石蜡组织切片机(英国Shandon公司),光学显微镜(德国徕卡显微系统贸易公司),凝胶成像系统、垂直电泳系统(美国Bio-Rad公司),高级分析倒置显微镜(日本Nikon公司),THERMO Varioskan Flash全波长多功能酶标仪(中国赛默飞世尔科技有限公司)。
1.3 CIA大鼠模型的建立采用胎牛Ⅱ型胶原与弗氏佐剂混合液2次注射免疫复制CIA大鼠模型。成年健康雄性SD大鼠适应性喂养7 d后,采用随机抽号法分为CIA造模组(n=42)和对照组(n=8)。CIA造模方法:将胎牛Ⅱ型胶原蛋白和完全弗氏佐剂按1∶1的比例制成混合液,每只大鼠在尾根部1.5 cm处多点皮内注射混合液0.2 mL;将胎牛Ⅱ型胶原蛋白和不完全弗氏佐剂按1∶1的比例制成混合液,于首次免疫后第14天进行第2次免疫注射,每只大鼠在尾根部0.5 cm处多点皮内注射混合液0.15 mL。对照组大鼠按相同方法注射等剂量生理盐水。根据关节炎指数(arthritis index, AI)积分表[8]判断造模是否成功。
1.4 分组治疗首次免疫后第30天,将24只造模成功的CIA大鼠根据随机数字表法随机分为模型组、药物组和电针组,每组8只。将DMSO、聚乙二醇300、吐温-80、生理盐水按1∶4∶0.5∶4.5的比例配制成溶剂,用配制好的溶剂将MTX溶解成1 mg/mL的溶液。(1)对照组与模型组:用自制布袋[12]固定20 min/d,同时予腹膜腔注射与药物组等剂量的溶剂,每7 d 1次,持续注射14 d。(2)药物组:用自制布袋固定20 min/d,同时予腹膜腔注射MTX 2 mg/kg,每7 d 1次[13],持续注射14 d。(3)电针组:用自制布袋固定20 min/d,同时予电针刺激,参照《实验针灸学实验指导》[14]选取大鼠后肢双侧足三里和三阴交,用环球牌不锈钢针灸针(0.25 mm×13 mm)垂直进针,进针后于同侧两穴接KWD-808电针仪,2/100 Hz疏密波,输出电流2 mA,干预20 min/d,持续治疗14 d;同时予腹膜腔注射等量溶剂,每7 d 1次,持续注射14 d。
1.5 CT观察治疗结束后,立即将大鼠分批腹腔注射2%戊巴比妥钠(50 mg/kg)麻醉,仰卧位固定,使用CT仪沿长轴对大鼠足踝关节进行扫描,观察骨密度的变化和骨质破坏情况。
1.6 取材治疗结束后,大鼠禁食过夜,再次麻醉,从心脏缓慢抽取1.2~1.5 mL血液后,颈椎脱臼法处死并快速抽取剩余血量。血液于4 ℃冰箱里静置2 h,4 ℃下3 000 r/min(离心半径6 cm)离心15 min,分离血清,-80 ℃冰箱保存。剥离右侧膝关节滑膜组织,快速用液氮冷冻处理后于-80 ℃冰箱中保存。截取左侧膝关节,用预冷PBS清洗干净后,于4%多聚甲醛溶液中固定1周,再置入10% EDTA溶液中脱钙处理30 d,然后行石蜡包埋、切片,切片厚度为5 μm。
1.7 膝关节病理形态学染色观察(1)H-E染色:每个膝关节组织取3张切片脱蜡至水,行H-E染色,脱水、透明,中性树脂封片,光学显微镜下观察滑膜细胞形态、炎症细胞浸润、血管翳增生、骨质变化等情况。(2)番红O-固绿染色:每个膝关节组织取3张切片脱蜡至水,行番红O-固绿染色,脱水、透明,中性树脂封片,光学显微镜下观察软骨结构、软骨细胞形态等。(3)TRAP染色:每个膝关节组织取3张切片脱蜡至水,行TRAP染色,脱水、透明,中性树脂封片,光学显微镜下观察破骨细胞及其细胞核,并在200×镜下进行计数。
1.8 蛋白质印迹法检测膝关节滑膜组织中A2AR、p38、P-p38、NF-κB、NFATc1蛋白表达于冰上将膝关节滑膜组织尽量剪碎后放入已消毒的研钵中,加入液氮并反复研磨至细腻粉末状。收集粉末,加入裂解混合液,用组织匀浆器充分裂解,4 ℃静置1 h,4 ℃下1 2000 r/min(离心半径6 cm)离心10 min。使用BCA蛋白浓度测定试剂盒测定蛋白浓度后进行蛋白变性,每个样本用PBS配制100 μL蛋白上样体系。按照操作规范依次进行电泳、转膜,4 ℃脱脂牛奶封闭过夜;分别加入A2AR、p38、P-p38、NFATc1、NF-κB、β-actin抗体(稀释比例均为1∶1 000),4 ℃孵育过夜;用相应二抗(山羊抗兔IgG或山羊抗小鼠IgG,稀释比例均为1∶5 000)室温下慢摇孵育1 h。用TBST充分洗膜后曝光。以β-actin为内参照进行半定量分析。
1.9 ELISA法测定外周血清中IL-1β水平将待测血清样本平衡到室温至少30 min,严格根据ELISA试剂盒说明书规范操作,检测各组大鼠外周血清中IL-1β的含量。
1.10 统计学处理采用SPSS 22.0软件分析数据。计量资料以x±s表示,采用两因素方差分析进行组间差异比较,多重比较采用最小显著性差异法或Dunnett-t检验。检验水准(α)为0.05。
2 结果 2.1 各组大鼠后足骨质破坏情况比较对照组大鼠后足骨密度及骨的空间结构均匀,有清晰的骨骼边缘,足关节和踝关节结构完整(图 1A)。模型组大鼠的后足骨密度和空间结构严重受损,关节边缘界限模糊不清,关节间隙严重狭窄、变形,周围软组织明显增厚;足骨可观察到明显虫蚀样改变,产生骨空洞,骨小梁变薄,甚至出现断裂(图 1B)。电针组和药物组大鼠后足虽仍可见骨质受损与关节边缘融合情况,但较模型组关节结构破坏有所改善,骨空洞明显减少(图 1C、1D)。
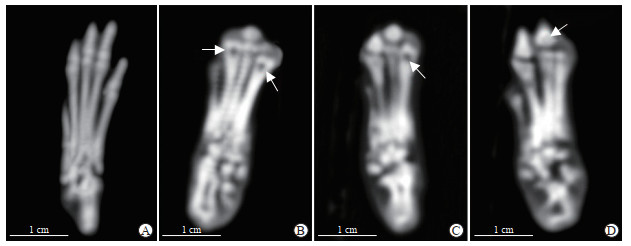
|
图 1 各组大鼠后足CT影像 Fig 1 CT images of hind feet of rats in each group A: Control group; B: Collagen-induced arthritis model group; C: Methotrexate-treated group; D: Electroacupuncture-treated group. The arrows indicate bone erosion. CT: Computed tomography. |
2.2 各组大鼠膝关节滑膜组织病理形态学比较
对照组大鼠膝关节结构形态正常,关节面光滑平整,无软骨和骨质侵蚀改变,未见明显炎症细胞浸润,关节腔滑膜细胞排列整齐,未见异常增殖(图 2A)。模型组大鼠膝关节结构形态紊乱,关节软骨表面凹凸不平,软骨和骨质破坏明显,腔隙内出现大面积淋巴细胞浸润(表现为鲜明蓝色点状聚集分布),以单核细胞和淋巴细胞为主,滑膜组织过度增生、水肿并伴有大量血管翳生成(表现为滑膜增厚处绒毛样突起),引起关节腔腔隙狭窄(图 2B)。药物组大鼠膝关节结构破坏程度和腔隙狭窄情况较模型组明显减轻,镜下可见滑膜细胞层略有增加,存在少量的局部炎症细胞浸润,滑膜内血管偶有发生改变,但没有明显血管翳形成及软骨骨质破坏(图 2C)。电针组大鼠膝关节结构破坏程度和腔隙狭窄情况较模型组明显改善,滑膜细胞增殖且组织形态发生改变,同时存在少量炎症细胞浸润,滑膜内血管略扩张,无明显血管翳增生,关节软骨表面略有改变,骨皮质无明显侵蚀(图 2D)。
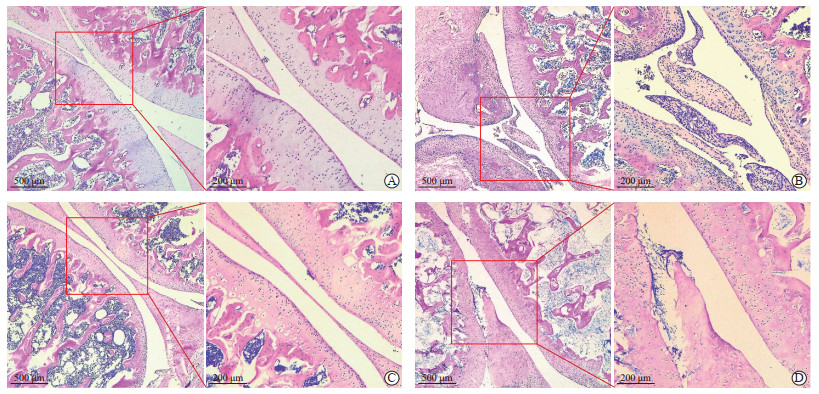
|
图 2 各组大鼠膝关节滑膜组织H-E染色结果 Fig 2 H-E staining of synovium of rat knee joint in each group A: Control group; B: Collagen-induced arthritis model group; C: Methotrexate-treated group; D: Electroacupuncture-treated group. H-E: Hematoxylin-eosin. |
2.3 各组大鼠膝关节软骨组织的病理形态学比较
对照组软骨组织结构完整,软骨表面光滑,全层着色鲜明均匀,软骨与骨的界限清晰,软骨细胞形态正常(图 3A)。模型组软骨组织结构破坏明显,软骨多层面出现裂隙,软骨与骨的界面消失,出现血管翳和炎症细胞浸润并侵蚀软骨,大部分软骨细胞受损,软骨表层、中层及深层着色明显丢失,表明软骨中蛋白多糖大量丢失(图 3B)。药物组软骨组织结构破坏程度较模型组明显改善,没有明显血管翳形成,软骨与骨的界面存在,无裂隙出现,局部软骨细胞减少,表层着色存在丢失(图 3C)。电针组软骨组织结构破坏程度较模型组明显改善,软骨与骨的界面存在,无明显血管翳增生,软骨表面结构不规则,出现破损,表层及中层着色丢失(图 3D)。
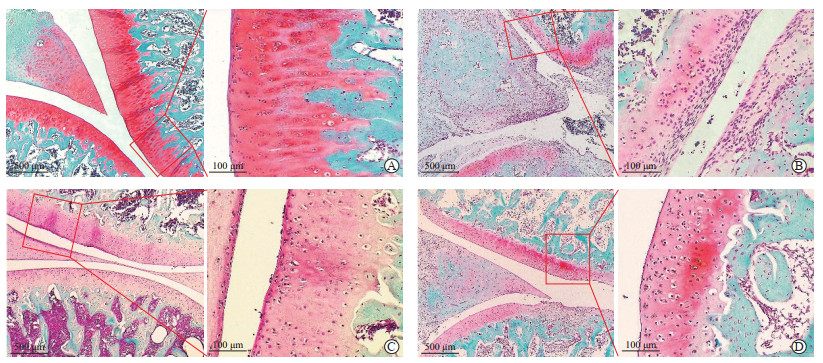
|
图 3 各组大鼠膝关节软骨组织番红O-固绿染色结果 Fig 3 Safranin O-fast green staining of cartilage of rat knee joint in each group A: Control group; B: Collagen-induced arthritis model group; C: Methotrexate-treated group; D: Electroacupuncture-treated group. |
2.4 各组大鼠膝关节组织破骨细胞数目比较
对照组大鼠膝关节中TRAP阳性的破骨细胞数目较少(图 4A),为(16.80±1.30)个。模型组大鼠膝关节中存在大量破骨细胞(图 4B),为(35.60±2.41)个,与对照组比较差异有统计学意义(P<0.01),且多数为成熟的破骨细胞(细胞核≥3个)。药物组(图 4C)和电针组(图 4D)大鼠膝关节中破骨细胞数目明显减少,分别为(24.40±1.82)和(27.60±1.14)个,与模型组比较差异均有统计学意义(P均<0.01),单细胞核的破骨细胞数量增加;药物组的破骨细胞数目少于电针组(P<0.05)。
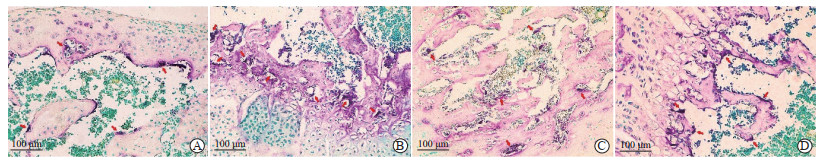
|
图 4 各组大鼠膝关节破骨细胞TRAP染色结果 Fig 4 TRAP staining of osteoclasts of rat knee joint in each group A: Control group; B: Collagen-induced arthritis model group; C: Methotrexate-treated group; D: Electroacupuncture-treated group. Red arrows indicate mature osteoclasts. TRAP: Tartrate-resistant acid phosphatase. |
2.5 各组大鼠膝关节滑膜组织中A2AR、p38、P-p38、NF-κB、NFATc1的蛋白表达比较
与对照组比较,模型组大鼠膝关节滑膜组织中A2AR、p38、P-p38、NF-κB、NFATc1蛋白表达量均升高(P均<0.01)。与模型组比较,电针组和药物组大鼠膝关节滑膜组织中A2AR蛋白表达量均升高(P均<0.01),p38、P-p38、NF-κB、NFATc1蛋白表达量均降低(P均<0.01)。与药物组比较,电针组大鼠膝关节滑膜组织中A2AR蛋白表达量降低(P<0.01),而NF-κB、NFATc1蛋白表达量升高(P均<0.05);虽然电针组p38的表达量与药物组相比差异无统计学意义(P>0.05),但电针组激活后的p38(P-p38)蛋白表达量高于药物组(P<0.05)。见图 5。
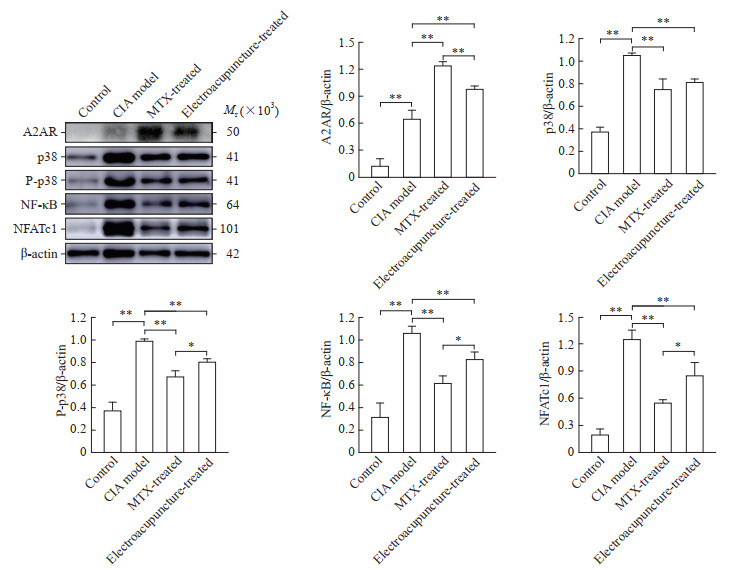
|
图 5 各组大鼠膝关节滑膜组织中A2AR、p38、P-p38、NF-κB、NFATc1蛋白表达 Fig 5 Expression of A2AR, p38, P-p38, NF-κB and NFATc1 in synovium of rat knee joint in each group Protein expression was detected by Western blotting when β-actin was the quantitative standard. *P < 0.05, **P < 0.01. n=8, x±s. A2AR: A2A adenosine receptor; P-p38: Phosphorylated p38; NF-κB: Nuclear factor κB; NFATc1: Nuclear factor-activated T cell 1; CIA: Collagen-induced arthritis; MTX: Methotrexate. |
2.6 各组大鼠外周血清中IL-1β水平比较
对照组大鼠血清中IL-1β含量为(11.71±1.80)ng/L;模型组大鼠血清中IL-1β含量为(37.77±4.83)ng/L,较对照组升高(P<0.01);药物组和电针组大鼠血清中IL-1β含量分别为(24.71±0.84)、(23.03±3.09)ng/L,均较模型组降低(P均<0.01),且电针组和药物组之间差异无统计学意义(P>0.05)。
3 讨论RA属中医痹症范畴,最早记载于《内经•素问》中:“风寒湿三气杂至,合而为痹也。其风气胜者为行痹,寒气胜者为痛痹,湿气胜者为着痹也。”近年研究表明针灸疗法可调节CIA大鼠模型体内异常的细胞因子水平及其mRNA表达,特别是对致炎与抗炎因子分别起到抑制和促进作用,有较好的镇痛疗效[15]。TNF-α和IL-1β作为促炎介质在RA的炎性病理过程、滑膜增生与关节破坏中起着重要作用,本课题组前期研究通过小鼠CIA模型发现,电针刺激足三里、三阴交等穴位能够有效降低TNF-α和IL-1β水平,发挥抗炎效应并减轻小鼠关节损害[7]。根据《针灸大成》《针灸经纶》中的论述,电针这2个穴位即从调理肝脾肾气血入手,使“正气存内,邪不可干”。足三里是足阳明胃经上治疗RA使用频率最高的穴位,具有通经活络、祛风除湿、化瘀止痛的功效,可贯穿应用于RA的整个治疗时段[16]。已有研究报道电针刺激足三里能使CIA模型大鼠血清中的IL-6、TNF-α、干扰素γ等含量明显下降,并发挥抗炎作用,减轻对关节的侵蚀作用[13]。三阴交作为足三阴经的交会穴,有清热利湿、补脾益肾的作用。电针刺激三阴交独穴即可通过Toll样受体(Toll-like receptor, TLR)/髓样分化因子88(myeloid differentiation factor 88, MYD88)信号通路减轻急性痛风性关节炎大鼠足踝的疼痛肿胀等[17]。本研究结果显示,CIA模型大鼠经电针刺激足三里、三阴交穴位后外周血清中IL-1β的水平明显下调,结合既往研究结果,提示电针可能有效抑制了CIA模型大鼠体内的炎症反应,从而改善CIA模型大鼠的炎症性疼痛。
本研究从膝关节的滑膜组织、软骨和骨3个主要组成部分研究电针干预后CIA模型大鼠的病理形态学改变。结果显示,电针干预后大鼠滑膜组织的病理情况得到改善,关节腔内炎症细胞浸润和滑膜细胞异常增殖明显缓解。同时,电针干预减少了膝关节软骨中深层蛋白多糖的丢失。这些结果表明电针对CIA引发的关节组织病理损伤有良好的治疗效果,能在一定程度上抑制关节的进行性损害,尤其是早期滑膜组织和软骨病变。此外,局灶性骨侵蚀是引起RA不可逆关节软骨和骨侵蚀的主要因素之一,且这种骨侵蚀多依赖于破骨细胞的骨吸收功能[18]。本研究结果表明电针干预可减轻CIA模型大鼠后足骨质损害,并且TRAP阳性的破骨细胞数目明显减少,且单细胞核的破骨细胞数量增加,表明电针可减少破骨细胞生成。
MAPK信号通路能够调节破骨细胞活性,对研究破骨细胞的分化和成熟尤为重要[19],其经典通路之一p38 MAPK途径是破骨细胞形成的一条重要途径[20]。NF-κB活化对于破骨细胞的形成和成熟至关重要,研究发现缺乏NF-κB时不会出现TRAP阳性破骨细胞[21]。p38 MAPK激活后,p38发生磷酸化,经过一系列生化反应使NF-κB的转录活性增强,促进NF-κB受体激活剂配体诱导的破骨细胞形成[22]。NFATc1作为入核刺激破骨细胞分化的关键特异性表达基因,与p38 MAPK磷酸化和NF-κB密切相关[23]。p38 MAPK、NF-κB和NFATc1阶梯式磷酸化和活化是破骨细胞生成的枢纽之一,并被认为是RA的一条关键通路[24]。A2AR是一种具有明显抗炎作用的腺苷受体[10]。在CIA动物实验中发现,A2AR激动剂能够减缓病情进展、抑制IL-1β表达[25]。Varani等[26]发现RA患者疾病活动评分和淋巴细胞上A2AR表达水平呈负相关;使用A2AR激动剂体外干预RA患者淋巴细胞后,TNF-α、IL-1β等释放减少,提示A2AR激动剂有望成为RA患者治疗的新药物。
本研究选择MTX干预作为阳性对照。MTX是目前临床用于治疗RA的主要药物,其可能主要通过腺苷发挥抗炎效应,并且MTX可以使细胞内外腺苷浓度保持在高水平,但这种作用能被A2A拮抗剂所消除[13]。实验证明MTX干预可以使CIA大鼠滑膜组织中p38和P-p38蛋白表达降低[27]。前期本课题组在这些理论的基础上展开研究,发现电针干预CIA大鼠后可使腺苷在细胞外空间不断累积并保持较高水平,从而激活A2AR等受体而发挥抗炎及减轻关节损害作用[7-8]。亦有研究显示电针刺激足三里可抑制完全弗氏佐剂所诱导的炎症性疼痛反应及p38 MAPK激活[28]。在本研究中,电针组与药物组大鼠膝关节滑膜组织中A2AR的表达均较模型组上调,即电针可能在一定程度上增强了A2AR的活化。此外,电针组与药物组大鼠膝关节滑膜组织中p38、P-p38、NF-κB和NFATc1的表达水平较模型组均有不同程度的降低;电针组与药物组大鼠膝关节滑膜组织中p38的表达水平相似,但电针组P-p38蛋白表达水平高于药物组。上述结果提示电针治疗RA可能具有与MTX治疗相似的机制,即通过激活A2AR、抑制p38 MAPK通路而减少破骨细胞生成。
综上所述,本研究结果显示电针刺激CIA模型大鼠足三里、三阴交可能是通过激活A2AR后抑制p38 MAPK通路而减少破骨细胞生成,继而减轻关节炎损害程度。但电针激活A2AR抑制破骨细胞分化的p38信号通路机制是否有其他关键细胞因子参与尚不明确,激活A2AR与抑制破骨细胞生成的p38 MAPK通路之间的阶梯性联系仍需进一步阐明,后期实验中有必要通过A2AR和p38基因敲除模型或应用拮抗剂进一步探讨。
| [1] |
中华医学会风湿病学分会. 2018中国类风湿关节炎诊疗指南[J]. 中华内科杂志, 2018, 57: 242-251. DOI:10.3760/cma.j.issn.0578-1426.2018.04.004 |
| [2] |
陈红梅, 王友莲. 破骨细胞在类风湿关节炎致骨破坏病理变化中的作用及其调控[J]. 中国骨质疏松杂志, 2016, 22: 1168-1173. DOI:10.3969/j.issn.1006-7108.2016.09.020 |
| [3] |
常俊, 吴华香. 破骨细胞在类风湿关节炎骨破坏中的研究进展[J]. 中华风湿病学杂志, 2009, 13: 346-349. DOI:10.3760/cma.j.issn.1007-7480.2009.05.020 |
| [4] |
赵江博, 田佳宁, 程萌旗, 陈德胜. p38 MAPK信号转导通路在人工关节置换术后假体周围骨溶解中的作用研究[J]. 医学综述, 2017, 23: 4382-4387. DOI:10.3969/j.issn.1006-2084.2017.22.003 |
| [5] |
SONG D Z, CAO Z, HUANG S, TICKNER J, LI N, QIU H, et al. Achyranthes bidentata polysaccharide suppresses osteoclastogenesis and bone resorption via inhibiting RANKL signaling[J]. J Cell Biochem, 2018, 119: 4826-4835. DOI:10.1002/jcb.26682 |
| [6] |
AMEZAGA URRUELA M, SUAREZ-ALMAZOR M E. Acupuncture in the treatment of rheumatic diseases[J]. Curr Rheumatol Rep, 2012, 14: 589-597. DOI:10.1007/s11926-012-0295-x |
| [7] |
LI Q H, XIE W X, LI X P, HUANG K T, DU Z H, CONG W J, et al. Adenosine A2A receptors mediate anti-inflammatory effects of electroacupuncture on synovitis in mice with collagen-induced arthritis[J/OL]. Evid Based Complement Alternat Med, 2015, 2015: 809560. DOI: 10.1155/2015/809560.
|
| [8] |
YE T S, DU Z H, LI Z H, XIE W X, HUANG K T, CHEN Y, et al. Repeated electroacupuncture persistently elevates adenosine and ameliorates collagen-induced arthritis in rats[J/OL]. Evid Based Complement Alternat Med, 2016, 2016: 3632168. DOI: 10.1155/2016/3632168.
|
| [9] |
GIAMBELLUCA M S, POULIOT M. Early tyrosine phosphorylation events following adenosine A2A receptor in human neutrophils: identification of regulated pathways[J]. J Leukoc Biol, 2017, 102: 829-836. DOI:10.1189/jlb.2VMA1216-517R |
| [10] |
DU Z H, ZHANG C W, XIE W X, CHEN Y, CONG W J, WANG Z D, et al. Adenosine A2A receptor mediates inhibition of synovitis and osteoclastogenesis after electroacupuncture in rats with collagen-induced arthritis[J/OL]. Evid Based Complement Alternat Med, 2019, 2019: 4617464. DOI: 10.1155/2019/4617464.
|
| [11] |
史晓萍, 宗阿南, 陶钧, 王禄增. 《关于善待实验动物的指导性意见》的研究[J]. 中国医科大学学报, 2007, 36: 493. DOI:10.3969/j.issn.0258-4646.2007.04.051 |
| [12] |
王建波, 曲怡, 张立德. 关于大鼠针刺、固定方法的研究与探讨[J]. 针灸临床杂志, 2015, 31: 73-74. |
| [13] |
BANJI D, PINNAPUREDDY J, BANJI O J, KUMAR A R, REDDY K N. Evaluation of the concomitant use of methotrexate and curcumin on Freund's complete adjuvant-induced arthritis and hematological indices in rats[J]. Indian J Pharmacol, 2011, 43: 546-550. DOI:10.4103/0253-7613.84970 |
| [14] |
郭义, 方剑乔. 实验针灸学实验指导[M]. 3版. 北京: 中国中医药出版社, 2012: 46-49.
|
| [15] |
YANG F, GONG Y, YU N, YAO L, ZHAO X, HONG S, et al. ST36 acupuncture alleviates the inflammation of adjuvant-induced arthritic rats by targeting monocyte/macrophage modulation[J/OL]. Evid Based Complement Alternat Med, 2021, 2021: 9430501. DOI: 10.1155/2021/9430501.
|
| [16] |
施晓兰, 陈弘, 胡丽萍. "足三里"穴治疗类风湿性关节炎机理探讨[J]. 亚太传统医药, 2015, 11: 54-55. |
| [17] |
张超男, 黄学宽, 骆言, 蒋娟, 万磊, 王玲. 电针对急性痛风性关节炎大鼠踝关节滑膜组织TLR/MYD88信号通路的影响[J]. 四川大学学报(医学版), 2014, 45: 924-927. |
| [18] |
FLAMMIER S, PEYRUCHAUD O, BOURGUILLAULT F, DUBOEUF F, DAVIGNON J L, NORMAN D D, et al. Osteoclast-derived autotaxin, a distinguishing factor for inflammatory bone loss[J]. Arthritis Rheumatol, 2019, 71: 1801-1811. DOI:10.1002/art.41005 |
| [19] |
CHENG B, LI J, DU J, LV X, WENG L, LING C. Ginsenoside Rb1 inhibits osteoclastogenesis by modulating NF-κB and MAPKs pathways[J]. Food Chem Toxicol, 2012, 50: 1610-1615. DOI:10.1016/j.fct.2012.02.019 |
| [20] |
SONG D, CAO Z, LIU Z B, TICKNER J, QIU H, WANG C, et al. Cistanche deserticola polysaccharide attenuates osteoclastogenesis and bone resorption via inhibiting RANKL signaling and reactive oxygen species production[J]. J Cell Physiol, 2018, 233: 9674-9684. DOI:10.1002/jcp.26882 |
| [21] |
DU T, YAN Z, ZHU S, CHEN G, WANG L, YE Z C, et al. QKI deficiency leads to osteoporosis by promoting RANKL-induced osteoclastogenesis and disrupting bone metabolism[J/OL]. Cell Death Dis, 2020, 11: 330. DOI: 10.1038/s41419-020-2548-3.
|
| [22] |
THOUVEREY C, CAVERZASIO J. Focus on the p38 MAPK signaling pathway in bone development and maintenance[J/OL]. Bonekey Rep, 2015, 4: 711. DOI: 10.1038/bonekey.2015.80.
|
| [23] |
KIM B H, OH J H, LEE N K. The inactivation of ERK1/2, p38 and NF-kB is involved in the down-regulation of osteoclastogenesis and function by A2B adenosine receptor stimulation[J]. Mol Cells, 2017, 40: 752-760. |
| [24] |
LIU Y, SONG F M, MA S T, MORO A, FENG W Y, LIAO S J, et al. Vaccarin prevents titanium particle-induced osteolysis and inhibits RANKL-induced osteoclastogenesis by blocking NF-κB and MAPK signaling pathways[J]. J Cell Physiol, 2019, 234: 13832-13842. DOI:10.1002/jcp.28063 |
| [25] |
MAZZON E, ESPOSITO E, IMPELLIZZERI D, DI PAOLA R, MELANI A, BRAMANTI P, et al. CGS 21680, an agonist of the adenosine (A2A) receptor, reduces progression of murine type Ⅱ collagen-induced arthritis[J]. J Rheumatol, 2011, 38: 2119-2129. DOI:10.3899/jrheum.110111 |
| [26] |
VARANI K, PADOVAN M, VINCENZI F, TARGA M, TROTTA F, GOVONI M, et al. A2A and A3 adenosine receptor expression in rheumatoid arthritis: upregulation, inverse correlation with disease activity score and suppression of inflammatory cytokine and metalloproteinase release[J/OL]. Arthritis Res Ther, 2011, 13: R197. DOI: 10.1186/ar3527.
|
| [27] |
张晨晨, 金镭, 陈慧慧, 朱捷. 桂枝附子汤对CIA大鼠滑膜组织中MAPK信号通路的影响[J]. 中国实验方剂学杂志, 2017, 23: 130-134. |
| [28] |
LI Y, FANG Z, GU N, BAI F, MA Y, DONG H, et al. Inhibition of chemokine CX3CL1 in spinal cord mediates the electroacupuncture-induced suppression of inflammatory pain[J]. J Pain Res, 2019, 12: 2663-2672. DOI:10.2147/JPR.S205987 |
 2021, Vol. 42
2021, Vol. 42


