2. 海军军医大学(第二军医大学)长海医院急诊科, 上海 200433
2. Department of Emergency, Changhai Hospital, Naval Medical University (Second Military Medical University), Shanghai 200433, China
血管内平滑肌瘤病(intravascular leiomyomatosis, IVL)也称为子宫静脉内平滑肌瘤病,是一种良性平滑肌肿瘤,类型特殊罕见,具有雌激素依赖性,好发于育龄女性,病理表现为平滑肌瘤组织呈结节状、条索状在静脉管腔内浸润性生长,严重者肿瘤可进入右心房、右心室甚至肺动脉,但不侵犯血管壁[1-3]。至今国际上报道的IVL仅200多例,该病虽然罕见,但总结分析后发现该病特点明确。目前临床上对IVL的漏诊、误诊主要是因为对该病缺乏认识。本研究回顾性分析了我院确诊并治疗的5例IVL患者的临床表现、影像学检查、免疫组织化学、手术治疗等资料,并复习相关文献,为该病的诊治提供参考。
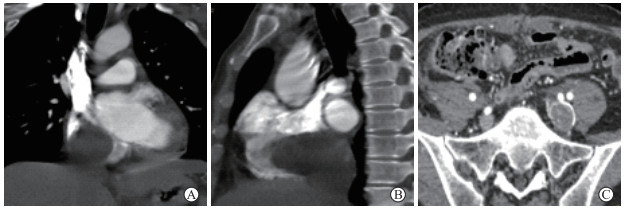
1 资料和方法 1.1 病例1患者女,48岁,因“反复胸闷、气喘1年,加重20 d ”于2014年12月10日至我院就诊。既往有子宫肌瘤病史,具体发病时间不详。超声检查显示下腔静脉及右心房实性占位、三尖瓣反流,左心室射血分数为59%。CT检查显示右心房及下腔静脉见不规则低密度充盈缺损,最大径约为2.8 cm,增强后强化不明显,盆腔内多发囊实性肿块,考虑子宫肌瘤播散可能性大(图 1)。于2014年12月18日由血管外科联合妇产科一期行心脏切开肿物切除+子宫及双侧附件全切除+下腔静脉瘤栓切除+血管成形术。术后病理示右心房、下腔静脉、左侧髂总静脉、髂内静脉内平滑肌瘤病,局部盆腔播散性平滑肌瘤病;免疫组织化学染色示平滑肌肌动蛋白(smooth muscle actin, SMA)(+)、钙调理蛋白(calponin, CALP)(+)、雌激素受体(estrogen receptor, ER)(+)、孕激素受体(progesterone receptor, PR)(+)、结蛋白(desmin,des)(+)、抑癌基因P53(-)、CD31(-)、细胞增殖相关抗原Ki-67(-)。术后患者恢复良好,于2014年12月31日出院。出院后定期复查,至2021年2月未见复发。
|
图 1 病例1 CT检查结果 A:冠状面;B:矢状面;C:水平面增强检查. 右心房及下腔静脉见不规则低密度充盈缺损,最大径约为2.8 cm,增强后强化不明显,左侧髂总静脉及髂内静脉充盈缺损.CT:计算机断层扫描. |
1.2 病例2
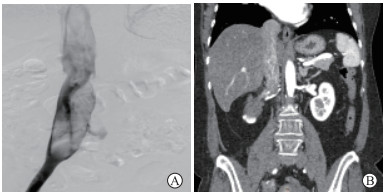
患者女,60岁,因“右下肢肿胀不适伴广泛浅静脉曲张5年”于2015年5月13日至我院就诊。患者10年前因子宫肌瘤行子宫及双侧附件全切除术。初步诊断考虑下肢静脉血栓,遂行血管造影、CT平扫及增强检查示右侧髂总静脉、下腔静脉可见连续充盈缺损,左侧髂静脉通畅;下腔静脉增粗,内可见条索状迂曲明显强化灶(图 2)。于2015年5月19日由血管外科行右侧髂总静脉、下腔静脉瘤栓切除+右侧髂总静脉起始端结扎+血管成形术,术中因出血较多未切除右侧髂总静脉内肿瘤。术后病理诊断为IVL,免疫组织化学染色示SMA(+)、CALP(+)、P53(-)、CD31(-)、Ki-67(-)。术后患者恢复良好,于2015年5月29日出院。出院后定期复查,至2021年2月未见复发。
|
图 2 病例2右侧髂总静脉血管造影和冠状面CT增强检查结果 A:右侧髂总静脉血管造影示右侧髂总静脉内连续条索状充盈缺损;B:冠状面CT增强检查示下腔静脉增粗,内见条索状迂曲明显强化灶.CT:计算机断层扫描. |
1.3 病例3
患者女,46岁,因“反复腹部不适伴双下肢水肿5个月余”于2017年10月13日至我院就诊。既往子宫肌瘤病史14年,未予处理。超声检查示右心房及下腔静脉实体回声。CT检查显示右侧髂静脉、下腔静脉增粗,内可见多发条索状迂曲明显强化灶,下方延续至右侧盆壁、子宫右侧旁(图 3);子宫肌层见数个结节状轻度强化灶。盆腔MRI(2017年9月1日,外院,无片)检查示下腔静脉内见T1等信号、T2高低混杂信号团块,弥散加权成像(diffusion-weighted imaging, DWI)示弥散部分受限,增强后呈轻度强化。2017年10月24日由胸外科行心脏切开肿物切除术。2017年11月16日由妇产科联合血管外科行子宫及双侧附件全切除+下腔静脉瘤栓取出+血管成形术。术后病理诊断为IVL,免疫组织化学染色示SMA(+)、CALP(+)、des(+)、信号转导和转录活化因子6(signal transducer and activator of transcription 6, STAT6)(+)、CD34(+)、ER(部分+)、PR(部分+)、P53(-)、CD31(-)、Ki-67(-)。术后患者恢复良好,于2017年11月28日出院。出院后定期复查,至2021年2月未见复发。

|
图 3 病例3冠状面CT血管造影及血管MIP图像 A,B:冠状面CT血管造影;C:血管MIP图像.右侧髂静脉、下腔静脉增粗,内见多发条索状迂曲明显强化灶,下方延续至右侧盆壁、子宫右侧旁. CT:计算机断层扫描;MIP:最大密度投影. |
1.4 病例4
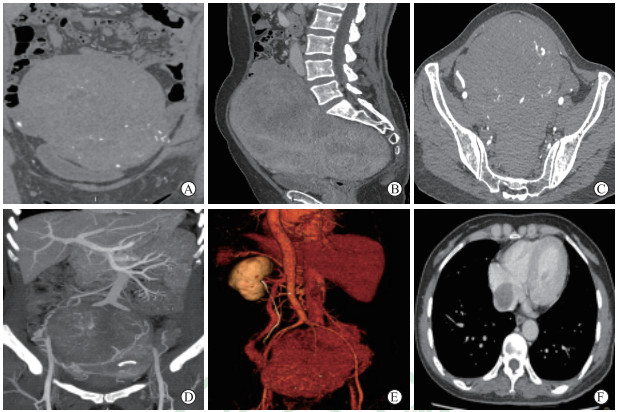
患者女,50岁,因“健康体检时发现下腹部肿块1年”于2018年6月19日至我院就诊。患者14年前发现子宫肌瘤,未予处理。超声检查示肝后下腔静脉段内低回声,考虑血栓。CT检查示子宫多发占位,下腔静脉、双侧髂总静脉及髂内外静脉走行区见条索状低密度影,边界尚清,增强后可见不均匀强化(图 4)。于2018年6月25日,由妇产科联合血管外科行子宫及双附件切除+下腔静脉、双侧髂总静脉、髂内外静脉肿瘤切除+血管成形术。术后病理诊断为IVL,免疫组织化学染色示SMA(+)、CALP(+)、P53(-)、CD31(-)、Ki-67(-)。术后患者恢复良好,于2018年7月4日出院,出院后随访至2021年2月未见复发。
|
图 4 病例4 CT检查结果 A:冠状面增强检查;B:矢状面增强检查;C:水平面增强检查;D:冠状面下腔静脉血管造影MIP图像;E:血管VR;F:水平面下腔静脉增强检查.子宫附件区见多发团块状混杂密度影,内见钙化影,边界尚可,增强后见不均匀强化,横截面大小约为11.0 cm×14.5 cm,膀胱受压移位;下腔静脉、双侧髂总静脉及髂内外静脉走行区见条索状低密度影,边界尚清,增强后可见不均匀强化.CT:计算机断层扫描;MIP:最大密度投影;VR:容积再现. |
1.5 病例5
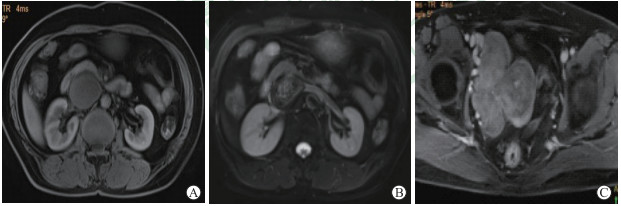
患者女,55岁,因“下腹胀半年”于2019年9月3日至我院就诊。患者4年前因子宫肌瘤及IVL行子宫及双侧附件全切除+下腔静脉内部分肿瘤切除+血管成形术。超声检查示右侧腹腔异常回声,性质待查。CT检查示盆腔偏右见多发结节,下腔静脉扩张,内充满条索状物质,考虑IVL复发。腹部MRI检查示下腔静脉扩张,其内见T1等信号、T2高低混杂信号团块,DWI示弥散部分受限,增强后呈轻度不均匀强化;盆腔右侧可见团块状等信号影,融合成团(图 5)。于2019年9月9日由血管外科行下腔静脉肿瘤切除+血管成形+盆腔肿瘤切除术。术后病理诊断为IVL,免疫组织化学染色示SMA(+)、CALP(+)、STAT6(+)、des(+)、CD34(+)、ER(部分+)、PR(少量+)、P53(-)、CD31(-)、Ki-67(-)。术后患者恢复良好,于2019年9月18日出院。出院后定期复查,至2021年2月未见复发。
|
图 5 病例5腹部和盆腔MRI检查结果 A:腹部T1加权成像;B:腹部T2加权成像;C:盆腔T1加权增强成像.下腔静脉扩张,其内见T1等信号、T2高低混杂信号团块;盆腔右侧见团块状等信号影,融合成团.MRI:磁共振成像. |
2 结果
5例患者均为女性,年龄46~60岁(平均51.8岁),均有子宫肌瘤病史,其中2例(病例2、5)有行子宫及双侧附件全切除术史。2例(病例1、3)平滑肌瘤侵及右心房,表现为心功能受损症状;其余3例(病例2、4、5)分别以右下肢肿胀不适、腹部肿块、下腹胀就诊。4例患者(病例1、3、4、5)行超声及下腔静脉CT造影,2例(病例3、5)行盆腔或腹部MRI平扫+增强检查,1例(病例2)行血管造影检查。5例患者均行血管平滑肌瘤切除+血管成形术。2例病灶累及右心房的患者中,1例患者行一期手术治疗,1例行二期手术,术后均恢复良好。1例患者(病例5)因术后4年复发再次手术。1例患者(病例2)因术中出血较多,未切除右侧髂总静脉内肿瘤,行肿瘤大部切除+髂总静脉起始端结扎术。5例患者的免疫组织化学染色均表现为SMA(+)、CALP(+)、P53(-)、CD31(-)、Ki-67(-);仅1例患者ER、PR均为阳性,1例ER、PR均为部分阳性,1例为ER部分阳性、PR少量阳性,2例患者未见ER、PR染色相关资料。5例患者术后均定期复查,随访至2021年2月均未见复发。
3 讨论IVL属于中胚叶细胞肿瘤,雌激素及多种细胞因子参与其发病,但具体病因不详。目前医学界存在2种假说解释其发病机制[4]:(1)肿瘤起源于血管壁内平滑肌细胞。但临床上只有少数病例报告支持这一理论[4-5]。(2)肿瘤起源于子宫平滑肌瘤,后者侵犯静脉并在血管内沿脉管路径生长,大多数学者支持这一理论[6-7]。本组5例患者均有明确的子宫肌瘤病史,病例1、3、4的子宫平滑肌瘤均与静脉内的平滑肌瘤相延续,术中可从血管内剥离出完整的瘤栓,与脉管壁无粘连;病例2、5因数年前行子宫切除术,不能证明IVL来源于子宫肌瘤。既往研究发现IVL中ER和PR的表达水平分别高于正常组织10倍和50倍,雌激素水平的增高可引起ER敏感人群血管内膜平滑肌细胞过度增殖,最终分化为平滑肌瘤[8-9]。Fukuyama等[10]提出IVL生长模式假说,对ER、PR敏感的子宫平滑肌细胞过度增殖并分化成平滑肌瘤细胞,后者在雌激素作用下继续增殖,待肿瘤生长到一定程度后会将血管壁顶入管腔中而形成套叠样结构,并在此基础上继续呈息肉样推进式生长,沿脉管管腔逐渐向远端迂曲、蜿蜒式浸润。
IVL临床表现缺乏特异性,一般均有子宫肌瘤病史或子宫肌瘤切除史,多见于育龄女性,发病年龄集中在30~50岁,患者常因关注月经不调而忽视该病[10]。部分患者因肿瘤压迫盆腔脏器后出现下腹痛、腰痛等症状。当肿瘤侵入血管导致血管堵塞可引起相应的循环系统症状,其侵入途径主要有:(1)子宫静脉→髂内静脉→髂总静脉→下腔静脉→右心房→右心室→肺动脉;(2)右卵巢静脉→下腔静脉→右心房→右心室→肺动脉;(3)左卵巢静脉→肾静脉→下腔静脉→右心房→右心室→肺动脉。文献报道当IVL累及下腔静脉后,10%~40%的患者可出现下腔静脉综合征,表现为腹胀、下肢水肿等,严重者可出现布加综合征[10]。如果侵入右心房、右心室或肺动脉则可表现出胸闷、心慌、呼吸困难、双下肢水肿等症状,严重者可因血流梗阻而猝死。本组5例患者中2例IVL侵及右心房,表现为胸闷、气喘和双下肢水肿;其余3例分别以下腔静脉堵塞症状为主,表现为腹部肿块、右下肢肿胀不适、下腹胀痛。
IVL发病不同时期可表现出局部脏器受压、下腔静脉综合征、心脏或肺功能受损等症状。虽然临床表现无特异性,但无论就诊于妇产科、胸外科还是血管外科,详细询问各全身系统病史后,结合患者的临床症状,也不难诊断该病,但最主要的还是对该病要有充分的认识。
IVL的影像学检查手段目前主要有超声、CT增强、MRI、PET-CT等[11]。这些检查当中,超声仍然是诊断IVL的首选方法[12]。超声检查操作方便、价格低廉,可以评估病灶的侵犯范围,评估右侧心房和/或心室的受累情况及心功能分级、三尖瓣反流程度等。当IVL局限在子宫时,表现与子宫肌瘤相似,为肌壁见低回声结节;当IVL浸润盆腔血管时,表现为边界不清的混合回声;当IVL浸润髂总静脉、下腔静脉等大血管时,可见相应的静脉管径增大,管腔内可见条索状或树枝状低回声,与脉管壁界限清楚,抑或游离于脉管内;对探头进行加压,血管不能被完全压扁;当IVL浸润右心房或右心室时,可见心脏内游离实性肿物与下腔静脉内肿物相连,形态尚规则,有时因游离端凸入三尖瓣,可导致三尖瓣关闭不全而出现不同程度的反流[13-14]。本组5例患者中4例进行了超声检查,1例因怀疑静脉血栓而直接行血管造影检查。2例超声表现为右心房、下腔静脉内实性占位,条索状肿物从盆腔血管途经下腔静脉一直延续至心房内,性质待定,其中1例还有轻度三尖瓣反流;另2例分别表现为肝下腔静脉段内蚯蚓状低回声、右侧腹腔异常回声,加压超声探头后血管不能闭合。
CT增强检查可直观、清晰地显示病变起源及侵犯范围,全面显示脉管内肿物的大小、形态、密度、有无增强、与管壁的关系、血管侧支循环及脉管管腔扩张情况。本组5例IVL患者中4例行CT增强检查。4例患者均表现为相应脉管内不规则低密度充盈缺损,呈条索状,增强后不均匀强化,肿物与脉管壁分界清楚,脉管管腔扩张。
MRI有良好的软组织分辨能力,可清晰地显示脉管内肿物信息及肿物(扩张的脉管)与盆腔各脏器之间的关系,IVL受累脉管流空效应部分或全部消失,肿物一般呈T1等信号、T2混杂信号或等低信号,早期及延迟期均明显强化,可表现为筛孔样结构[11, 15];DWI显示病灶弥散轻度受限,表现为等或稍高信号;表观弥散系数无明显降低。本组2例行MRI检查,均表现为下腔静脉扩张,其内见T1等信号、T2高低混杂信号团块,弥散部分受限,增强后不均匀强化,盆腔右侧可见团块状等信号影,融合成团。
PET-CT检查在鉴别平滑肌肿瘤良恶性方面独具优势,IVL患者5-氟脱氧葡萄糖代谢无异常,一旦出现异常浓聚多提示恶性病变[16-17]。
IVL的影像学检查特点明确,超声、CT增强、MRI等均可观察到盆腔血管、下腔静脉甚至右心房、右心室或肺动脉内连续的条索状或蚯蚓状、实性、低回声或低密度或T1等信号和T2高低混杂信号团块、增强后不规则强化等特点。根据影像特点结合相关临床表现及妇科相关病史,可提高诊断的准确性。
IVL术后病理大体可见以下特征:(1)子宫不规则增大,切面可见单个或多个结节,多为实性,质地偏韧,因其切面有明显的血管壁结构,可与子宫肌瘤鉴别。(2)盆腔内其余附件(包括血管、韧带)及下腔静脉、心脏内均可见条索状肿物,体积大小不等,与周围结构界限清楚,脉管内的肿物可直接抽出,表面光滑,切开后肿物内部呈灰红色或灰白色,质地软硬不等[18]。镜下可见IVL肿瘤细胞呈类圆形、不规则,核呈卵圆形、淡染,似上皮样,部分可见细胞质内空泡,呈簇状、小条索状或单个细胞散在;标本表面可见血管内皮细胞覆盖;部分淋巴管也可见受累[18]。免疫组织化学染色可见SMA、STAT6、des、CALP、CD34均呈阳性,PR、ER呈强阳性,Ki-67、P53等呈阴性[18]。本组5例患者大体及镜下病理表现和以上特征相似,但免疫组织化学染色稍有不同。本组5例患者,免疫组织化学染色的共同点是SMA(+)、CALP(+)、P53(-)、CD31(-)、Ki-67(-);但ER、PR在病例1表现为阳性,在病例3均为部分阳性,在病例5表现为ER部分阳性、PR少量阳性,病例2、4未见相关资料。造成这种偏差的原因可能有以下2个方面:(1)该病病理检查没有统一规范,各病例的免疫组织化学表型可能不尽相同;(2)免疫组织化学所取标本的部位可能不同,因为肿瘤涉及范围较广,各个部位免疫组织化学表型也不尽相同。
因IVL多发生于育龄女性,所以临床多综合考虑患者生育要求,并结合患者年龄、病变侵犯范围等因素制订治疗方案,对难以全切除的肿瘤,尽可能多切尽肿瘤以缓解症状。Carr等[5]研究指出,手术是治疗IVL的唯一可靠手段。当病变局限于腹部、盆腔时,建议的手术方法为:(1)年龄<45岁、无生育要求、无宫外脉管浸润者,建议行子宫全切除术,双侧附件酌情考虑是否切除;对有生育要求患者,建议术中尽量切除瘤栓并保留病变较轻一侧的卵巢,并嘱患者术后3~6个月严密随访,告知相关风险及复发情况。(2)年龄≥45岁、无生育要求但伴有宫外脉管浸润者,建议行全子宫+双侧附件+宫外病灶切除术,并高位结扎漏斗韧带,术后不行激素替代治疗。当病变累及大血管、心脏时,手术相对困难,术前需要详细评估血管情况和心功能等指标,术中应用体外循环、低体温等技术,并在多学科联合基础上进行手术[19]。部分患者病变从盆腔经下腔静脉至心脏均有累及,此类患者手术具有挑战性,选择多学科联合一期肿瘤全切除术还是二期手术分阶段切除需根据患者病情、手术耐受能力、医学技术及医疗仪器综合考虑[20-22]。Ariza等[23]在1982年首次报道了1例成功一期手术切除病例,之后30余年手术成功病例不断报道。二期手术分2个阶段,第一阶段先处理心脏内及肾静脉水平以上的下腔静脉内肿物,1个月后(1周至2年)行肾静脉水平以下的肿瘤切除。虽然二期手术安全性较高,但增加了患者痛苦、经济负担及前次手术粘连后再次手术的难度。目前随着医学技术的进步及医疗器械的改进,一期手术患者数量逐渐增多。本组2例病变累及右心房患者中,1例(病例1)行一期手术治疗,1例(病例3)行二期手术,术后均恢复良好。
此外,根据IVL有雌激素依赖性的特点,对于不愿手术或手术无法全切除的患者,可以在术前或术后应用抗雌激素治疗,抑制肿瘤生长或防止其复发。但研究显示抗雌激素治疗虽可缩小肿瘤体积,却并不能降低肿瘤复发率[24]。本组5例患者均未行抗雌激素治疗,因为5例患者免疫组织化学ER、PR均未表现出强阳性,考虑即使抗雌激素治疗,治疗效果也可能不佳。
IVL虽然是一种良性肿瘤,但有恶性肿瘤浸润倾向,部分肿瘤堵塞脉管或凸入心腔,可造成严重症状甚至猝死。本研究回顾分析了我院5例IVL患者资料并结合文献报道,总结了IVL的发病机制、临床表现、影像学特征、病理及免疫组织化学染色结果、治疗方法等。IVL患者多为女性,发病年龄集中在30~50岁,有子宫肌瘤病史或子宫肌瘤切除术史,影像学检查示下腔静脉内条索状影伴不均匀强化,结合相关临床表现及妇科病史可提高诊断准确性。
| [1] |
AYDIN E, KÖSE O, KOCAASLAN C, ALDAĞ M, BADEMCI M Ş. Intravascular leiomyomatosis with extension into the pulmonary artery[J]. J Card Surg, 2018, 33: 453-454. DOI:10.1111/jocs.13746 |
| [2] |
LOW H Y, ZHAO Y, HUANG K S, SHEN H P, WU P J, TSENG C J. Intravenous leiomyomatosis of the uterus: a clinicopathological analysis of nine cases and literature review[J]. Taiwan J Obstet Gynecol, 2017, 56: 362-365. DOI:10.1016/j.tjog.2017.04.017 |
| [3] |
KOMMOSS F, EBEL T, DRUSENHEIMER J, SCHELZIG H, LICHTENBERG A, FEHM T, et al. Intravenous leiomyomatosis[J]. Pathologe, 2019, 40: 80-84. DOI:10.1007/s00292-019-0566-7 |
| [4] |
NORRIS H J, PARMLEY T. Mesenchymal tumors of the uterus. Ⅴ. Intravenous leiomyomatosis. A clinical and pathologic study of 14 cases[J]. Cancer, 1975, 36: 2164-2178. DOI:10.1002/cncr.2820360935 |
| [5] |
CARR R J, HUI P, BUZA N. Intravenous leiomyomatosis revisited: an experience of 14 cases at a single medical center[J]. Int J Gynecol Pathol, 2015, 34: 169-176. DOI:10.1097/PGP.0000000000000127 |
| [6] |
FANG H, YOU Y, CAI F, YANG Y, YANG C, LV P. Intravenous leiomyomatosis of the subclavian vein[J]. J Vasc Surg Venous Lymphat Disord, 2017, 5: 254-256. DOI:10.1016/j.jvsv.2016.03.008 |
| [7] |
GUL P, GUL K, GUL P, JOGEZAI S. Subserosal leiomyoma with intravenous leiomyomatosis extending into inferior vena cava and right-sided cardiac chambers[J]. J Coll Physicians Surg Pak, 2019, 29: 775-777. DOI:10.29271/jcpsp.2019.08.775 |
| [8] |
KOKAWA K, YAMOTO M, YATA C, MABUCHI Y, UMESAKI N. Postmenopausal intravenous leiomyomatosis with high levels of estradiol and estrogen receptor[J]. Obstet Gynecol, 2002, 100(5 Pt 2): 1124-1126. |
| [9] |
KIR G, KIR M, GURBUZ A, KARATEKE A, AKER F. Estrogen and progesterone expression of vessel walls with intravascular leiomyomatosis; discussion of histogenesis[J]. Eur J Gynaecol Oncol, 2004, 25: 362-366. |
| [10] |
FUKUYAMA A, YOKOYAMA Y, FUTAGAMI M, SHIGETO T, WADA R, MIZUNUMA H. A case of uterine leiomyoma with intravenous leiomyomatosis: histological investigation of the pathological condition[J]. Pathol Oncol Res, 2011, 17: 171-174. DOI:10.1007/s12253-010-9265-7 |
| [11] |
YANG C, FANG H, YANG Y, CAI F, ZHENG H, JIN B, et al. Diagnosis and surgical management of inferior vena cava leiomyomatosis[J]. J Vasc Surg Venous Lymphat Disord, 2018, 6: 636-645. DOI:10.1016/j.jvsv.2018.03.013 |
| [12] |
GE Z T, WANG Y H, QI Z H, ZHANG Q, JIN J, LI J C. Ultrasound appearance of intravenous leiomyomatosis: a case report[J/OL]. Medicine, 2019, 98: e16913. DOI: 10.1097/MD.0000000000016913.
|
| [13] |
张晓东, 方理刚, 蔡胜, 王亚红, 徐钟慧, 王蕾, 等. 静脉内平滑肌瘤病心脏受累的声像图特征[J]. 中国医学科学院学报, 2013, 35: 69-73. DOI:10.3881/j.issn.1000-503X.2013.01.013 |
| [14] |
SOGABE M, KAWAHITO K, AIZAWA K, SATO H, MISAWA Y. Uterine intravenous leiomyomatosis with right ventricular extension[J]. Ann Thorac Cardiovasc Surg, 2014, 20(Suppl): 933-936. |
| [15] |
JALAGUIER-COUDRAY A, ALLAIN-NICOLAI A, THOMASSIN-PIANA J, VILLARD-MAHJOUB R, DELARBRE B, RUA S, et al. Radio-surgical and pathologic correlations of pelvic intravenous leiomyomatosis[J]. Abdom Radiol (NY), 2017, 42: 2927-2932. DOI:10.1007/s00261-017-1225-1 |
| [16] |
JIN X N, LI F, LU Z H, CHENG W Y. IV leiomyomatosis on FDG PET/CT[J]. Clin Nucl Med, 2016, 41: 580-582. DOI:10.1097/RLU.0000000000001185 |
| [17] |
XIAO J, LIU G, CHENG D, WANG H, SHI H. The value of 18F-FDG PET/CT in the diagnosis of uterine intravenous leiomyomatosis extended into the right atrium[J]. Hell J Nucl Med, 2016, 19: 179-181. |
| [18] |
TANG L, LU B. Intravenous leiomyomatosis of the uterus: a clinicopathologic analysis of 13 cases with an emphasis on histogenesis[J]. Pathol Res Pract, 2018, 214: 871-875. DOI:10.1016/j.prp.2018.04.011 |
| [19] |
MATOS A P, RAMALHO M, PALAS J, HERÉDIA V. Heart extension of an intravenous leiomyomatosis[J]. Clin Imaging, 2013, 37: 369-373. DOI:10.1016/j.clinimag.2012.04.022 |
| [20] |
FUKUI T, KAWAHITO K, SUGAYA A, SHIMIZU K, AIZAWA K, MISAWA Y. [Two-stage surgery for uterine intravenous leiomyomatosis with right ventricular extension: report of a case][J]. Kyobu Geka, 2018, 71: 376-379. |
| [21] |
ATALAY A, POYRAZOGLU H H, GÖÇEN U, YÜKSEL M, ERAY I C, GUZEL A B, et al. Successful one stage surgical removal of intravenous leiomyomatosis with on pump beating heart technique[J/OL]. Heart Lung Circ, 2016, 25: e72-e74. DOI: 10.1016/j.hlc.2015.11.003.
|
| [22] |
BAYRAMOGLU D, ORHAN A, GUL A, SAHIN G, CELIK Z E, KOPLAY M, et al. Two-stage surgery for extra pelvic intravenous leiomyomatosis: report of a case[J]. J Obstet Gynaecol, 2020, 40: 731-732. DOI:10.1080/01443615.2019.1624950 |
| [23] |
ARIZA A, CERRA C, HAHN I S, SHAW R K, RIGNEY B. Intravascular leiomyomatosis of the uterus. A case report[J]. Conn Med, 1982, 46: 700-703. |
| [24] |
LI B, CHEN X, CHU Y D, LI R Y, LI W D, NI Y M. Intracardiac leiomyomatosis: a comprehensive analysis of 194 cases[J]. Interact Cardiovasc Thorac Surg, 2013, 17: 132-138. DOI:10.1093/icvts/ivt117 |
 2021, Vol. 42
2021, Vol. 42


