2. 上海嘉会国际医院泌尿外科, 上海 200030
2. Department of Urology, Jiahui International Hospital, Shanghai 200030, China
下腔静脉的血流量大,主要汇集了肝脏、肾脏、下肢等重要脏器的血液回流,在外科手术中,肾上段下腔静脉前方有胰腺、十二指肠及肝脏的遮挡,暴露较为困难。因此,术中发生出血及周围脏器损伤等并发症的可能性较大,手术难度相对较高,部分学者甚至认为侵犯下腔静脉是手术预后不良的重要因素。
不同来源的肿瘤侵犯下腔静脉时,因其生物学行为不同,手术方式也存在较大差异。下腔静脉相关肿瘤既包括肾癌下腔静脉癌栓、下腔静脉平滑肌瘤病等来源于其他器官的肿瘤侵犯下腔静脉,也包括原发性下腔静脉平滑肌肉瘤等原发性疾病。虽然肿瘤均可位于下腔静脉内,影响下腔静脉血流,出现侵犯下腔静脉血管壁的表现,但这3种与下腔静脉相关的疾病却在很多方面存在差异。
肾癌患者中约有4%~10%会发生静脉癌栓,这是下腔静脉癌栓最常见的来源[1-2]。因大部分肾癌下腔静脉癌栓并不侵犯下腔静脉内壁,多数情况下行下腔静脉切开取栓后单纯缝合重建下腔静脉即可。近年来随着手术技术的提高和靶向药物的研发,肾癌下腔静脉癌栓患者的手术预后得到明显改善。原发性下腔静脉平滑肌肉瘤是一种下腔静脉平滑肌来源的恶性肿瘤,较为罕见[3], 其既可向腔内生长也可向腔外生长[4-5],邻近血管受到肿瘤挤压可包裹甚至侵入血管腔[6]。既往研究认为完整切除是影响原发性下腔静脉平滑肌肉瘤患者预后最重要的因素[7],但肿瘤完整切除手术的难度极大,目前即使是国内外手术量较大的中心也仅有少量病例报道。下腔静脉平滑肌瘤病是一种少见的来自子宫中胚叶的良性肿瘤[8],肿瘤沿血管蔓延,可以从小静脉延及下腔静脉甚至进入右心房[9]。
目前尚无针对肾癌下腔静脉癌栓、原发性下腔静脉平滑肌肉瘤、下腔静脉平滑肌瘤病这3种疾病外科治疗方式的对比研究,本研究拟分析这3种累及肾上段下腔静脉相关肿瘤的手术方式、手术策略和手术效果,重点关注下腔静脉的切除与重建方式,以期为其他中心开展相似疾病的诊治提供参考。
1 资料和方法 1.1 一般资料本研究共纳入海军军医大学(第二军医大学)长海医院2008年1月至2018年4月收治的侵犯肾上段下腔静脉的不同组织来源肿瘤患者51例,其中肾癌下腔静脉癌栓32例、原发性下腔静脉平滑肌肉瘤11例、下腔静脉平滑肌瘤病8例。男20例、女31例,年龄26~76(50.1±12.8)岁,除3例肾癌下腔静脉癌栓患者接受腹腔镜手术治疗外,其余患者均接受开放手术切除肿瘤;所有患者均得到术后病理确诊。
32例肾癌下腔静脉癌栓患者中男18例、女14例,年龄39~76(57.0±10.4)岁,右肾肾癌19例、左肾肾癌13例,癌栓Mayo分级Ⅰ、Ⅱ、Ⅲ、Ⅳ级患者分别为8、11、9、4例,侵犯肝上段、肝后段、肝下段下腔静脉的患者分别为4、9、19例。11例原发性下腔静脉平滑肌肉瘤患者中男2例、女9例,年龄26~47(37.2±6.6)岁,侵犯肝上段、肝后段、肝下段下腔静脉的患者分别为3、4、4例。8例下腔静脉平滑肌瘤病患者均为女性,年龄30~49(40.3±6.6)岁,侵犯肝上段、肝后段、肝下段下腔静脉的患者分别为5、2、1例。本研究通过海军军医大学(第二军医大学)长海医院伦理委员会审批。
1.2 术前准备术前常规行CT下腔静脉造影,肾癌下腔静脉癌栓、原发性下腔静脉平滑肌肉瘤、下腔静脉平滑肌瘤病通过术前影像学手段获得准确诊断的患者比例分别为100.0%(32/32)、90.9%(10/11)、100.0%(8/8)。1例原发性下腔静脉平滑肌肉瘤患者未能在术前获得影像学诊断,原因是该患者的影像学表现主要为肿瘤于血管外生长而不是血管内,挤压下腔静脉(以压迫为主),术前认为该肿瘤为腹膜后来源,未考虑其可能为下腔静脉来源的肉瘤。
术前行常规检查,排除合并心肺功能不全、存在出血性疾病等不能耐受麻醉及手术的患者。患者于手术前一晚常规导泄,术前30 min预防性应用第2代头孢菌素类抗生素。
1.3 手术方法 1.3.1 肾癌下腔静脉癌栓对于累及肝下段下腔静脉的肾癌癌栓,大多数情况下可以对其进行切开取栓+修补成形术,有时需切除肾静脉汇入点附近的局部腔静脉壁,很少需要进行下腔静脉切除置换[10]。肝后段下腔静脉受累时,常需要结扎肝短静脉,游离尾状叶甚至肝裸区,从右向左旋转肝脏后才能显露该段下腔静脉,需要在膈下阻断下腔静脉和第一肝门。如肾癌下腔静脉癌栓进入心房,则需考虑体外循环,通常的做法是进行上腔静脉和升主动脉插管并切开右心房。本组共6例患者癌栓侵犯下腔静脉管壁,其中2例因癌栓(均为Mayo分级Ⅲ级)与下腔静脉管壁关系紧密无法分离(图 1)而行下腔静脉切除(1例右侧肾癌合并下腔静脉癌栓患者术中切除下腔静脉后探查见左肾色泽正常,静脉回流情况好,未进行下腔静脉重建,术后未出现下肢肿胀等并发症;另1例左侧肾癌合并下腔静脉癌栓患者术中行人工血管置换)。
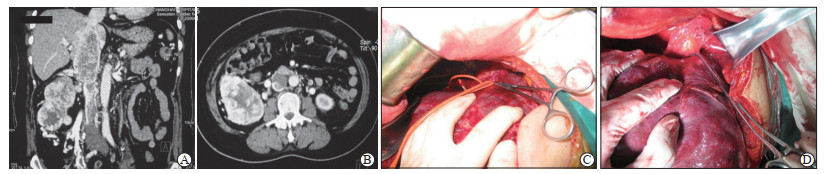
|
图 1 肾癌下腔静脉癌栓(Mayo分级Ⅲ级)典型病例术前影像资料及手术过程 Fig 1 Preoperative imaging data and surgical procedure of Mayo grade Ⅲ renal carcinoma with inferior vena cava tumor thrombus A: The CT coronal plane image of Mayo gradeⅢ tumor thrombus; B: The CT horizontal plane image of Mayo gradeⅢ tumor thrombus; C: The upper hepatic inferior vena cava was blocked by a vascular sling; D: The upper hepatic inferior vena cava was blocked by an atraumatic hemostatic forceps. CT: Computed tomography. |
1.3.2 原发性下腔静脉平滑肌肉瘤
下腔静脉游离暴露方法同肾癌下腔静脉癌栓。本组患者下腔静脉壁均受到肿瘤不同程度侵犯,被侵犯的下腔静脉需行切除及重建。在游离及阻断下腔静脉近端和远端后,将肿瘤连同下腔静脉一起切除。下腔静脉切除后,使用带支撑环的聚四氯乙烯人工血管(直径13~14 mm)及CV-7缝线或6-0 Prolene缝线连续缝合进行血管重建(图 2)。如果肿瘤同时侵犯肝脏,需行肉瘤联合部分肝脏切除(图 3)。
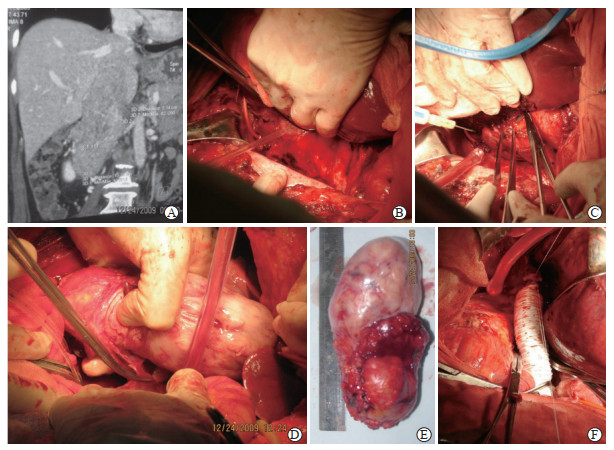
|
图 2 原发性下腔静脉平滑肌肉瘤(侵犯肝后段下腔静脉)典型病例术前影像资料及手术过程 Fig 2 Preoperative imaging data and surgical procedure of primary inferior vena cava leiomyosarcoma (involving posterior hepatic inferior vena cava) The patient underwent resection of sarcoma and inferior vena cava+reconstruction of inferior vena cava by artificial blood vessel. A: The CT coronal plane image of inferior vena cava showed that the tumor invaded the liver; B: The liver was lifted up and the inferior vena cava was fully exposed; C: The inferior vena cava was exposed and protected carefully; D: The inferior vena cava and the tumor were separated integrally; E: The postoperative specimen; F: The inferior vena cava was replaced by poly tetra fluoroethylene artificial blood vessel. CT: Computed tomography. |

|
图 3 原发性下腔静脉平滑肌肉瘤(侵犯肝脏)典型病例术前影像资料及手术过程 Fig 3 Preoperative imaging data and surgical procedure of primary inferior vena cava leiomyosarcoma (involving liver) The patient underwent sarcoma resection and partial hepatectomy. A: The CT coronal plane image of inferior vena cava showed that the tumor invaded the liver; B: The CT sagittal plane image of inferior vena cava; C, D: Three dimensional reconstruction of sarcoma and inferior vena cava; E: The liver was partially resected and the inferior vena cava was exposed; F: The sarcoma was removed integrally; G, H: The postoperative specimens of sarcoma, inferior vena cava and part of the resected liver. CT: Computed tomography. |
1.3.3 下腔静脉平滑肌瘤病
下腔静脉游离暴露方法同上。本组患者均未发现瘤体与周围下腔静脉粘连情况,所有患者均行下腔静脉切开取瘤术。部分患者下腔静脉受累长度较长,可在下腔静脉瘤体近端得到控制后,采取分段切开下腔静脉的方法抽出瘤体(图 4)。本组1例下腔静脉全程受累瘤体进入右心房的患者接受了分期手术,第1次先行胸部手术,体外循环下行瘤栓取出术,待患者生命体征平稳后2周内再次行腹部手术切除。因该病与激素有关,原则上对无生育需求的女性患者行双侧附件切除。本组1例患者有生育需求,未行子宫附件切除,行髂静脉结扎术以降低肿瘤未切除部分进入下腔静脉的风险。
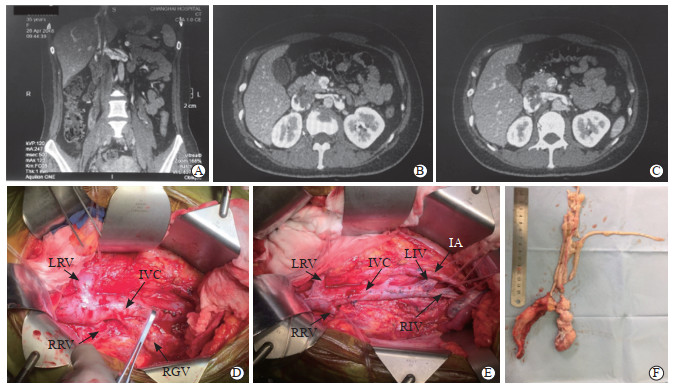
|
图 4 下腔静脉平滑肌瘤病典型病例术前影像资料及手术过程 Fig 4 Preoperative imaging data and surgical procedure of inferior vena cava leiomyomatosis A: The CT coronal plane image of IVC leiomyomatosis; B: The CT horizontal plane image of IVC leiomyomatosis; C: The CT horizontal plane image of IVC leiomyomatosis showed the tumor thrombus partially invaded the LRV; D: The IVC, LRV, RRV and RGV were separated and fully exposed during the operation; E: The IVC was resected to remove the tumor thrombus, the RGV was removed and the IVC was reconstructed; F: The postoperative IVC specimen. CT: Computed tomography; IVC: Inferior vena cava; LRV: Left renal vein; RRV: Right renal vein; RGV: Right gonadal vein; LIV: Left iliac vein; RIV: Right iliac vein; IA: Iliac artery. |
1.4 围手术期并发症诊断标准
于术前7 d至术后14 d观察并发症的发生情况,采用改良Clavien分级系统评估并发症,≥Ⅲ级并发症定义为严重并发症[11]。
1.5 术后随访术后1个月进行首次随访,1年内每3个月随访1次,1年后每6个月随访1次。随访内容主要包括血常规、血生化、CT下腔静脉造影或泌尿系增强CT、胸部X线片或胸部增强CT等,记录局部复发、转移及死亡情况。
1.6 统计学处理应用MedCalc 10.4.7.0软件进行统计学分析。符合正态分布的计量资料以x±s表示,不符合正态分布的计量资料以中位数(下四分位数,上四分位数)表示;计数资料以例数和百分数表示。
2 结果 2.1 手术情况50例患者顺利完成手术切除,1例患者术中中止手术。无术中死亡病例。32例肾癌下腔静脉癌栓患者中,单纯切开下腔静脉取栓者30例(93.8%),2例(6.2%)术中联合下腔静脉切除(1例左侧肾癌合并下腔静脉癌栓患者行人工血管重建术)。11例原发性下腔静脉平滑肌肉瘤患者中,6例切除下腔静脉并行人工血管置换,4例切除肿瘤侵犯的部分下腔静脉并缝合重建,1例术中探查后无法切除肿瘤而中止手术。8例下腔静脉平滑肌瘤病患者均未行下腔静脉切除及重建。所有患者的手术时间为130~320(208±40)min,肾癌下腔静脉癌栓、原发性下腔静脉平滑肌肉瘤、下腔静脉平滑肌瘤病患者的手术时间分别为130~302(199±35)、170~320(236±40)和150~255(208±38)min。所有患者的出血量为1 500(1 000,2 200)mL,肾癌下腔静脉癌栓、原发性下腔静脉平滑肌肉瘤、下腔静脉平滑肌瘤病患者的出血量分别为1 450(1 000,1 850)、2 300(1 600,3 350)和1 400(1 000,2 200)mL。
2.2 围手术期情况肾癌下腔静脉癌栓、原发性下腔静脉平滑肌肉瘤、下腔静脉平滑肌瘤病患者的围手术期(术前7 d至术后14 d)并发症发生率分别为12.5%(4/32)、18.2%(2/11)和0(0/8),其中Clavien分级≥Ⅲ级并发症的发生率分别为12.5%(4/32)、9.1%(1/11)和0(0/8);围手术期死亡患者分别为3、1、0例,其中术中肾癌下腔静脉癌栓脱落并在围手术期死亡2例,肾癌下腔静脉癌栓及原发性下腔静脉平滑肌肉瘤肝淤血导致术后弥散性血管内凝血死亡各1例。
2.3 随访情况中位随访时间为17个月,最长随访时间36个月,最短1个月(因患者死亡),肾癌下腔静脉癌栓、原发性下腔静脉平滑肌肉瘤、下腔静脉平滑肌瘤病患者的生存率分别为84.4%(27/32)、63.6%(7/11)和100.0%(8/8)。肾癌下腔静脉癌栓死亡患者除围手术期死亡3例外,另有2例死于肿瘤远处转移。围手术期后死亡的3例原发性下腔静脉平滑肌肉瘤患者死于肺及肝转移。
3 讨论 3.1 3种疾病存在诸多差异(1)疾病人口学特征差异。3组患者在年龄分布上存在差异,肾癌下腔静脉癌栓患者的平均年龄为(57.0±10.4)岁,而原发性下腔静脉平滑肌肉瘤及下腔静脉平滑肌瘤病患者的平均年龄分别为(37.2±6.6)岁和(40.3±6.6)岁,明显低于肾癌下腔静脉癌栓患者。下腔静脉平滑肌瘤病患者均为女性,原发性下腔静脉平滑肌肉瘤中女性患者也多于男性(9∶2)。
(2)侵犯血管情况差异。肾癌下腔静脉癌栓存在侵犯静脉壁的情况,但比例不高,本研究中共有6例(18.8%,6/32)侵犯下腔静脉管壁,切除后下腔静脉重建方式与既往报道[12]相似。原发性下腔静脉平滑肌肉瘤侵犯下腔静脉管壁且与其无明显界限,术中通常难以分离,本研究中11例原发性下腔静脉平滑肌肉瘤患者中6例行下腔静脉切除及人工血管重建,4例切除肿瘤侵犯的部分下腔静脉管壁并缝合重建。下腔静脉平滑肌瘤病瘤体与下腔静脉壁之间通常存在明显间隙,瘤体外表光滑,可通过抽拉将肿瘤完整地从下腔静脉取出。本研究中的8例下腔静脉平滑肌瘤病患者均未发现瘤体与周围下腔静脉粘连情况。对于肿瘤侵犯静脉壁的患者,可选择使用肿瘤剥离子进行剥离,如能完整剥离则不必切除下腔静脉。因此,在侵犯同等高度下腔静脉的这3种疾病中,原发性下腔静脉平滑肌肉瘤患者因其与大血管的关系紧密,手术治疗难度最大。
(3)癌栓/瘤栓脱落风险不同。这3种疾病中肾癌下腔静脉癌栓的脱落风险最大,其脱落有可能导致心肺栓塞,是下腔静脉癌栓取出术中最严重的并发症,发生率为2%~4%,死亡率高达75%[13]。下腔静脉平滑肌瘤病瘤体质地韧,瘤栓脱落风险较低。而原发性下腔静脉平滑肌肉瘤侵犯血管与血管壁关系紧密,呈侵犯性生长,瘤栓也不易脱落。
本研究中2例肾癌下腔静脉癌栓患者出现术中癌栓脱落并在围手术期死亡,脱落均发生在血管分离阶段,主要存在两方面原因:首先,肿瘤的质地比较疏松或肿瘤内形成坏死导致癌栓容易脱落;其次,手术中的操作难免触及血管壁,是癌栓脱落的重要诱因。因此,手术过程中操作应轻柔,以减少对血管壁的刺激;同时阻断要充分,完整分离血管,看到阻断钳尖部后再行阻断。
(4)术后预后差异。经过中位17个月随访后,本研究的肾癌下腔静脉癌栓、原发性下腔静脉平滑肌肉瘤患者分别有5例(15.6%,5/32)、4例(36.4%,4/11)死亡,下腔静脉平滑肌瘤病患者无死亡。肾癌发生癌栓通常提示患者肿瘤转移风险较高,肿瘤已发展到晚期,如不做任何处理,中位生存时间仅为5个月[14];当施行患肾根治性切除+下腔静脉癌栓取出术后,患者预后得到明显改善,5年生存率为40%~60%[13]。对于原发性下腔静脉平滑肌肉瘤患者,虽有化疗、放疗等综合治疗手段,但肿瘤根治性切除是已被证实的唯一对预后有效的治疗方法[15]。有研究报道原发性下腔静脉平滑肌肉瘤患者术后1年及3年的生存率分别为85.7%和64.3%[16],5年生存率约为55%[17]。而下腔静脉平滑肌瘤病由于是良性肿瘤,肿瘤联合附件切除后,消除了雌激素产生来源,患者预后良好。
3.2 手术治疗原则手术切除是上述3种疾病最有效的治疗方式。在进行根治性手术时,如癌栓侵犯下腔静脉管壁,应彻底切除受累的下腔静脉壁[18]。在遇到下腔静脉壁受侵犯的患者时,任何单一学科背景的外科医师都会遇到困难,成功进行手术的前提是在前期接受大量的血管吻合基本训练,并在手术时选取合适的血管手术器械及合适的人工血管等[19]。
3.3 未解决的问题肾癌癌栓术中脱落是手术中致命性并发症,一旦发生可导致严重的呼吸循环障碍,危及患者生命。本研究肾癌下腔静脉癌栓患者中,2例患者癌栓脱落,均为Mayo分级Ⅲ级癌栓,术前评估未见明显异常。目前尚无能在术前有效判断癌栓脱落可能性的方法,虽然术前放置下腔静脉滤器预防癌栓脱落的方法并未得到大样本研究的支持,但对于术前影像学评估认为存在脱落风险的患者,下腔静脉滤器仍是一种可以使用的预防方式。笔者自2007年开始使用临时性下腔静脉滤器预防癌栓脱落,已取得一定经验[20]。
3.4 癌栓/瘤栓高度并不等同于手术难度即使肿瘤侵犯下腔静脉的高度类似,不同患者的手术难度也存在明显差异。癌栓/瘤栓造成的下腔静脉部分或完全梗阻可能导致局部组织水肿,不利于手术操作;对于合并远端下腔静脉血栓者要进一步预防远端血栓脱落。癌栓/瘤栓是否阻塞肝静脉开口是判断手术难度及患者预后的重要因素,本研究中2例因肝淤血及凝血功能下降出现术后弥散性血管内凝血而在围手术期死亡,因此术前读片时应特别关注这一问题。术前还要确定患者是否合并冠状动脉狭窄,对这部分心功能不全的患者,采用体外循环是比较安全的手术方式。此外,原发性下腔静脉平滑肌肉瘤可能侵犯肝脏而需行部分肝脏联合切除,这也将显著增大手术难度。
综上所述,在累及肾上段下腔静脉的肿瘤患者中,肾癌下腔静脉癌栓、原发性下腔静脉平滑肌肉瘤和下腔静脉平滑肌瘤病在人口学、血管侵犯情况、癌栓/瘤栓脱落风险、疾病预后方面存在明显差异。术前全面评估患者病情有助于更好地完成手术,但目前尚无在术前评估手术难度、避免癌栓/瘤栓脱落及避免术后严重并发症的有效方法。本研究属于回顾性研究,病例随访时间不长,研究结果还需要更大样本量的长期随访予以证实。
| [1] |
杨罗佳, 彭程, 黄庆波, 杨阳, 沈东来, 杜松良, 等. 机器人辅助腹腔镜肾根治性切除联合下腔静脉癌栓取出术术中癌栓降级11例分析[J]. 现代泌尿外科杂志, 2020, 25: 337-341. DOI:10.3969/j.issn.1009-8291.2020.04.013 |
| [2] |
唐静, 刘凤永, 马鑫, 袁宏军, 李鑫, 叶挺, 等. 下腔静脉造影在肾癌伴发下腔静脉癌栓切除术前评估中的应用价值[J]. 介入放射学杂志, 2020, 29: 824-829. DOI:10.3969/j.issn.1008-794X.2020.08.019 |
| [3] |
MANN G N, MANN L V, LEVINE E A, SHEN P. Primary leiomyosarcoma of the inferior vena cava: a 2-institution analysis of outcomes[J]. Surgery, 2012, 151: 261-267. DOI:10.1016/j.surg.2010.10.011 |
| [4] |
DZSINICH C, GLOVICZKI P, VAN HEERDEN J A, NAGORNEY D M, PAIROLERO P C, JOHNSON C M, et al. Primary venous leiomyosarcoma: a rare but lethal disease[J]. J Vasc Surg, 1992, 15: 595-603. DOI:10.1016/0741-5214(92)90003-Q |
| [5] |
ZHOU X, WANG M, LI S, CAI H, LIANG L, LI Z P, et al. A case of a huge inferior vena cava leiomyosarcoma: precise preoperative evaluation with gadobutrol-enhanced MRI[J]. Cancer Manag Res, 2020, 12: 7929-7939. DOI:10.2147/CMAR.S258990 |
| [6] |
邵世虎, 吴志远, 王忠敏, 丁晓毅, 曾小松, 梅露. 腹膜后平滑肌肉瘤CT、MRI诊断与病理对比分析[J]. 中国医学计算机成像杂志, 2018, 24: 224-228. DOI:10.3969/j.issn.1006-5741.2018.03.009 |
| [7] |
THOMPSON M M, FIRMIN R K, BOLIA A A, GRAHAM T R, BELL P R. Primary venous leiomyosarcoma: a rare but lethal disease[J]. J Vasc Surg, 1993, 17: 447-448. |
| [8] |
VALDÉS DEVESA V, CONLEY C R, STONE W M, COLLINS J M, MAGRINA J F. Update on intravenous leiomyomatosis: report of five patients and literature review[J]. Eur J Obstet Gynecol Reprod Biol, 2013, 171: 209-213. DOI:10.1016/j.ejogrb.2013.09.031 |
| [9] |
KOTER S H, TIESENHAUSEN K. Intravenous leiomyomatosis extending from the pelvic veins to the heart[J]. Eur J Vasc Endovasc Surg, 2017, 54: 219. DOI:10.1016/j.ejvs.2017.04.006 |
| [10] |
WOODRUFF D Y, VAN VELDHUIZEN P, MUEHLEBACH G, JOHNSON P, WILLIAMSON T, HOLZBEIERLEIN J M. The perioperative management of an inferior vena caval tumor thrombus in patients with renal cell carcinoma[J]. Urol Oncol, 2013, 31: 517-521. DOI:10.1016/j.urolonc.2011.03.006 |
| [11] |
DINDO D, DEMARTINES N, CLAVIEN P A. Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey[J]. Ann Surg, 2004, 240: 205-213. DOI:10.1097/01.sla.0000133083.54934.ae |
| [12] |
BENKIRANE A, KHODARI M, YAKOUBI R, LAMBERT M, KOUSSA M, GHONEIM T, et al. Polytetrafluoroethylene expanded prosthesis as replacement of the inferior vena cava in renal cell carcinoma with caval thrombus[J]. Int J Urol, 2014, 21: 448-452. DOI:10.1111/iju.12339 |
| [13] |
冯翔, 吕晨, 陈锐, 花梅免, 陆晓俊, 宋子健. 下腔静脉延迟阻断法在Mayo 2级静脉癌栓取出术中的应用(附光盘)[J]. 现代泌尿外科杂志, 2019, 24: 332-335. DOI:10.3969/j.issn.1009-8291.2019.05.002 |
| [14] |
REESE A C, WHITSON J M, MENG M V. Natural history of untreated renal cell carcinoma with venous tumor thrombus[J]. Urol Oncol, 2013, 31: 1305-1309. DOI:10.1016/j.urolonc.2011.12.006 |
| [15] |
黄建刚, 王金永, 郭美萍. 原发性下腔静脉平滑肌肉瘤两例的诊治体会[J]. 国际外科学杂志, 2018, 45: 41-43. |
| [16] |
JOUNG H S, NOOROMID M J, ESKANDARI M K, WAYNE J D. Surgical approach, management, and oncologic outcomes of primary leiomyosarcoma of the inferior vena cava: an institutional case series[J]. J Surg Oncol, 2020, 122: 1348-1355. DOI:10.1002/jso.26163 |
| [17] |
GAIGNARD E, BERGEAT D, ROBIN F, CORBIÈRE L, RAYAR M, MEUNIER B. Inferior vena cava leiomyosarcoma: what method of reconstruction for which type of resection?[J]. World J Surg, 2020, 44: 3537-3544. DOI:10.1007/s00268-020-05602-2 |
| [18] |
HIRONO M, KOBAYASHI M, TSUSHIMA T, OBARA W, SHINOHARA N, ITO K, et al. Impacts of clinicopathologic and operative factors on short-term and long-term survival in renal cell carcinoma with venous tumor thrombus extension: a multi-institutional retrospective study in Japan[J]. BMC Cancer, 2013, 13: 447. DOI:10.1186/1471-2407-13-447 |
| [19] |
LAWINDY S M, KURIAN T, KIM T, MANGAR D, ARMSTRONG P A, ALSINA A E, et al. Important surgical considerations in the management of renal cell carcinoma (RCC) with inferior vena cava (IVC) tumour thrombus[J]. BJU Int, 2012, 110: 926-939. DOI:10.1111/j.1464-410X.2012.11174.x |
| [20] |
冯翔, 景在平, 侯建国, 高旭. 腔静脉滤器保护下肾癌下腔静脉癌栓切除[J]. 中华外科杂志, 2009, 47: 236-237. DOI:10.3760/cma.j.issn.0529-5815.2009.03.024 |
 2021, Vol. 42
2021, Vol. 42


