2. 海军军医大学(第二军医大学)基础医学院, 上海 200433
2. College of Basic Medical Sciences, Naval Medical University (Second Military Medical University), Shanghai 200433, China
黄热病毒(yellow fever virus, YFV)属于黄病毒科黄病毒属,是首个被报道的出血热病毒[1],其所引起的黄热病目前主要在非洲和南美洲等热带地区流行[2-3]。在自然界中,YFV宿主范围较窄,主要通过非人灵长类动物和食血蚊子之间的周期性传播循环存在,被携带病毒的蚊子叮咬是人类患病的主要途径[4]。尽管YFV疫苗在20世纪30年代就已研制成功,但在发展中国家的接种率非常有限。例如巴西约有2 300万人处于YFV流行地区,但接种人口仅占23%左右[5]。此外,免疫力低下人群(如艾滋病患者和正使用免疫抑制剂的患者)、孕妇、1岁以下婴儿和老人注射活疫苗可能产生严重的不良反应,甚至死亡[1]。由于流行区热带雨林存在大量YFV自然宿主,彻底阻断黄热病传播极其困难,2016年安哥拉和巴西相继暴发了黄热病疫情[6]。近年来随着全球化进程的加快,YFV感染范围不断扩大,已有近60个国家和地区报道过黄热病输入病例,我国也相继报告了来自安哥拉的11例输入性病例[7]。据统计,全球每年YFV感染人数高达20万,死亡人数超过6万[8],严重威胁人类的生命健康。
黄热病患者临床表现主要为高热、黄疸、出血、肝功能衰竭等[9]。由于尚无有效的抗YFV药物,目前临床上仅能对患者采取对症和支持治疗[10-11]。不同病毒蛋白在YFV感染过程各个阶段都发挥着重要作用,其不仅影响YFV的感染性、致病性,也是决定病毒传播力、毒力的关键物质。因此,病毒蛋白是研发抗YFV药物的重要靶点。YFV是一类有包膜的单正链RNA病毒,其基因组编码3种结构蛋白和7种非结构蛋白(non-structural protein, NS),前者包括包膜(envelope, E)蛋白、前膜(precursor-membrane, prM)蛋白、衣壳(capsid, C)蛋白,后者由NS1、NS2A、NS2B、NS3、NS4A、NS4B和NS5组成[12-13]。结构蛋白包裹病毒核酸、组装病毒颗粒,NS参与病毒复制并在免疫逃逸等过程中发挥作用[14],它们均可作为抗病毒药物的靶向分子。本文将重点介绍YFV感染过程中发挥作用的关键病毒蛋白,并在明确它们的分子结构及功能特点的基础上,总结靶向病毒蛋白分子治疗药物的研究进展。
1 YFV的结构蛋白与靶向药物YFV E蛋白介导病毒颗粒与细胞表面受体的相互作用,帮助病毒入侵靶细胞,其功能区域包含氨基端与羧基端结构域。氨基端由3个胞外域(ectodomain, ED)构成,其中ED1连接ED2和ED3,是E蛋白在病毒复制过程中构象得以改变的关键结构;ED2在病毒与靶细胞膜吸附、融合过程中发挥重要作用[15];ED3参与病毒与受体的结合,并包含病毒特异性的中和表位[16]。E蛋白羧基端包含2个跨膜结构域,将E蛋白锚定在病毒膜上,并在prM蛋白的作用下于病毒表面进行重排[17]。
目前靶向YFV结构蛋白的药物主要是针对E蛋白表位制备的单克隆抗体及靶向E蛋白结构功能区的小分子药物,两者均可在病毒感染早期阶段阻断整个复制周期。研究表明,靶向E蛋白的单克隆抗体5A具有较强的中和活性和保护作用,5A可与E蛋白二聚体结合,占据YFV颗粒表面,阻断病毒吸附到靶细胞上;5A亦可通过干扰E蛋白重排来影响其融合环的功能,从而抑制YFV的膜融合[18]。5A的双重抑制效果使其具有较强的抗YFV作用,YFV-17D感染的BALB/c小鼠在给予腹腔注射5A治疗后,观察期内均无体重下降,且全部存活;而给予腹腔注射PBS的小鼠在接种病毒后的7 d内全部死亡[18]。单克隆抗体5A高效、特异的抗病毒作用,使其具有成为临床一线抗YFV治疗药物的良好前景。单克隆抗体2A10G6通过特异性结合E蛋白融合环上的98DRXW101基序发挥抗病毒作用,空斑中和实验表明3.6 μg/mL的2A10G6就可使YFV滴度降低50%[19]。然而,单克隆抗体制备成本昂贵、生产周期冗长复杂,极大阻碍了其在YFV感染地区尤其是低收入发展中国家的广泛运用。此外,有研究表明一些噻唑衍生物也可与E蛋白结合从而抑制病毒进入细胞[20]。
YFV prM蛋白可与E蛋白形成异二聚体prME,介导病毒颗粒向胞外出芽[21]。YFV C蛋白则主要参与病毒基因组的包装和感染性颗粒的形成[22]。目前尚无靶向prM和C蛋白的药物分子。
2 YFV的NS与靶向药物 2.1 NS1与靶向药物NS1是一类非常保守的糖蛋白,在YFV基因组复制过程中起着至关重要的作用。YFV感染细胞后可产生大量分泌型NS1,参与机体先天性和适应性免疫反应,促进YFV的免疫逃逸与致病[23]。研究显示,利用针对YFV NS1的干扰RNA(RNA interference, RNAi)沉默NS1的表达,可帮助成年BALB/c小鼠抵抗YFV的感染;组织病理学分析结果提示,在感染YFV 10 d后NS1 RNAi对小鼠的中枢神经系统仍具有显著的保护作用[24]。
2.2 NS2A、NS2B、NS3与靶向药物YFV NS2A是分子量约为22 000的小疏水蛋白,其氨基端的结构簇有助于感染性病毒颗粒的产生[25]。目前尚无针对NS2A的治疗药物。NS3氨基端区域带有经典的催化三联体(Ser-His-Asp)结构,是典型的丝氨酸蛋白酶,它与NS2B组成的复合体参与YFV复制。由于蛋白酶是调控病毒复制过程的关键因素,NS3也成为抗病毒药物的重要靶点[26]。
研究发现,伊维菌素可竞争性与NS3蛋白酶结合,抑制YFV的复制,对YFV感染的抑制作用尤其明显,3.1~6.3 nmol/L的伊维菌素可使YFV感染的Vero细胞病变减少50%以上,伊维菌素抑制YFV复制的半数有效浓度(median effective concentration, EC50)也低于0.5 nmol/L,疗效显著[27]。伊维菌素作为常用的口服抗蠕虫药,安全性较高。研究结果显示,YFV感染Vero细胞后14 h内使用伊维菌素的抑制效果最为明显,而当细胞内YFV RNA合成开始后伊维菌素将逐渐失去其抗病毒能力。因此,伊维菌素仅在黄病毒复制周期的特定阶段,即病毒解旋酶具有功能活性的时期使用才有效[27]。
2.3 NS4A、NS4B与靶向药物YFV NS4A和NS4B都是膜相关蛋白[28],两者在病毒RNA复制过程中起重要的调节作用。此外,NS4B还参与YFV的免疫逃逸,通过抑制干扰素(interferon, IFN)诱导的信号转导因子和转录激活因子(signal transducer and activator of transcription, STAT)1的磷酸化阻断IFN-α/β信号通路,干扰细胞抗病毒状态的建立[29]。研究发现,新型苯二氮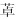
YFV NS5是病毒复制最为关键的RNA聚合酶,包含2个关键结构域:氨基端甲基转移酶结构域(methyltransferase domain, Mtase)和羧基端RNA依赖的RNA聚合酶结构域(RNA dependent RNA polymerase domain, RdRp)[31]。其中,Mtase可催化病毒加帽过程中的鸟苷酰转移反应和甲基化反应,RdRp在病毒RNA基因组复制过程中发挥主导作用。YFV NS5氨基端区域的赖氨酸泛素化后,可与IFN通路下游的人类STAT2结合,抑制细胞内Ⅰ型IFN信号通路,逃避固有免疫杀伤作用,促进病毒的复制与扩散[32]。因此,靶向NS5的药物分子具有抑制YFV的复制并增强Ⅰ型IFN介导的抗病毒作用。
目前研究较多的NS5靶向药物是索非布韦,它是广谱的RNA聚合酶抑制剂,2013年获得美国FDA批准,临床上主要用于治疗丙型肝炎患者。索非布韦通过保守的氨基酸残基与YFV NS5蛋白上RdRp结合而影响其功能,抑制YFV的复制。体外实验结果显示,索非布韦可阻止YFV野生株和疫苗株在人肝癌细胞Huh-7和HepG2中的复制,并且这种抑制作用呈剂量依赖性。用索非布韦治疗YFV感染的Swiss小鼠和A129小鼠,可降低小鼠的死亡率和血清中丙氨酸转氨酸水平[33]。临床实践显示2例YFV感染患者在使用索非布韦治疗后病毒血症减轻[34]。索非布韦的临床抗病毒疗效还需进一步评估,此外,因价格昂贵,该药在发展中国家中普及性较差。
法匹拉韦是一种新型抗流感病毒药物,它通过与RdRp结合抑制病毒复制,也具有抗YFV作用,但需要更高的浓度。在YFV感染的Vero细胞中加入330 μmol/L法匹拉韦可使病毒感染率下降90%[35]。在YFV感染前后每天口服法匹拉韦400 mg/kg,可提高YFV感染仓鼠的生存率、降低血清中丙氨酸转氨酶水平;未感染仓鼠每天口服400 mg/kg法匹拉韦未出现任何毒性反应,表明法匹拉韦抗YFV作用有效且安全性好[35]。
3 小结YFV的结构蛋白和非结构蛋白在病毒的入侵、复制、组装、释放及免疫逃逸等过程中发挥重要的作用,针对其蛋白结构或功能研发具有靶向作用的抗YFV药物是控制黄热病病程发展和传播的重要手段。现有的靶向药物大多在体内外实验中表现出良好的抗YFV效果,若要运用于临床治疗YFV患者仍需进一步的临床试验加以评估。近年来,黄热病有流行和蔓延的趋势,一旦疫情暴发将严重威胁人类生命健康。为了应对挑战,WHO于2017年启动了消除黄热病战略(Eliminate Yellow Fever Epidemics, EYE)。随着疫苗覆盖率的增高及有效药物的研发和使用,黄热病的感染率和死亡率有望逐年降低,进而在世界范围内消除黄热病。
| [1] |
GUARNER J, HALE G L. Four human diseases with significant public health impact caused by mosquito-borne flaviviruses: West Nile, Zika, dengue and yellow fever[J]. Semin Diagn Pathol, 2019, 36: 170-176. DOI:10.1053/j.semdp.2019.04.009 |
| [2] |
BECK A, GUZMAN H, LI L, ELLIS B, TESH R B, BARRETT A D. Phylogeographic reconstruction of African yellow fever virus isolates indicates recent simultaneous dispersal into east and west Africa[J/OL]. PLoS Negl Trop Dis, 2013, 7: e1910. DOI: 10.1371/journal.pntd.0001910.
|
| [3] |
MONATH T P, VASCONCELOS P F C. Yellow fever[J]. J Clin Virol, 2015, 64: 160-173. DOI:10.1016/j.jcv.2014.08.030 |
| [4] |
MONATH T P. Yellow fever: an update[J]. Lancet Infect Dis, 2001, 1: 11-20. DOI:10.1016/S1473-3099(01)00016-0 |
| [5] |
DOUAM F, PLOSS A. Yellow fever virus: knowledge gaps impeding the fight against an old foe[J]. Trends Microbiol, 2018, 26: 913-928. DOI:10.1016/j.tim.2018.05.012 |
| [6] |
KLEINERT R D V, MONTOYA-DIAZ E, KHERA T, WELSCH K, TEGTMEYER B, HOEHL S, et al. Yellow fever: integrating current knowledge with technological innovations to identify strategies for controlling a re-emerging virus[J/OL]. Viruses, 2019, 11: 960. DOI: 10.3390/v11100960.
|
| [7] |
WANG Y L, WANG X, LIU X B, REN R Q, ZHOU L, LI C, et al. Epidemiology of imported infectious diseases, China, 2005-2016[J]. Emerg Infect Dis, 2018, 25: 33-41. DOI:10.3201/eid2501.180178 |
| [8] |
FARIA N R, KRAEMER M U G, HILL S C, GOES DE JESUS J, AGUIAR R S, IANI F C M, et al. Genomic and epidemiological monitoring of yellow fever virus transmission potential[J]. Science, 2018, 361: 894-899. DOI:10.1126/science.aat7115 |
| [9] |
HOLANDA G M, CASSEB S M M, MELLO K F L, VASCONCELOS P F C, CRUZ A C R. Yellow fever virus modulates the expression of key proteins related to the microRNA pathway in the human hepatocarcinoma cell line HepG2[J]. Viral Immunol, 2017, 30: 336-341. DOI:10.1089/vim.2016.0149 |
| [10] |
GARDNER C L, RYMAN K D. Yellow fever: a reemerging threat[J]. Clin Lab Med, 2010, 30: 237-260. DOI:10.1016/j.cll.2010.01.001 |
| [11] |
HEINZ F X, STIASNY K. Flaviviruses and flavivirus vaccines[J]. Vaccine, 2012, 30: 4301-4306. DOI:10.1016/j.vaccine.2011.09.114 |
| [12] |
FERNANDES-MONTEIRO A G, TRINDADE G F, YAMAMURA A M, MOREIRA O C, DE PAULA V S, DUARTE A C, et al. New approaches for the standardization and validation of a real-time qPCR assay using TaqMan probes for quantification of yellow fever virus on clinical samples with high quality parameters[J]. Hum Vaccin Immunother, 2015, 11: 1865-1871. DOI:10.4161/21645515.2014.990854 |
| [13] |
PATKAR C G, LARSEN M, OWSTON M, SMITH J L, KUHN R J. Identification of inhibitors of yellow fever virus replication using a replicon-based high-throughput assay[J]. Antimicrob Agents Chemother, 2009, 53: 4103-4114. DOI:10.1128/AAC.00074-09 |
| [14] |
LINDENBACH B D, THIEL H J, RICE C M. Flaviviridae: the virus and their replication[M]//KNIPE D M, HOWLEY P M. Fields virology. 5th ed. Philadelphia, PA: Lippincott Williams & Wilkins, 2007: 1101-1152.
|
| [15] |
DAVIS E H, BARRETT A D T. Structure-function of the yellow fever virus envelope protein: analysis of antibody epitopes[J]. Viral Immunol, 2020, 33: 12-21. DOI:10.1089/vim.2019.0107 |
| [16] |
VOLK D E, MAY F J, GANDHAM S H, ANDERSON A, VON LINDERN J J, BEASLEY D W, et al. Structure of yellow fever virus envelope protein domain Ⅲ[J]. Virology, 2009, 394: 12-18. DOI:10.1016/j.virol.2009.09.001 |
| [17] |
OP DE BEECK A, MOLENKAMP R, CARON M, BEN YOUNES A, BREDENBEEK P, DUBUISSON J. Role of the transmembrane domains of prM and E proteins in the formation of yellow fever virus envelope[J]. J Virol, 2003, 77: 813-820. DOI:10.1128/JVI.77.2.813-820.2003 |
| [18] |
LU X S, XIAO H X, LI S H, PANG X F, SONG J, LIU S, et al. Double lock of a human neutralizing and protective monoclonal antibody targeting the yellow fever virus envelope[J/OL]. Cell Rep, 2019, 26: 438-446. e5. DOI: 10.1016/j.celrep.2018.12.065.
|
| [19] |
DENG Y Q, DAI J X, JI G H, JIANG T, WANG H J, YANG H O, et al. A broadly flavivirus cross-neutralizing monoclonal antibody that recognizes a novel epitope within the fusion loop of E protein[J/OL]. PLoS One, 2011, 6: e16059. DOI: 10.1371/journal.pone.0016059.
|
| [20] |
MAYHOUB A S, KHALIQ M, KUHN R J, CUSHMAN M. Design, synthesis, and biological evaluation of thiazoles targeting flavivirus envelope proteins[J]. J Med Chem, 2011, 54: 1704-1714. DOI:10.1021/jm1013538 |
| [21] |
CICZORA Y, CALLENS N, SÉRON K, ROUILLÉ Y, DUBUISSON J. Identification of a dominant endoplasmic reticulum-retention signal in yellow fever virus pre-membrane protein[J]. J Gen Virol, 2010, 91(Pt 2): 404-414. |
| [22] |
PATKAR C G, JONES C T, CHANG Y H, WARRIER R, KUHN R J. Functional requirements of the yellow fever virus capsid protein[J]. J Virol, 2007, 81: 6471-6481. DOI:10.1128/JVI.02120-06 |
| [23] |
WANG H Y, HAN M, QI J X, HILGENFELD R, LUO T R, SHI Y, et al. Crystal structure of the C-terminal fragment of NS1 protein from yellow fever virus[J]. Sci China Life Sci, 2017, 60: 1403-1406. DOI:10.1007/s11427-017-9238-8 |
| [24] |
PACCA C C, SEVERINO A A, MONDINI A, RAHAL P, D'AVILA S G, CORDEIRO J A, et al. RNA interference inhibits yellow fever virus replication in vitro and in vivo[J]. Virus Genes, 2009, 38: 224-231. DOI:10.1007/s11262-009-0328-3 |
| [25] |
VOßMANN S, WIESELER J, KERBER R, KÜMMERER B M. A basic cluster in the N terminus of yellow fever virus NS2A contributes to infectious particle production[J]. J Virol, 2015, 89: 4951-4965. DOI:10.1128/JVI.03351-14 |
| [26] |
NOSKE G D, GAWRILJUK V O, FERNANDES R S, FURTADO N D, BONALDO M C, OLIVA G, et al. Structural characterization and polymorphism analysis of the NS2B-NS3 protease from the 2017 Brazilian circulating strain of yellow fever virus[J/OL]. Biochim Biophys Acta Gen Subj, 2020, 1864: 129521. DOI: 10.1016/j.bbagen.2020.129521.
|
| [27] |
MASTRANGELO E, PEZZULLO M, DE BURGHGRAEVE T, KAPTEIN S, PASTORINO B, DALLMEIER K, et al. Ivermectin is a potent inhibitor of flavivirus replication specifically targeting NS3 helicase activity: new prospects for an old drug[J]. J Antimicrob Chemother, 2012, 67: 1884-1894. DOI:10.1093/jac/dks147 |
| [28] |
ZHANG W J, LI X M, LIN Y, TIAN D H. Identification of three H-2Kd restricted CTL epitopes of NS4A and NS4B protein from yellow fever 17D vaccine[J]. J Virol Methods, 2013, 187: 304-313. DOI:10.1016/j.jviromet.2012.10.002 |
| [29] |
VIDOTTO A, MORAIS A T, RIBEIRO M R, PACCA C C, TERZIAN A C, GIL L H, et al. Systems biology reveals NS4B-cyclophilin A interaction: a new target to inhibit YFV replication[J]. J Proteome Res, 2017, 16: 1542-1555. DOI:10.1021/acs.jproteome.6b00933 |
| [30] |
GUO F, WU S, JULANDER J, MA J L, ZHANG X X, KULP J, et al. A novel benzodiazepine compound inhibits yellow fever virus infection by specifically targeting NS4B protein[J]. J Virol, 2016, 90: 10774-10788. DOI:10.1128/JVI.01253-16 |
| [31] |
DUBANKOVA A, BOURA E. Structure of the yellow fever NS5 protein reveals conserved drug targets shared among flaviviruses[J/OL]. Antiviral Res, 2019, 169: 104536. DOI: 10.1016/j.antiviral.2019.104536.
|
| [32] |
LAURENT-ROLLE M, MORRISON J. The role of NS5 protein in determination of host cell range for yellow fever virus[J]. DNA Cell Biol, 2019, 38: 1414-1417. DOI:10.1089/dna.2019.5115 |
| [33] |
DE FREITAS C S, HIGA L M, SACRAMENTO C Q, FERREIRA A C, REIS P A, DELVECCHIO R, et al. Yellow fever virus is susceptible to sofosbuvir both in vitro and in vivo[J/OL]. PLoS Negl Trop Dis, 2019, 13: e0007072. DOI: 10.1371/journal.pntd.0007072.
|
| [34] |
MENDES É A, PILGER D R B, SANTOS NASTRI A C S, MALTA F M, PASCOALINO B D S, CARNEIRO D'ALBUQUERQUE L A, et al. Sofosbuvir inhibits yellow fever virus in vitro and in patients with acute liver failure[J]. Ann Hepatol, 2019, 18: 816-824. DOI:10.1016/j.aohep.2019.09.001 |
| [35] |
JULANDER J G, SHAFER K, SMEE D F, MORREY J D, FURUTA Y. Activity of T-705 in a hamster model of yellow fever virus infection in comparison with that of a chemically related compound, T-1106[J]. Antimicrob Agents Chemother, 2009, 53: 202-209. DOI:10.1128/AAC.01074-08 |
 2021, Vol. 42
2021, Vol. 42


