2. 上海交通大学医学院附属瑞金医院超声科, 上海 210025
2. Department of Ultrasound, Ruijin Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 210025, China
2017年欧洲泌尿外科学会年会指出,肾肿瘤的影像学诊断主要依靠超声、CT和MRI,并且增强检查是鉴别肿瘤良恶性最重要的方法;对于CT检查未能明确的肾肿瘤,推荐使用超声造影进一步诊断和鉴别诊断[1]。肾透明细胞癌(clear cell renal cell carcinoma,ccRCC)是泌尿系统起源恶性肿瘤中致死率最高的病理类型,居癌症相关死亡原因第6位,是成人最常见的肾原发性恶性肿瘤,好发年龄为60~70岁,男女发病比例约为2∶1,5年生存率约为45%[2];肾血管平滑肌脂肪瘤(renal angiomyolipoma,RAML)是肾脏最常见的良性肿瘤。两者的治疗方法和预后截然不同,如何做出准确的诊断对临床治疗决策极为重要。超声造影具有实时、无创、便捷、无肾毒性等优点,在临床应用中得到了一致认可。本研究通过分析RAML和ccRCC的超声造影特点,探讨超声造影在这2种最常见的肾占位性病变的诊断及鉴别诊断中的应用价值。
1 资料和方法 1.1 研究对象回顾性分析2015年6月至2020年8月在上海交通大学医学院附属瑞金医院及无锡分院进行超声检查的117例肾肿瘤患者的影像学资料,包括ccRCC患者86例、RAML患者31例。所有ccRCC病灶均取得手术病理结果,16枚RAML病灶取得手术或活检病理结果,22枚RAML病灶经增强CT或MRI进一步检查及长期随访证实。本研究通过上海交通大学医学院附属瑞金医院药物临床试验伦理委员会审批[(2018)伦审第(8)号-2]。
1.2 检查仪器及造影剂Mindray Re 7S和Re 8(深圳迈瑞生物医疗电子股份有限公司,探头型号为SC5-1U)或ESAOTE MyLabTwice(意大利百胜集团,探头型号为CA541)彩色超声诊断仪。造影剂使用声诺维(SonoVue,意大利Bracco公司),每瓶含六氟化硫(SF6)气体59 mg,使用前注入5 mL生理盐水充分震荡摇匀形成微泡混悬液。
1.3 检查方法与检查内容患者取合适体位,首先进行常规超声检查,测量肿瘤的大小,观察肿瘤的回声、边界、有无血流信号等情况,并将肿瘤分为低回声组(包括低回声、实性成分为低回声的囊实性混合回声)及非低回声组(包括高回声、等回声、实性成分为高或等回声的囊实性混合回声)。随后选取能清晰显示肿瘤及其周围肾实质的最佳切面作为造影观察切面,嘱患者平静、缓慢呼吸,选择低机械指数造影模式,经肘部浅静脉团注造影剂(每次造影注射0.8~1.0 mL)并追加5 mL生理盐水,同时按下计时按钮,使用高清硬盘刻录全程,连续观察肿瘤及瘤旁肾组织的动态灌注过程3~4 min。如需重复造影,2次间隔时间须>15 min。以周围肾皮质为参照,观察病灶的超声造影灌注方式(造影剂进入病灶时间早于或同步于周围肾皮质为“快进”,反之为“慢进”)、消退方式(造影剂退出病灶时间早于或同步于周围肾皮质为“快退”,反之为“慢退”)、灌注强度(病灶造影剂灌注峰值强度高于或等于周围肾皮质为“高灌注”,反之为“低灌注”)、灌注均匀性(病灶内无造影剂灌注缺损区域为“均匀灌注”,反之为“不均匀灌注”)及有无周边环状增强。由经验丰富的超声科主治医师和副主任医师各1名对超声造影图像逐帧回放观察、分析,独立判断,观察病灶和周围肾皮质各时相的造影剂灌注和消退等情况,并记录相应数据。以病理结果或增强CT、增强MRI检查结果为金标准,比较常规超声和超声造影对低回声与非低回声组肾肿瘤的鉴别诊断价值,并对所有可能出现的超声造影征象单独及联合诊断价值逐一进行分析。
1.4 统计学处理全部资料以Excel 2013软件建立数据库,应用SPSS 23.0软件进行统计学分析。计量资料以x±s表示,两组间比较采用独立样本t检验;计数资料以例数和百分数表示,组间比较采用χ2检验或Fisher确切概率法。筛选出可以鉴别诊断ccRCC与RAML的常规超声及超声造影声像图特征,计算相应的准确度、灵敏度、特异度、阳性预测值及阴性预测值。检验水准(α)为0.05。
2 结果 2.1 患者一般情况117例肾肿瘤患者共检出126枚病灶。其中ccRCC患者86例,男57例58枚病灶、女29例30枚病灶,患者年龄为(57.69±12.43)岁(29~86岁),病灶最大径为(31.34±14.26)mm(11~97 mm);RAML患者31例,男11例14枚病灶、女20例24枚病灶,患者年龄为(47.72±12.64)岁(26~68岁),病灶最大径为(25.25±14.25)mm(11~85 mm)。两组患者性别、年龄及病灶大小差异均有统计学意义(χ2=9.156,t=4.111、2.201;P均<0.05)。
2.2 常规超声对ccRCC与RAML的鉴别诊断能力分析ccRCC病灶以低回声(78.41%,69/88)、富血供(53.41%,47/88)、边界清晰(92.05%,81/88)为主,RAML病灶以非低回声(86.84%,33/38)、乏血供(68.42%,26/38)、边界清晰(97.37%,37/38)为主,两者在回声水平及血供分布方面差异均有统计学意义(χ2=46.621、5.080,P均<0.05),而病变边界情况的差异无统计学意义(P>0.05)。以富血供为ccRCC的诊断标准、乏血供为RAML的诊断标准,分析常规超声对低回声组和非低回声组ccRCC(分别为69和19枚)与RAML(分别为5和33枚)病灶的鉴别诊断价值,结果如表 1所示,常规超声鉴别诊断低回声组ccRCC与RAML病灶的特异度和阳性预测值均较高(分别为80.00%和97.56%),鉴别诊断非低回声组的准确度、灵敏度、特异度、阳性预测值、阴性预测值均较低。
|
|
表 1 常规超声及常规超声结合超声造影对ccRCC与RAML鉴别诊断的效能比较 Tab 1 Efficacy comparison of conventional ultrasound and its combination with contrast-enhanced ultrasound in differential diagnosis of ccRCC and RAML |
2.3 超声造影对ccRCC和RAML的鉴别诊断能力分析
见表 2,ccRCC病灶以快进、快退、高灌注和不均匀灌注为主,周边环状增强较常见(图 1);RAML病灶以快退、低灌注、均匀灌注为主,快进与慢进各占50.00%,周边环状增强少见(图 2);两组病灶的造影剂灌注方式、灌注强度、灌注均匀性和环状增强情况差异均有统计学意义(P均<0.01),而消退方式差异无统计学意义(P>0.05)。见表 3,快进+高灌注对ccRCC与RAML鉴别诊断的准确度、灵敏度均较高,快进+不均匀灌注+环状增强对ccRCC与RAML鉴别诊断的特异度和阳性预测值均达100.00%。
|
|
表 2 ccRCC和RAML病灶超声造影声像图特征比较 Tab 2 Comparison of contrast-enhanced ultrasound characteristics between ccRCC and RAML lesions |
|
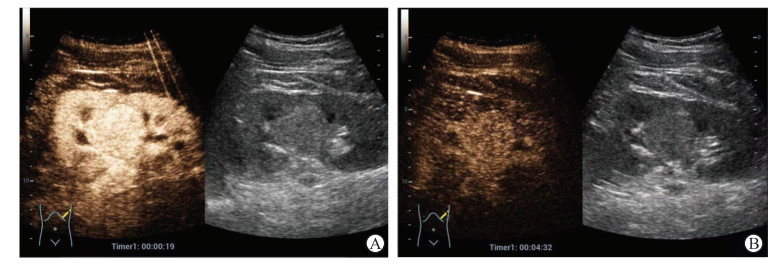
图 1 1例ccRCC患者的常规超声与超声造影声像图 Fig 1 Conventional ultrasound and contrast-enhanced ultrasound images of a ccRCC patient Male, 39 years old. Gray-scale ultrasound examination showed a hyper-echoic well-demarcated mass, while contrast-enhanced ultrasound examination showed relatively homogeneous hyper-enhancement in both arterial phase (A, 19 s) and late phase (B, 4 min 32 s), displaying the rapid wash-in and slow wash-out patterns. ccRCC: Clear cell renal cell carcinoma. |
|
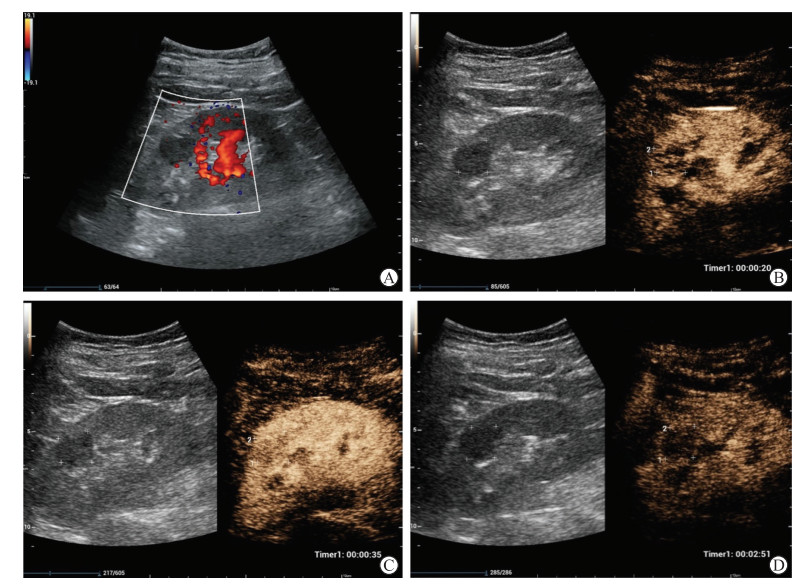
图 2 1例RAML患者的常规超声与超声造影声像图 Fig 2 Conventional ultrasound and contrast-enhanced ultrasound images of a RAML patient Male, 61 years old. Color Doppler flow image demonstrated a well-demarcated hypo-echoic mass without major vascularization (A), while contrast-enhanced ultrasound showed hypo-enhancement in arterial phase (B, 20 s), relatively homogeneous and slightly hypo-enhancement in venous phase (C, 35 s), and hypo-enhancement in late phase (D, 2 min 51 s), displaying the slow wash-in and rapid wash-out patterns. RAML: Renal angiomyolipoma. |
|
|
表 3 超声造影声像图特征单独及联合使用对ccRCC与RAML的鉴别诊断价值 Tab 3 Differential diagnostic value of contrast-enhanced ultrasonographic features used alone or in combination for ccRCC and RAML |
2.4 常规超声与常规超声结合超声造影对ccRCC和RAML的鉴别诊断价值比较
见表 1,以超声造影呈快进和高灌注为ccRCC的诊断标准,常规超声结合超声造影对低回声组ccRCC与RAML病灶鉴别诊断的准确度和灵敏度均优于常规超声(P均<0.01),阳性预测值和阴性预测值也均高于常规超声,但差异均无统计学意义(P均>0.05);对非低回声组ccRCC与RAML病灶鉴别诊断的准确度、灵敏度、阴性预测值均优于常规超声(P均<0.05),特异度和阳性预测值亦均高于常规超声,但差异均无统计学意义(P均>0.05)。
3 讨论超声检查作为最常用的影像学筛查手段,可以筛选出约90%的肾占位性病变,但对于病灶的确诊有一定的局限性,需要结合增强检查。RAML是最常见的肾脏良性肿瘤,一般随访观察即可,在瘤体较大或伴有出血等情况时可采取保留肾脏的肿瘤切除术。文献报道肾细胞癌占肾脏恶性肿瘤的90%~95%,其中70%为ccRCC[3],临床处理策略为局部切除或根治性肾切除术[4-5]。如何有效提高肾肿瘤诊断的准确度以促进临床精准治疗是值得关注的问题。
据报道ccRCC以富血供的低回声团块常见,RAML以乏血供的高回声团块常见,但研究显示高回声的肾癌和低回声的RAML亦不少见[3, 6],不典型病例的常规超声表现常有交叉,高回声的肾癌和低回声的RAML是超声鉴别诊断的难点。本组资料显示53.41%(47/88)的ccRCC和31.58%(12/38)的RAML内可见血流信号,非低回声的ccRCC和低回声的RAML分别占21.59%(19/88)和13.16%(5/38),后者病理类型多为少脂肪或乏脂肪型。
常规超声结合超声造影有助于ccRCC和RAML的鉴别诊断,但造影剂灌注强度对于鉴别肾脏肿瘤良恶性的价值目前存在争议。有学者认为肾癌和RAML行超声造影后灌注强度差异并无统计学意义[7],也有学者研究认为肾良性肿瘤的灌注强度明显低于肾脏恶性肿瘤[8-9],还有学者认为ccRCC的灌注强度与病灶大小有关,病灶越大灌注强度越高[10]。本组资料显示高灌注是ccRCC和RAML鉴别诊断的有效指标,准确度、灵敏度、阳性预测值和阴性预测值均较高(分别为84.92%、93.18%、86.32%和80.65%),高灌注率在两者之间差异亦有统计学意义[ccRCC与RAML分别为93.18%(82/88)和34.21%(13/38),P<0.01]。在超声造影相关诊断指标中表现为快进征象的肿瘤倾向于恶性,鉴别诊断ccRCC与RAML的准确度、灵敏度、阳性预测值和阴性预测值均较高(分别为81.75%、95.45%、81.55%和82.61%),并且ccRCC与RAML病灶出现快进征象的概率差异有统计学意义[95.45%(84/88)vs 50.00%(19/38),P<0.01],这与薛继平等[11]的研究结果一致。分析可能原因是恶性肿瘤的新生血管数量较多、内径粗大、破坏正常血管后形成动静脉瘘,使病灶血供丰富,因而造影剂灌注速度快、程度高、持续时间短、消退快。RAML病灶内血管成分少、管腔细、管壁缺乏弹力层等可能是导致超声造影表现为灌注速率较慢、灌注强度低的病理学基础,微气泡在迂曲的微血管网内反复循环可能是造影剂消退延迟的原因。本组资料结果显示,71.59%(63/88)的ccRCC和68.42%(26/38)的RAML病灶呈快退征象,消退方式在两组之间差异无统计学意义(P=0.720),这与Dai等[12]的研究结果相似,但也有学者研究认为造影剂快速消退多见于肾恶性肿瘤,很少出现在肾良性肿瘤[13]。本组资料中1例上皮样血管平滑肌脂肪瘤病灶在常规超声呈低回声、富血供表现,超声造影表现为快进、慢退、高灌注和均匀灌注,与既往研究结果[14-16]一致。其原因可能为上皮样血管平滑肌脂肪瘤内脂肪成分及梭形平滑肌细胞稀少或缺乏,肿瘤细胞呈上皮样,具有潜在恶性,故在影像学和组织学上与肉瘤样变的肾癌或低分化肾癌类似而难以鉴别[17]。
恶性肿瘤内部血供不能满足其快速生长的需求,造成肿瘤内相对缺血而出现变性、坏死及囊性变,这是超声造影表现为不均匀灌注的原因。不均匀灌注鉴别诊断ccRCC与RAML的阳性预测值为91.30%,并且ccRCC与RAML病灶表现为不均匀灌注的概率差异有统计学意义[71.59%(63/88)vs 15.79%(6/38),P<0.01],该结果与忻晓洁等[18]及周青和陈琴[19]的研究结果一致。但本组资料38枚RAML病灶中有6枚呈不均匀灌注,这与Lu等[20]报道的所有入组RAML病灶(n=18)均呈均匀灌注不同,可能与病灶内出血或血栓形成有关。
既往研究对RAML周围是否存在假包膜有争议[7, 18]。肿瘤在膨胀性生长过程中压迫周围肾实质形成的由纤维结缔组织组成的纤维膜状结构是肾癌周围显示环状增强即“假包膜征”的病理基础[8, 21],但肿瘤细胞可以浸润、突破假包膜进入正常肾组织[22]。本组资料中10.53%(4/38)的RAML周围见环状增强,ccRCC周围环状增强显示率为34.09%(30/88),其中2例假包膜不完整。病灶周围环状增强征象鉴别诊断ccRCC与RAML的特异度和阳性预测值均较高(分别为89.47%、88.24%),但灵敏度较低(34.09%),病灶周围环状增强率在两组间差异也有统计学意义(P=0.006),与多数学者研究结果[8, 12]一致。刘龙等[10]研究认为肿瘤越大其“假包膜征”检出率越高,Cao等[8]报道大小为(40.4±22.1)mm的ccRCC病灶“假包膜征”的检出率为76.7%。本组资料中ccRCC病灶偏小,最大径为(31.34±14.26)mm,“假包膜征”检出率也相对偏低。
以上所述4种超声造影征象在ccRCC与RAML的鉴别诊断中以高灌注的准确度最高、环状增强的特异度最高、快进的灵敏度及阴性预测值最高、不均匀灌注的阳性预测值最高。当联合2种诊断指标进行鉴别诊断时,快进+高灌注的准确度和灵敏度均较高,可有效提高ccRCC的诊断准确度、降低漏诊率。联合3种诊断指标进行ccRCC预判时,快进+不均匀灌注+环状增强的特异度和阳性预测值均达到100.00%,串联以上4种诊断指标同样可以达到100.00%的特异度和阳性预测值,但此时准确度、灵敏度及阴性预测值较低。Dai等[12]和Cao等[8]认为“假包膜征”诊断ccRCC的特异度最高(分别为88.0%、90.9%),徐勇等[9]研究认为高灌注+不均匀灌注诊断ccRCC的灵敏度、特异度、阳性预测值和阴性预测值分别为48.00%、91.89%、92.31%和46.58%,均与本研究结果相似。但既往研究多聚焦于1种或几种典型表现的诊断价值,本研究对临床工作中所有可能同时出现的超声造影征象一一进行了分析和总结,以期更好地指导临床应用。
常规超声是所有超声新技术应用的基础,而超声造影弥补了常规超声难以探测小血管及低速血流的不足,2种方法结合使用对低回声组ccRCC与RAML的鉴别诊断可同时达到较高的准确度、灵敏度、特异度和阳性预测值,对非低回声组ccRCC与RAML的鉴别诊断也可达到较高的灵敏度和阴性预测值。相较于增强CT或MRI检查,超声造影检查操作简便,无放射性损伤,可实时连续动态观察组织微循环灌注情况,必要时可多次重复检查,具有较好的临床应用前景,且声诺维是纯血池造影剂,主要经肺排泄,无肝、肾及心脏毒性,过敏反应发生率极低[23]。但本研究存在一定局限性,如RAML病灶数较少(n=38),可能会存在选择性偏倚,在今后的工作中仍需扩大样本量进行研究。
综上所述,常规超声和超声造影声像图特征对于ccRCC和RAML的诊断和鉴别诊断具有重要价值,2种检查方法结合可有效提高诊断效能。特别是当灰阶超声显示为高回声而超声造影检查表现为快进、高灌注、不均匀灌注伴或不伴环状增强时,可基本排除RAML做出恶性肿瘤的诊断,避免延误临床治疗;灰阶超声显示为低回声而超声造影呈低灌注、均匀灌注的肿瘤则倾向于RAML,可建议密切随访观察或结合CT或MRI检查,避免引起临床过度治疗。但对于部分表现不典型的患者仍需要结合临床进行综合判断以做出正确的治疗决策。
| [1] |
张树栋, 马潞林. 2017年欧洲泌尿外科学会年会肾癌指南更新及研究进展[J]. 中华泌尿外科杂志, 2017, 38: 485-488. DOI:10.3760/cma.j.issn.1000-6702.2017.07.002 |
| [2] |
REIMANN R, RÜBENTHALER J, HRISTOVA P, STAEHLER M, REISER M, CLEVERT D A. Characterization of histological subtypes of clear cell renal cell carcinoma using contrast-enhanced ultrasound (CEUS)[J]. Clin Hemorheol Microcirc, 2015, 63: 77-87. |
| [3] |
WEI S P, XU C L, ZHANG Q, ZHANG Q R, ZHAO Y E, HUANG P F, et al. Contrast-enhanced ultrasound for differentiating benign from malignant solid small renal masses: comparison with contrast-enhanced CT[J]. Abdom Radiol (NY), 2017, 42: 2135-2145. DOI:10.1007/s00261-017-1111-x |
| [4] |
HÖTKER A M, MAZAHERI Y, WIBMER A, KARLO C A, ZHENG J, MOSKOWITZ C S, et al. Differentiation of clear cell renal cell carcinoma from other renal cortical tumors by use of a quantitative multiparametric MRI approach[J]. AJR Am J Roentgenol, 2017, 208: W85-W91. DOI:10.2214/AJR.16.16652 |
| [5] |
SUN J, XING Z, XING W, ZHENG L, CHEN J, FAN M, et al. Intratumoral macroscopic fat and hemorrhage combination useful in the differentiation of benign and malignant solid renal masses[J/OL]. Medicine (Baltimore), 2016, 95: e2960. DOI: 10.1097/MD.0000000000002960.
|
| [6] |
BURGAN C M, SANYAL R, LOCKHART M E. Ultrasound of renal masses[J]. Radiol Clin North Am, 2019, 57: 585-600. DOI:10.1016/j.rcl.2019.01.009 |
| [7] |
蒋珺, 陈亚青, 朱云开, 周永昌. 超声造影鉴别诊断肾透明细胞癌和肾血管平滑肌脂肪瘤[J]. 中国医学影像技术, 2010, 26: 134-137. |
| [8] |
CAO H, FANG L, CHEN L, ZHAN J, DIAO X, LIU Y, et al. The independent indicators for differentiating renal cell carcinoma from renal angiomyolipoma by contrast-enhanced ultrasound[J/OL]. BMC Med Imaging, 2020, 20: 32. DOI: 10.1186/s12880-020-00436-9.
|
| [9] |
徐勇, 张晟, 魏玺, 李秀英, 杜萍. 不同增强强度超声造影对肾脏肿物的诊断价值[J]. 中国医学影像学杂志, 2013, 21: 291-294. |
| [10] |
刘龙, 杜联芳, 史秋生, 李凡, 李刚, 高峰, 等. 超声造影定性及定量评价不同大小肾透明细胞癌[J]. 临床超声医学杂志, 2019, 21: 570-573. DOI:10.3969/j.issn.1008-6978.2019.08.003 |
| [11] |
薛继平, 王健, 康春松, 史凯玲, 李朝军. 肾脏良恶性占位性病变超声造影增强模式分析[J/CD]. 中华医学超声杂志(电子版), 2013, 10: 68-73.
|
| [12] |
DAI W B, YU B, DIAO X H, CAO H, CHEN L, CHEN Y, et al. Renal masses: evaluation with contrast-enhanced ultrasound, with a special focus on the pseudocapsule sign[J]. Ultrasound Med Biol, 2019, 45: 1924-1932. DOI:10.1016/j.ultrasmedbio.2019.03.020 |
| [13] |
OH T H, LEE Y H, SEO I Y. Diagnostic efficacy of contrast-enhanced ultrasound for small renal masses[J]. Korean J Urol, 2014, 55: 587-592. DOI:10.4111/kju.2014.55.9.587 |
| [14] |
CONG X, ZHANG J, XU X, ZHANG M, CHEN Y. Renal epithelioid angiomyolipoma: magnetic resonance imaging characteristics[J]. Abdom Radiol (NY), 2018, 43: 2756-2763. DOI:10.1007/s00261-018-1548-6 |
| [15] |
QIU T, LING W, LU Q, LU C, LUO Y. Contrast-enhanced ultrasound in diagnosis of epithelioid renal angiomyolipoma with renal vein and inferior vena cava extension[J]. J Med Ultrason (2001), 2016, 43: 427-430. DOI:10.1007/s10396-016-0705-1 |
| [16] |
RYAN M J, FRANCIS I R, COHAN R H, DAVENPORT M S, WEIZER A, HAFEZ K, et al. Imaging appearance of renal epithelioid angiomyolipomas[J]. J Comput Assist Tomogr, 2013, 37: 957-961. DOI:10.1097/RCT.0b013e3182a77674 |
| [17] |
LOPATER J, DANIEL L, AKIKI A, BOISSIER R, LECHEVALLIER E, COULANGE C. [Renal epithelioid angiomyolipoma][J]. Prog Urol, 2009, 19: 457-461. DOI:10.1016/j.purol.2009.01.010 |
| [18] |
忻晓洁, 张晟, 穆洁. 超声造影在鉴别小肾癌与脂肪缺乏型肾错构瘤中的应用价值[J]. 中华泌尿外科杂志, 2016, 37: 436-439. DOI:10.3760/cma.j.issn.1000-6702.2016.06.010 |
| [19] |
周青, 陈琴. 超声造影对肾脏实性肿瘤的定性诊断价值[J]. 中国医学影像学杂志, 2018, 26: 602-605, 611. DOI:10.3969/j.issn.1005-5185.2018.08.011 |
| [20] |
LU Q, WANG W, HUANG B, LI C, LI C. Minimal fat renal angiomyolipoma: the initial study with contrast-enhanced ultrasonography[J]. Ultrasound Med Biol, 2012, 38: 1896-1901. DOI:10.1016/j.ultrasmedbio.2012.07.014 |
| [21] |
PARK B K, KIM S H, CHOI H J. Characterization of renal cell carcinoma using agent detection imaging: comparison with gray-scale US[J]. Korean J Radiol, 2005, 6: 173-178. DOI:10.3348/kjr.2005.6.3.173 |
| [22] |
朱凯, 苗陈岿, 田野, 刘守勇, 张超, 王增军. 肾细胞癌假包膜的研究进展[J]. 中华泌尿外科杂志, 2019, 40: 398-400. DOI:10.3760/cma.j.issn.1000-6702.2019.05.021 |
| [23] |
SIDHU P S, CANTISANI V, DIETRICH C F, GILJA O H, SAFTOIU A, BARTELS E, et al. The EFSUMB guidelines and recommendations for the clinical practice of contrast-enhanced ultrasound (CEUS) in non-hepatic applications: update 2017(long version)[J/OL]. Ultraschall Med, 2018, 39: e2-e44. DOI: 10.1055/a-0586-1107.
|
 2021, Vol. 42
2021, Vol. 42


