2. 上海市东方医院学科办, 上海 200120;
3. 海军军医大学(第二军医大学)药学系无机化学教研室, 上海 200433
2. Department of Medical Affairs, Shanghai East Hospital, Tongji University, Shanghai 200120, China;
3. Department of Inorganic Chemistry, School of Pharmacy, Naval Medical University (Second Military Medical University), Shanghai 200433, China
烧伤和创伤导致的皮肤损伤发生率较高,已成为重要的公共卫生健康问题之一。全世界每年有1 100多万人因烧伤而寻求医疗救治,超过30万人死亡[1]。预防感染、促进创面愈合、缩短创面愈合时间是临床上治疗创面和减少瘢痕的基本原则。创面愈合是一个复杂且有序的生物学过程,包括炎症反应、细胞增殖和创面成熟与重建3个阶段。在创面愈合过程中,巨噬细胞作为主要炎症细胞移行至创面,启动并调控创面愈合;角质细胞、成纤维细胞和血管内皮细胞的迁移、增殖完成创面再上皮化、新生血管化和肉芽组织形成,并重建皮肤屏障功能[2]。提高这些细胞的定向迁移能力有助于促进创面愈合。
细胞迁移是细胞在接收到迁移信号或感受到某些物质的浓度变化后通过胞体形变进行的定向移动,肌动蛋白(actin)是其重要的物质基础和执行单元。肌动蛋白在细胞中存在2种功能状态,即可溶性单体肌动蛋白(G-actin)和丝状肌动蛋白(F-actin)。G-actin聚合成F-actin促使细胞伸出板状伪足和丝状伪足等突足结构,启动细胞运动[3]。细胞迁移的影响因素有细胞因子和物理因素等,电场等物理因素可以刺激细胞定向迁移[4]。电场促进细胞迁移的机制主要有:(1)电场使细胞极化,提高细胞的定向迁移能力;(2)电场使细胞膜表面一些生长因子受体的表达和分布发生改变,激活细胞内多种信号通路(如Rho、MAPK-ERK1/2、蛋白激酶A、PI3K等),从而促进细胞的定向迁移[5-6]。
驻极体是一类能够长期储存空间电荷和偶极电荷的功能电介质材料。研究表明驻极体产生的外静电场可以促进药物经皮吸收,抑制瘢痕形成,调控生物组织和生物大分子的驻极态,诱导细胞极化,促进中性粒细胞、巨噬细胞和淋巴细胞等增殖和分化,并能促进创面愈合[7-11]。虽然有文献报道驻极体能促进烧伤创面愈合,但仅限于动物实验和临床观察性研究,相关分子生物学机制研究还不够深入、完整。本研究制备了负极性聚丙烯驻极体,通过划痕实验和Transwell迁移实验研究驻极体静电场诱导小鼠巨噬细胞(RAW264.7细胞)的迁移规律及作用机制,并通过荧光标记F-actin观察驻极体静电场对巨噬细胞形态和结构的影响,以期阐明驻极体静电场诱导细胞迁移及促进创面愈合的机制,为临床创面治疗提供新的实验和理论依据。
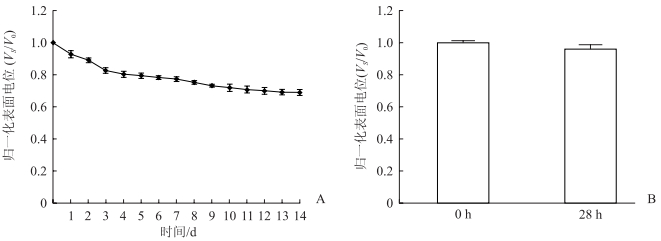
1 材料和方法 1.1 驻极体制备及电荷储存稳定性评价将膜厚25 μm、面积5 cm×6 cm的双裸面聚丙烯薄膜(日本东丽株式会社)平铺于铝块上,常温下利用低温等离子体放电法(栅控恒压电晕放电)制备驻极体。针尖电压为-10 kV,栅压为-2 000 V,驻极时间为10 min,制备得-2 000 V驻极体。利用常规等温表面电位衰减测量方法研究驻极体在储存和实验条件下的电荷储存稳定性。采用表面电位计(ESR102A型,北京华晶汇科技有限公司)测量-2 000 V驻极体充电后的表面电位,以及在常温、常湿条件下存放14 d和在细胞培养箱(温度为37 ℃、相对湿度为95%)放置28 h后的表面电位;并计算其归一化表面电位,即样品不同时间测定的表面电位(VS)与其初始表面电位(V0)的比值。
1.2 细胞划痕实验小鼠巨噬细胞系RAW264.7细胞(购自中国科学院上海生命科学研究院细胞资源中心)按每孔1×106个细胞的密度接种于6孔板,待细胞融合度达90%以上时使用10 μL枪头进行划痕。驻极体组将紫外线消毒后的-2 000 V驻极体贴于6孔板上部,对照组贴未驻电荷的空白聚丙烯薄膜。于划痕后0、4、8、28 h,使用IX71型光学显微镜(日本Olympus公司)在200倍视野下观察细胞增殖情况并拍照。
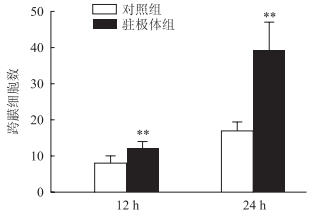
1.3 Transwell细胞迁移实验在Transwell下室加入600 μL含10% FBS(美国BD公司)的DMEM培养基(美国Gibco公司),上室滴加100 μL密度为5×105/mL的RAW264.7细胞悬液。将上室置于下室之中,在驻极体组上室顶部贴紫外线消毒后的-2 000 V驻极体,对照组贴未驻电荷的空白聚丙烯薄膜,然后在37 ℃温箱内培养细胞。培养12、24 h后取出上室,用棉签将残留在上室内表面上的细胞拭去。上室经PBS洗涤后,用4%多聚甲醛溶液固定,然后用含0.1%龙胆紫的20%乙醇溶液染色20 min,清水洗3次。通过光学显微镜在100倍视野下观察并计算跨膜细胞数,随机取5个视野计算平均值。
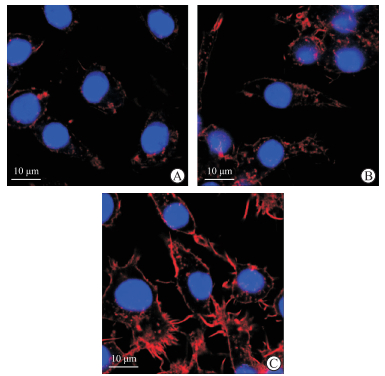
1.4 细胞形态及突足的观察实验用荧光标记F-actin观察巨噬细胞的形态及突足变化。配制100 nmol/L Actin-stain™ 555鬼笔环肽工作液。取1×105个RAW264.7细胞接种于玻底培养皿,待细胞融合度达90%以上时,在驻极体组玻底培养皿上方贴-2 000 V驻极体,对照组贴未驻电荷的空白聚丙烯薄膜,继续培养12、24 h。弃培养基,PBS洗1次,用4%多聚甲醛溶液固定10 min;PBS洗1次,0.4% Triton X-100透化细胞5 min;PBS洗1次,加入鬼笔环肽工作液,室温避光孵育30 min;PBS洗3次,DAPI染核5 min;PBS洗3次。用TCS SP5型共聚焦显微镜(德国Leica公司)观察细胞的板状伪足、丝状伪足、褶皱及细胞体积的变化。
1.5 统计学处理应用SPSS 19.0软件进行数据分析。符合正态分布的计量资料以x±s表示,两组间比较采用独立样本t检验。检验水准(α)为0.05。
2 结果 2.1 驻极体的电荷储存稳定性图 1A为-2 000 V驻极体在常温、常湿环境下放置14 d的归一化表面电位衰减图。如图所示,-2 000 V驻极体在常温、常湿条件下放置14 d其表面电位逐渐衰减,14 d时表面电位基本稳定在其初始值的70%。图 1B为驻极体置于细胞培养箱(温度为37 ℃、相对湿度为95%)28 h后的归一化表面电位,可见28 h后驻极体的归一化表面电位与0 h相比差异无统计学意义(P>0.05)。这一结果说明制备的驻极体可以在整个实验过程中稳定供给静电场和微电流,持续作用于细胞。
|
图 1 -2 000 V驻极体的归一化表面电位随时间的变化 A:在常温、常湿条件下存放14 d的归一化表面电位;B:在细胞培养箱放置28 h后的归一化表面电位.n=6,x±s.VS:不同时间点的表面电位;V0:初始表面电位. |
2.2 驻极体静电场促进RAW264.7细胞迁移
如图 2所示,与对照组比较,驻极体静电场作用28 h时RAW264.7细胞向划痕区迁移、增殖能力增强,划痕面积减小。

|
图 2 细胞划痕实验检测驻极体静电场作用不同时间时巨噬细胞的迁移能力(200×) |
2.3 驻极体静电场促进RAW264.7细胞跨膜迁移
如图 3所示,驻极体静电场作用12和24 h时,RAW264.7细胞的跨膜迁移数目均较对照组增多(P均<0.01)。
|
图 3 Transwell实验检测驻极体静电场作用不同时间对巨噬细胞跨膜迁移的作用 **P<0.01与同时间点对照组比较.n=6,x±s. |
2.4 驻极体静电场促进RAW264.7细胞延展及突足形成
如图 4所示,对照组RAW264.7细胞多呈圆形或椭圆形,而驻极体静电场作用12 h时RAW264.7细胞体积变大并发生延展,作用24 h时RAW264.7细胞不仅发生延展、褶皱增多,还生出板状伪足、丝状伪足等突足结构。这一结果说明在驻极体静电场持续作用下,巨噬细胞呈现出迁移过程中的典型形态特征。
|
图 4 共聚焦显微镜观察驻极体静电场对巨噬细胞延展及突足形成的促进作用 A:对照组;B:驻极体静电场作用12 h;C:驻极体静电场作用24 h. |
3 讨论
慢性难愈性创面尽早愈合是近年来烧伤、创伤、康复等领域亟待解决的医学难题之一。随着医学技术的发展,新产品和新疗法不断被开发出来,目前促进创面愈合的方法主要有抗感染治疗、细胞因子及生长因子、外用制剂和物理疗法[12-14]等,还有一些新兴疗法如干细胞类产品、组织工程皮肤等[15]。电刺激疗法作为物理疗法的一种,在促进创面愈合方面表现出巨大的应用前景。Barker等[16]曾证实伤口电流的存在和维持在创面愈合中有重要作用。
本团队前期研究结果显示驻极体静电场可以促进大鼠创面愈合[17],虽然相关的分子生物学机制并不明确,但据此设想驻极体产生的静电场和微电流或许能通过促进创面中重要细胞的迁移促进创面愈合。本研究探讨了驻极体静电场对在创面愈合中起关键作用的巨噬细胞迁移能力的影响,以明确驻极体静电场能否通过促进巨噬细胞迁移促进创面愈合。划痕实验结果显示,相比对照组,驻极体静电场作用于巨噬细胞28 h后划痕面积减小,细胞向划痕区迁移、增殖的能力增强。由于该变化还包含细胞增殖的作用结果,并不能证明划痕的“愈合”是驻极体静电场促进细胞迁移的独立作用导致的。为此,本研究通过Transwell跨膜迁移实验进一步验证,结果同样显示驻极体静电场作用12、24 h均促进了细胞跨膜迁移,而且随着作用时间的延长驻极体静电场对细胞的促迁移作用更加显著,24 h时跨膜细胞数约为12 h时的3倍。该结果与细胞划痕实验结果一致,说明驻极体可有效促进创面愈合中巨噬细胞的迁移,从而为创面愈合提供了较好的先决条件。
驻极体静电场促细胞迁移的作用也可由细胞形态的变化反映。本研究采用荧光标记F-actin观察驻极体静电场作用12、24 h后巨噬细胞的形态改变,结果显示,驻极体静电场作用12 h时巨噬细胞体积变大且发生延展,当作用24 h时出现了细胞迁移的典型特征形态,即细胞发生延展、褶皱增多且生出板状伪足、丝状伪足等突足结构。该结果从细胞形态变化方面进一步验证了驻极体静电场可以促进细胞形态改变,生成突足结构,启动细胞运动,促进细胞迁移。虽然从细胞形态变化可以反映驻极体静电场能促进巨噬细胞F-actin聚合而生成突足结构,但是其相关分子机制有待进一步研究。
综上所述,细胞划痕实验、Transwell跨膜迁移实验证实了-2 000 V驻极体静电场可以促进巨噬细胞迁移;荧光标记F-actin观察细胞形态结果表明其通过促进巨噬细胞体积变大、延展、褶皱增多及细胞内F-actin聚合而生成板状伪足和丝状伪足等突足结构,增强了巨噬细胞的迁移能力。该研究结果为创面愈合的治疗提供了新的思路。
| [1] |
STANOJCIC M, VINAIK R, JESCHKE M G. Status and challenges of predicting and diagnosing sepsis in burn patients[J]. Surg Infect (Larchmt), 2018, 19: 168-175. DOI:10.1089/sur.2017.288 |
| [2] |
WANG P H, HUANG B S, HORNG H C, YEH C C, CHEN Y J. Wound healing[J]. J Chin Med Assoc, 2018, 81: 94-101. DOI:10.1016/j.jcma.2017.11.002 |
| [3] |
LE CLAINCHE C, CARLIER M F. Regulation of actin assembly associated with protrusion and adhesion in cell migration[J]. Physiol Rev, 2008, 88: 489-513. DOI:10.1152/physrev.00021.2007 |
| [4] |
HOARE J I, RAJNICEK A M, MCCAIG C D, BARKER R N, WILSON H M. Electric fields are novel determinants of human macrophage functions[J]. J Leukoc Biol, 2016, 99: 1141-1151. DOI:10.1189/jlb.3A0815-390R |
| [5] |
RASSOKHIN M A, PAKHOMOV A G. Cellular regulation of extension and retraction of pseudopod-like blebs produced by nanosecond pulsed electric field (nsPEF)[J]. Cell Biochem Biophys, 2014, 69: 555-566. DOI:10.1007/s12013-014-9831-9 |
| [6] |
包家立, 王鑫磊, 黄本康, 冀倩倩, 李宇波, 朱朝阳. 双源推挽功率技术和电磁隔离技术在经皮给药中的应用[J]. 高电压技术, 2013, 39: 103-108. |
| [7] |
安晓强, 郭鑫, 苑旺, 黄平, 江键, 崔黎丽. 正极性驻极体5-氟尿嘧啶贴剂对瘢痕组织中胶原合成的影响[J]. 高电压技术, 2018, 44: 633-639. |
| [8] |
徐立丽, 黄平, 苑旺, 梁合鹃, 崔黎丽, 江键. 正极性聚丙烯驻极体外静电场对5-氟尿嘧啶贴剂中药物释放的影响[J]. 高电压技术, 2017, 43: 1925-1929. |
| [9] |
YUAN W, XU L, HUANG P, AN X, CUI L, JIANG J. Inhibition effects of a negative electret 5-FU patch on the growth of a hypertrophic scar[J]. Plasma Sci Technol, 2018, 20(054011(6pp)). DOI:10.1088/2058-6272/aaa88b |
| [10] |
谢卫, 杨敏杰, 虞俊杰, 顾在秋, 吕国忠. 驻极体薄膜在烧伤创面的临床应用[J]. 江苏临床医学杂志, 2001, 5: 292-293, 304. |
| [11] |
江键, 宋诚荣, 王小平, 崔黎丽, 宋茂海, 方影, 等. 驻极体对成纤维细胞生长和表面电荷的影响[J]. 第二军医大学学报, 2001, 22: 405-408. JIANG J, SONG C R, WANG X P, CUI L L, SONG M H, FANG Y, et al. Effect of electret on growth and surface charge in fibroblast cells[J]. Acad J Sec Mil Med Univ, 2001, 22: 405-408. DOI:10.3321/j.issn:0258-879X.2001.05.002 |
| [12] |
HUNCKLER J, DE MEL A. A current affair: electrotherapy in wound healing[J]. J Multidiscip Healthc, 2017, 10: 179-194. DOI:10.2147/JMDH.S127207 |
| [13] |
PARK J W, HWANG S R, YOON I S. Advanced growth factor delivery systems in wound management and skin regeneration[J/OL]. Molecules, 2017, 22: 1259. DOI: 10.3390/molecules22081259.
|
| [14] |
VUJANOVIC S, VUJANOVIC J. Bioresources in the pharmacotherapy and healing of burns: a mini-review[J]. Burns, 2013, 39: 1031-1038. DOI:10.1016/j.burns.2013.03.016 |
| [15] |
XIE S Y, PENG L H, SHAN Y H, NIU J, XIONG J, GAO J Q. Adult stem cells seeded on electrospinning silk fibroin nanofiberous scaffold enhance wound repair and regeneration[J]. J Nanosci Nanotechnol, 2016, 16: 5498-5505. DOI:10.1166/jnn.2016.11730 |
| [16] |
BARKER A T, JAFFE L F, VANABLE J W. The glabrous epidermis of cavies contains a powerful battery[J]. Am J Physiol, 1982, 242: R358-R366. |
| [17] |
黄平, 徐立丽, 梁媛媛, 郭鑫, 梁合鹃, 崔黎丽, 等. 负极性驻极体与5-氟尿嘧啶对大鼠创面愈合的影响[J]. 解剖学杂志, 2017, 40: 176-180. |
 2021, Vol. 42
2021, Vol. 42


