下腰痛是脊柱外科常见的疾病。据统计,在2006年全球约84%的人在一生中会经历下腰痛,且随着社会老龄化下腰痛的发病率逐渐上升,给患者家庭和社会造成了巨大的负担[1-2]。引起患者下腰痛的原因很多,其中椎间盘退变是导致下腰痛的最主要原因[2]。与机体其他器官相似,椎间盘也随着年龄增长逐渐发生退变。文献报道椎间盘退变最早发生在11岁[3]。同时,椎间盘退变涉及其内在结构的变化,这些病变将导致椎间盘吸收和传递脊柱轴向力障碍,进而导致脊柱退行性疾病,包括椎管狭窄、退行性脊柱侧凸和椎间盘突出症等[4]。该病起病隐匿,很多患者一旦出现症状保守治疗往往无效,外科治疗成为解除患者痛苦的唯一选择。但是外科治疗也伴随着许多并发症,对椎间盘退变早期预防、诊断和及时干预的研究是脊柱外科临床工作的重点。本文从神经、免疫和内分泌系统3个角度对目前椎间盘退变的机制研究进展进行综述。
1 椎间盘的结构、功能和退变椎间盘位于相邻2个椎体之间,是机体最大的无血管组织,其由髓核、终板软骨和纤维环3个部分组成。髓核组织呈胶冻状,主要由髓核细胞和周围细胞外基质组成,细胞外基质中混杂着不规则的Ⅱ型和Ⅰ型胶原纤维(两者比例为27:1)[5],其他成分还包括Ⅵ、Ⅶ、Ⅺ型胶原纤维及富含亮氨酸的蛋白多糖、纤维调节蛋白和角化蛋白等[6]。这些带负电荷的成分使髓核具有高亲水性和保水特性,为其传递脊柱负荷提供了生物学基础。环绕髓核组织的是纤维环,其是主要由高度规则排列的胶原纤维形成的同心圆结构,上下端的纤维紧密连接在终板软骨上[7]。纤维环中超过2/3的成分是Ⅰ型胶原纤维,越接近髓核Ⅰ型胶原含量越低、Ⅱ型胶原越多[7]。终板软骨是椎间盘的上下边界,发挥着限制髓核突出及营养髓核的作用[8]。研究发现,5岁之前人体有微血管通过终板软骨为椎间盘内部结构提供营养,5岁之后椎间盘内部的营养供应逐渐以纤维环和终板软骨的液体渗透和物质弥散为主[9],正常成年人椎间盘组织的神经、血管分布及营养供应如图 1所示。
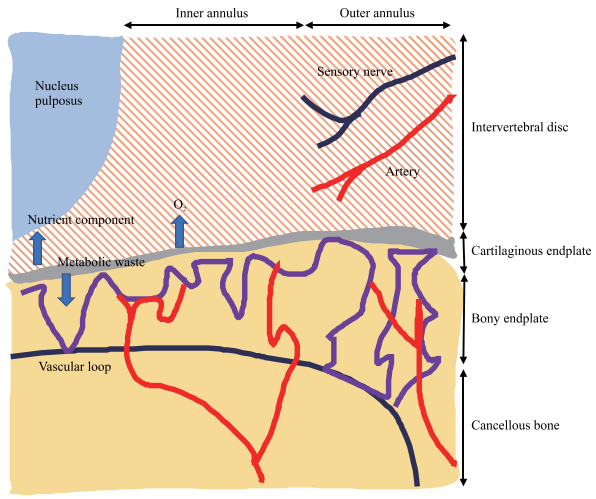
|
图 1 成年人椎间盘神经、血管分布及营养供应示意图 Fig 1 Anatomy of blood and nerve distribution and nutrient supply of intervertebral disc in adults |
在年轻个体中,髓核和纤维环之间存在明显的边界。然而,随着椎间盘发生退变,髓核组织中Ⅱ型胶原逐渐被Ⅰ型胶原替代,蛋白多糖的合成能力也逐渐降低,导致髓核和纤维环之间的界限逐渐消失,髓核组织的保水能力也逐渐降低。椎间盘退变过程中,细胞外基质分解代谢相关蛋白酶的表达明显增加,包括基质金属蛋白酶(matrix metalloproteinase,MMP)、蛋白聚糖酶家族(a disintegrin and metalloproteinase with thrombospondin motifs family,ADAMTS),从而促进髓核组织蛋白多糖和Ⅱ型胶原降解[5]。蛋白多糖和Ⅱ型胶原的比例失调是髓核细胞功能受损的主要标志[9]。同时终板软骨的钙化和渗透能力也会逐渐下降,影响髓核组织损伤修复,进一步加重了髓核损伤。髓核结构改变会使椎间盘高度降低,导致脊柱生物力学紊乱而出现一系列脊柱退行性疾病。
然而椎间盘退变不仅仅是年龄相关的退变过程,也是一个涉及神经、免疫和内分泌系统变化的复杂的病理生理过程。因此深入探究和阐明这些系统在椎间盘退变过程中的作用机制,对于未来椎间盘退变的早期干预具有重要临床意义。
2 神经系统与椎间盘退变在正常生理状态下,仅仅在椎间盘纤维环结构外部有来自脊髓背根神经节的感觉神经支配,而退变椎间盘内部常常伴有神经长入,尤其在退变严重的区域神经分布更密集。Freemont等[10]研究发现盘源性疼痛患者的椎间盘组织内神经生长因子(nerve growth factor,NGF)高表达,且伴随神经长入的微血管也高表达NGF,这些血管主要通过终板侵入椎间盘内部,同时血管附近的神经表达NGF的高亲和力受体A;而对照组尽管在纤维环内部发现了血管新生,但是未发现NGF表达的血管。这一结果提示椎间盘神经的重塑可能需要邻近椎体血管的促进作用。
研究发现来自脊髓背根神经节(dorsal root ganglion,DRG)的神经纤维参与椎间盘退变,正常情况下这些神经纤维分布在纤维环外侧,在椎间盘退变过程中逐渐长入椎间盘内部。Binch等[11]报道IL-1和TNF-α是促进神经内分泌因子分泌的主要炎症因子,也是导致椎间盘退变的主要炎症因子。Ashton等[12]曾将退变腰椎间盘纤维环组织中的感觉神经分为P物质能、蛋白基因产物9.5能、血管活性肠肽能和降钙素基因相关肽(calcitonin gene-related peptide,CGRP)能感觉神经。而TNF-α作为椎间盘主要的促炎因子,能促进椎间盘外周神经末端P物质和CGRP等炎症性神经肽的释放[11]。
P物质及其受体神经激肽1、2、3受体广泛表达于人类髓核和纤维环细胞,且在椎间盘退变和盘源性疼痛患者的椎间盘组织中表达明显增加[13]。Kepler等[14]曾报道P物质能够通过激活ERK1/2信号通路促进髓核和纤维环细胞中炎症因子的表达,尤其是IL-6,而在拮抗神经激肽1受体后细胞中IL-6的表达水平明显降低,这一结果提示P物质可能主要通过神经激肽1受体促进椎间盘的炎症反应。然而,P物质在椎间盘退变的最初阶段并不是以促进炎症反应为主,其在人类退变椎间盘的纤维环小血管内皮细胞上被发现,与神经激肽1受体结合能够通过介导血管内皮细胞的增殖和迁移参与新生血管形成[15]。考虑到在椎间盘退变早期损伤阶段椎间盘存在自我修复能力,P物质这一效应可能参与椎间盘损伤的早期修复。
与P物质一样,CGRP也主要表达于感觉神经纤维,并通过脊髓DRG轴突与椎间盘联系,从而参与椎间盘的炎症和疼痛反应[16]。研究发现支配损伤椎间盘的脊髓DRG神经元内部的CGRP表达明显增加,且与损伤椎间盘内部TNF-α和IL-6的表达增加一致,提示CGRP表达可能与椎间盘炎症相关;此外,在针刺大鼠损伤椎间盘的同时注入TNF-α抑制剂依那西普或NGF抗体后,DRG中CGRP的表达水平明显降低,进一步证明了CGRP和椎间盘炎症反应的相关性[17]。
研究表明自主神经系统也参与椎间盘退变过程,可能与交感神经分泌的神经因子如去甲肾上腺素、神经肽Y等有关[18-19],但相关机制目前仍缺乏较深入的研究。笔者前期研究发现神经肽Y具有缓解IL-1β介导髓核细胞凋亡和细胞外基质降解的作用[20]。然而,CGRP、血管活性肠肽等神经肽与髓核细胞的直接生物学关系目前仍缺乏研究。
在临床研究方面,长征医院史建刚团队基于临床经验提出神经轴向高张力导致椎间盘退变的“弓弦病理论”。该理论认为由于生长发育或人体功能退变等因素导致脊柱高度和神经根长度不匹配,从而引起神经根轴向高张力,但人体由于自我保护会启动椎间盘退变过程,通过牺牲椎间盘高度缓解神经根高张力,达到自我减压的目的[21]。未来需要进一步的基础研究证明神经根轴向高张力与椎间盘退变的因果关系及其内在调控机制,这将为脊柱外科椎间盘疾病治疗理念的革新提供新的思路。
3 免疫系统与椎间盘退变免疫细胞作为免疫系统主要的功能执行者,广泛参与人体骨骼退行性疾病的发生和发展。研究发现,退变的髓核细胞和纤维环细胞会产生大量的促炎因子,包括IL-1α、IL-β、TNF-α和C-C基序趋化因子配体(C-C motif chemokine ligand,CCL)等[17]。这些炎症趋化因子会进一步招募免疫细胞浸润到椎间盘内部,加重炎症反应。
巨噬细胞作为免疫应答的重要成分,通过表型转换广泛参与人体的促炎、抗炎过程和组织重塑。在对急性损伤的反应中,巨噬细胞会迅速从促炎表型(M1型)向促进炎症消散和组织愈合表型(M2型)转换[22]。Nakazawa等[23]首次在人类退变椎间盘中发现不同亚型巨噬细胞(M1、M2a和M2c型),而在正常的椎间盘中未发现巨噬细胞。该实验也发现M1型和组织重塑型(M2c型)巨噬细胞的聚集程度与椎间盘退变程度呈正相关,提示巨噬细胞可能同时参与椎间盘损伤的早期炎症反应和后期损伤修复。Yang等[24]通过细胞共培养发现,椎间盘退变状态下髓核细胞和纤维环细胞的培养上清能够促进巨噬细胞中促炎相关基因(TNF-α、IL-1β、IL-6)、分解代谢因子基因(MMP3、MMP13、ADAMTS-4、ADAMTS-5)和趋化因子基因(CCL-3、CCL-4)表达。同时,M1型巨噬细胞培养上清也能促进髓核细胞和纤维环细胞中促炎相关基因、分解代谢因子基因和趋化因子基因表达。以上结果提示在椎间盘退变过程中,巨噬细胞和髓核细胞可能存在相互作用关系,共同形成局部炎症微环境,从而维持炎症反应持续进行,加速了椎间盘退变。
肥大细胞也参与椎间盘退变过程,研究发现在盘源性疼痛椎间盘组织的髓核细胞和终板软骨细胞中均发现肥大细胞聚集,而在纤维环中未发现[25]。通过进一步实验观察到,肥大细胞培养体系可增加髓核细胞和终板软骨细胞促炎因子和促血管新生因子的分泌,而退变的椎间盘细胞对于肥大细胞也有招募和激活作用,形成正反馈,逐步加重椎间盘退变。
辅助性T细胞(T-helper cell,Th)是T细胞的一个亚型,主要包括Th1和Th2,两者平衡对于维持局部内环境稳态极为重要,一旦失衡,机体炎症因子的分泌将会紊乱,进而引发疾病。Yao等[26]研究报道在椎间盘退变模型大鼠的髓核组织中Th1数量明显增加,造模后14 d达到高峰,28 d下降。另有研究发现Th2分泌的IL-4能够通过与椎间盘细胞的IL-4受体α结合缓解椎间盘的炎症反应,尤其在突出椎间盘中该受体的表达水平更高,提示Th2对于椎间盘退变有保护作用[27]。也有研究报道Th7能通过分泌IL-17促进炎症因子产生、招募巨噬细胞和嗜酸性粒细胞,参与椎间盘退变炎症反应[28]。B细胞缺陷患者终板软骨的炎症反应也明显高于正常对照[29]。
基于目前免疫系统和椎间盘退变的研究进展,推测在正常情况下,椎间盘是一个免疫屏蔽的器官,以纤维环和终板软骨作为生物学屏障抵挡免疫细胞入侵。随着人体的衰老,反复的微损伤将导致终板软骨出现裂隙性病变,使椎间盘内部的髓核与骨髓腔相通。同时,退变的椎间盘细胞通过分泌炎症细胞趋化因子招募大量的免疫细胞进入椎间盘内部,与髓核细胞形成正反馈,最终促使炎症反应持续进行,加速了年龄相关的椎间盘退变(图 2)。

|
图 2 免疫细胞参与椎间盘退变的可能机制 Fig 2 Possible mechanisms of immune cells involvement in intervertebral disc degeneration The red arrow indicates a degenerative intervertebral disc in the MRI image. NP: Nucleus pulposus; TNF: Tumor necrosis factor; IL: Interleukin; MMP: Matrix metalloproteinase; ADAMTS: A disintegrin and metalloproteinase with thrombospondin motifs family; MRI: Magnetic resonance imaging. |
4 内分泌系统与椎间盘退变
内分泌系统疾病不仅仅局限于内分泌系统本身的器官和组织,对于包括椎间盘(图 3)在内的全身其他器官组织也有重要影响。
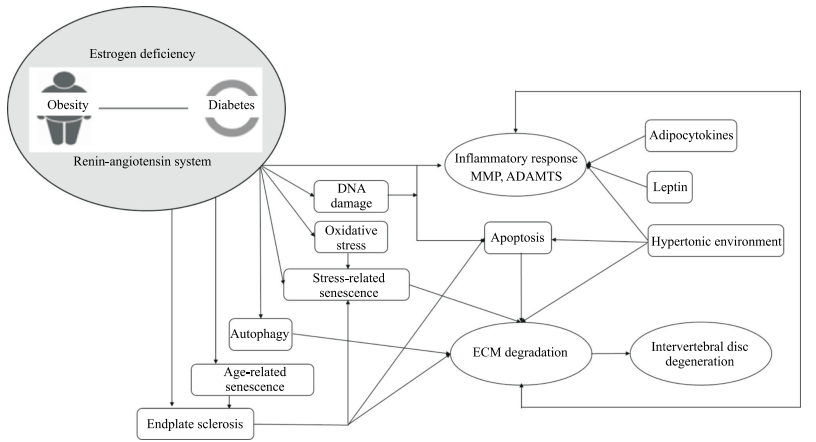
|
图 3 内分泌系统参与椎间盘退变的可能途径 Fig 3 Possible pathways of endocrine system involvement in intervertebral disc degeneration MMP: Matrix metalloproteinase; ADAMTS: A disintegrin and metalloproteinase with thrombospondin motifs family; ECM: Extracellular matrix. |
糖尿病是内分泌系统最常见的疾病之一。Agius等[30]研究发现与非糖尿病患者相比,糖尿病患者表现出更多的椎间隙高度丢失,推测高血糖可能通过促进椎间盘组织中蛋白质的糖化修饰而使椎间盘出现代谢和营养功能障碍,从而发生退变。并且患者的糖尿病病程越长、血糖控制越差,椎间盘退变越严重,尤其在上腰椎水平[31]。我们推测糖尿病促进椎间盘退变主要有以下机制:(1)细胞暴露于高糖环境下其内部糖稳态调节失衡,使糖代谢酶的活性发生障碍,影响能量代谢。(2)高糖导致椎间盘终板软骨硬化、内部微血管狭窄,降低了髓核细胞的营养供应和与外界进行物质交换的效率。(3)高糖环境可以介导和加速细胞衰老,损害线粒体功能,导致氧化应激产物累积,最终导致椎间盘细胞凋亡或死亡。(4)其他机制,如高糖增加髓核细胞自噬、促进炎症反应、糖基化终末产物聚集及其导致的渗透应力、低氧和酸性环境等都可能促进椎间盘退变。
研究发现肥胖也是椎间盘退变的危险因素,脂肪组织尤其白色脂肪组织的增加与TNF-α、IL-1β和IL-6过表达及巨噬细胞表型转换有关,这些都是促进椎间盘退变的因素[32]。此外,肥胖患者血清中瘦素含量明显增加,而椎间盘细胞表达瘦素受体,两者结合使椎间盘内蛋白分解酶合成增加,加速了椎间盘退变[32]。
绝经后女性常伴随雌激素水平降低。研究表明中、青年男性椎间盘退变的发生率明显高于同龄女性,而老年女性尤其是绝经期后的女性的椎间盘退变发生率明显高于男性[1]。一项采用人体椎间盘组织进行的研究发现髓核细胞上存在雌激素α和β受体,且椎间盘退变越严重这2种受体的表达水平越低[33]。这一结果提示雌激素可能通过其α和β受体对椎间盘发挥保护作用,其缺乏或功能障碍将导致椎间盘退变加速。雌激素保护椎间盘退变的机制主要包括抑制炎症因子(如IL-1、TNF-α)的产生和释放、抑制分解代谢相关酶(如MMP、ADAMTS)的活性及降低组织氧化损伤等[1]。
与椎间盘退变有关的内分泌激素还包括肾素-血管紧张素系统[34]和维生素D[35](通过提高椎间盘内部胰岛素样生长因子1和TNF-β的含量抑制椎间盘退变发生)等。这些都证实了内分泌系统与椎间盘退变的密切关系,但未来仍需进一步深入探究内分泌激素对椎间盘退变的调节机制,这将为未来椎间盘退变的预防和治疗提供新的思路。
5 小结椎间盘作为人体脊柱系统的重要组成部分,连接相邻椎体,起着传递、吸收、分散脊柱轴向应力及参与脊柱的旋转等运动的作用。椎间盘退变则对人们的生活、工作和精神造成巨大压力。人体作为完整的生命体,神经、免疫和内分泌等系统之间相互独立又相互协调,共同调节和维持着椎间盘内部的微环境,任一系统的异常都将对椎间盘微环境造成不利影响。阐明椎间盘退变作为系统疾病之一的机制,将为椎间盘退变的预防和治疗提供新的思路。
| [1] |
YANG S, ZHANG F, MA J, DING W. Intervertebral disc ageing and degeneration: The antiapoptotic effect of oestrogen[J/OL]. Ageing Res Rev, 2020, 57: 100978. DOI: 10.1016/j.arr.2019.100978.
|
| [2] |
SHELERUD R A. Epidemiology of occupational low back pain[J]. Clin Occup Environ Med, 2006, 5: 501-528. |
| [3] |
HUGHES S P, FREEMONT A J, HUKINS D W, MCGREGOR A H, ROBERTS S. The pathogenesis of degeneration of the intervertebral disc and emerging therapies in the management of back pain[J]. J Bone Joint Surg Br, 2012, 94: 1298-1304. |
| [4] |
HODGKINSON T, SHEN B, DIWAN A, HOYLAND J A, RICHARDSON S M. Therapeutic potential of growth differentiation factors in the treatment of degenerative disc diseases[J/OL]. JOR Spine, 2019, 2: e1045. DOI: 10.1002/jsp2.1045.
|
| [5] |
CHEN F, LIU H, LI Z M, PEI Y X, WANG H, ZHANG J, et al. Paraoxonase 1 was negatively associated with intervertebral disc degeneration[J/OL]. Spine, 2019, 44: E1053-E1062. DOI: 10.1097/BRS.0000000000003059.
|
| [6] |
LYU F J, CUI H, PAN H, MC CHEUNG K, CAO X, IATRIDIS J C, et al. Painful intervertebral disc degeneration and inflammation: from laboratory evidence to clinical interventions[J/OL]. Bone Res, 2021, 9: 7. DOI: 10.1038/s41413-020-00125-x.
|
| [7] |
ZELDIN L, MOSLEY G E, LAUDIER D, GALLATE Z S, GANSAU J, HOY R C, et al. Spatial mapping of collagen content and structure in human intervertebral disk degeneration[J/OL]. JOR Spine, 2020, 3: e1129. DOI: 10.1002/jsp2.1129.
|
| [8] |
KAMALI A, ZIADLOU R, LANG G, PFANNKUCHE J, CUI S, LI Z, et al. Small molecule-based treatment approaches for intervertebral disc degeneration: current options and future directions[J]. Theranostics, 2021, 11: 27-47. DOI:10.7150/thno.48987 |
| [9] |
DOWDELL J, ERWIN M, CHOMA T, VACCARO A, IATRIDIS J, CHO S K. Intervertebral disk degeneration and repair[J]. Neurosurgery, 2017, 80: S46-S54. DOI:10.1093/neuros/nyw078 |
| [10] |
FREEMONT A J, PEACOCK T E, GOUPILLE P, HOYLAND J A, O'BRIEN J, JAYSON M I. Nerve ingrowth into diseased intervertebral disc in chronic back pain[J]. Lancet, 1997, 350: 178-181. DOI:10.1016/S0140-6736(97)02135-1 |
| [11] |
BINCH A L, COLE A A, BREAKWELL L M, MICHAEL A L, CHIVERTON N, CROSS A K, et al. Expression and regulation of neurotrophic and angiogenic factors during human intervertebral disc degeneration[J/OL]. Arthritis Res Ther, 2014, 16: 416. DOI: 10.1186/s13075-014-0416-1.
|
| [12] |
ASHTON I K, ROBERTS S, JAFFRAY D C, POLAK J M, EISENSTEIN S M. Neuropeptides in the human intervertebral disc[J]. J Orthop Res, 1994, 12: 186-192. DOI:10.1002/jor.1100120206 |
| [13] |
DING M, HART R P, JONAKAIT G M. Tumor necrosis factor-alpha induces substance P in sympathetic ganglia through sequential induction of interleukin-1 and leukemia inhibitory factor[J]. J Neurobiol, 1995, 28: 445-454. DOI:10.1002/neu.480280405 |
| [14] |
KEPLER C K, MARKOVA D Z, HILIBRAND A S, VACCARO A R, RISBUD M V, ALBERT T J, et al. Substance P stimulates production of inflammatory cytokines in human disc cells[J/OL]. Spine, 2013, 38: E1291-E1299. DOI: 10.1097/BRS.0b013e3182a42bc2.
|
| [15] |
WU B, YANG L, PENG B. Ingrowth of nociceptive receptors into diseased cervical intervertebral disc is associated with discogenic neck pain[J]. Pain Med, 2019, 20: 1072-1077. DOI:10.1093/pm/pnz013 |
| [16] |
KEPLER C K, MARKOVA D Z, KOERNER J D, MENDELIS J, CHEN C M, VACCARO A R, et al. Substance P receptor antagonist suppresses inflammatory cytokine expression in human disc cells[J]. Spine (Phila Pa 1976), 2015, 40: 1261-1269. DOI:10.1097/BRS.0000000000000954 |
| [17] |
BINCH A L A, FITZGERALD J C, GROWNEY E A, BARRY F. Cell-based strategies for IVD repair: clinical progress and translational obstacles[J]. Nat Rev Rheumatol, 2021, 17: 158-175. DOI:10.1038/s41584-020-00568-w |
| [18] |
LEE S, MILLECAMPS M, FOSTER D Z, STONE L S. Long-term histological analysis of innervation and macrophage infiltration in a mouse model of intervertebral disc injury-induced low back pain[J]. J Orthop Res, 2020, 38: 1238-1247. DOI:10.1002/jor.24560 |
| [19] |
KUPKA J, KOHLER A, EL BAGDADI K, BOSTELMANN R, BRENNEIS M, FLEEGE C, et al. Adrenoceptor expression during intervertebral disc degeneration[J/OL]. Int J Mol Sci, 2020, 21: 2085. DOI: 10.3390/ijms21062085.
|
| [20] |
SUN K, ZHU J, SUN J, SUN X, HUAN L, ZHANG B, et al. Neuropeptide Y prevents nucleus pulposus cells from cell apoptosis and IL-1β-induced extracellular matrix degradation[J]. Cell Cycle, 2021, 1-18. |
| [21] |
SHI J G, XU X M, SUN J C, WANG Y, KONG Q J, SHI G D. Theory of bowstring disease: diagnosis and treatment bowstring disease[J]. Orthop Surg, 2019, 11: 3-9. DOI:10.1111/os.12417 |
| [22] |
GUILLIAMS M, SVEDBERG F R. Does tissue imprinting restrict macrophage plasticity?[J]. Nat Immunol, 2021, 22: 118-127. DOI:10.1038/s41590-020-00849-2 |
| [23] |
NAKAZAWA K R, WALTER B A, LAUDIER D M, KRISHNAMOORTHY D, MOSLEY G E, SPILLER K L, et al. Accumulation and localization of macrophage phenotypes with human intervertebral disc degeneration[J]. Spine J, 2018, 18: 343-356. DOI:10.1016/j.spinee.2017.09.018 |
| [24] |
YANG H, LIU B, LIU Y J, HE D, XING Y G, AN Y, et al. Secreted factors from intervertebral disc cells and infiltrating macrophages promote degenerated intervertebral disc catabolism[J/OL]. Spine, 2019, 44: E520-E529. DOI: 10.1097/BRS.0000000000002953.
|
| [25] |
HWANG M H, SON H G, KIM J, CHOI H. In vitro model of distinct catabolic and inflammatory response patterns of endothelial cells to intervertebral disc cell degeneration[J/OL]. Sci Rep, 2020, 10: 20596. DOI: 10.1038/s41598-020-77785-6.
|
| [26] |
YAO Y, XUE H, CHEN X, CAO Y, YU J, JIANG X, et al. Polarization of helper T lymphocytes maybe involved in the pathogenesis of lumbar disc herniation[J]. Iran J Allergy Asthma Immunol, 2017, 16: 347-357. |
| [27] |
KEDONG H, WANG D, SAGARAM M, AN H S, CHEE A. Anti-inflammatory effects of interleukin-4 on intervertebral disc cells[J]. Spine J, 2020, 20: 60-68. DOI:10.1016/j.spinee.2019.06.025 |
| [28] |
HE W S, ZOU M X, YAN Y G, YAO N Z, CHEN W K, LI Z, et al. Interleukin-17A promotes human disc degeneration by inhibiting autophagy through the activation of the phosphatidylinositol 3-kinase/Akt/Bcl2 signaling pathway[J/OL]. World Neurosurg, 2020, 143: e215-e223. DOI: 10.1016/j.wneu.2020.07.117.
|
| [29] |
XU C, ZHANG M, LI K, NI M, BAI Y, ZHANG J, et al. CD24hiCD38hi B regulatory cells from patients with end plate inflammation presented reduced functional potency[J]. Int Immunopharmacol, 2019, 70: 295-301. DOI:10.1016/j.intimp.2019.02.034 |
| [30] |
AGIUS R, GALEA R, FAVA S. Bone mineral density and intervertebral disc height in type 2 diabetes[J]. J Diabetes Complications, 2016, 30: 644-650. DOI:10.1016/j.jdiacomp.2016.01.021 |
| [31] |
RUSSO F, AMBROSIO L, NGO K, VADALÀ G, DENARO V, FAN Y, et al. The role of typeⅠdiabetes in intervertebral disc degeneration[J]. Spine (Phila Pa 1976), 2019, 44: 1177-1185. DOI:10.1097/BRS.0000000000003054 |
| [32] |
RUIZ-FERNÁNDEZ C, FRANCISCO V, PINO J, MERA A, GONZÁLEZ-GAY M A, GÓMEZ R, et al. Molecular relationships among obesity, inflammation and intervertebral disc degeneration: are adipokines the common link?[J/OL]. Int J Mol Sci, 2019, 20: 2030. DOI: 10.3390/ijms20082030.
|
| [33] |
SONG X X, YU Y J, LI X F, LIU Z D, YU B W, GUO Z. Estrogen receptor expression in lumbar intervertebral disc of the elderly: gender- and degeneration degree-related variations[J]. Joint Bone Spine, 2014, 81: 250-253. DOI:10.1016/j.jbspin.2013.09.002 |
| [34] |
ARAVI B, LI Z, LANG C N, SCHMID B, LANG F K, GRAD S, et al. The tissue renin-angiotensin system and its role in the pathogenesis of major human diseases: quo vadis?[J/OL]. Cells, 2021, 10: 650. DOI: 10.3390/cells10030650.
|
| [35] |
HUANG H S, CHENG S F, ZHENG T H, YE Y H, YE A Z, ZHU S Q, et al. Vitamin D retards intervertebral disc degeneration through inactivation of the NF-κB pathway in mice[J]. Am J Transl Res, 2019, 11: 2496-2506. |
 2021, Vol. 42
2021, Vol. 42


