2. 华中科技大学同济医学院附属武汉儿童医院(武汉市妇幼保健院)超声科, 武汉 430014
2. Department of Ultrasound, Wuhan Children's Hospital (Wuhan Maternal and Child Healthcare Hospital), Tongji Medical College, Huazhong University of Science & Technology, Wuhan 430014, Hubei, China
完全植入式静脉输液港(以下简称输液港)是一种由输液港座和硅胶导管组成的完全植入的血管通道系统,可长时间连续输液和多次采血,解除了多次静脉穿刺对患者带来的痛苦,同时减少了对静脉的破坏。近年来输液港在儿童肿瘤患者中的应用逐渐普及[1-2]。输液港导管尖端的理想位置为上腔静脉下1/3至右心房上腔静脉口之间[3-4]。目前临床上主要应用术中X线片或腔内心电图技术定位输液港导管尖端的位置,经食管和经胸心脏超声定位的相关报道较少。X线定位为非实时性定位,术中需多次摄片,会对患者造成较多的辐射伤害。腔内心电图定位技术无辐射伤害,可实时监测,但不适用于心律异常或P波异常的患者。超声定位具有直观、无辐射等优点,为了解决以上问题,我院普外科自2019年1月开始与超声科合作开展术中床旁经胸心脏超声监视下输液港导管尖端定位,取得了良好的临床效果。本研究对经胸心脏超声辅助输液港导管尖端定位病例的相关临床资料进行了总结,并与采用X线片定位的病例资料进行对比分析,现报告如下。
1 资料和方法 1.1 病例资料与分组回顾性分析2015年3月至2018年12月(采用床边胸部X线片进行术中输液港导管尖端定位)和2019年1月至2020年6月(采用床旁经胸心脏超声进行术中输液港导管尖端定位)在我院行输液港植入术的238例恶性肿瘤患儿的临床资料,排除同时接受其他手术(如恶性肿瘤切除术、肿瘤活检术等)而无法准确记录输液港植入手术时长的病例(31例)、输液港植入术后1周内死亡的病例(2例)和植入术后因原发病放弃治疗而导致随访时间短于1周的病例(5例),最终200例患儿纳入研究。根据术中导管尖端定位方式将患儿分为两组:X线片定位组(105例)和超声定位组(95例)。本研究通过我院伦理委员会审批(2021R049-E01)。
1.2 设备与手术方法Celsite® Babyport(适用于小儿,型号为04433742,4.5 F)植入式静脉输液港及穿刺套件均为德国Braun公司产品。超声仪器使用荷兰Philips公司EPIQ5型彩色多普勒超声诊断仪,心脏超声检查采用S8-3型相控阵探头。
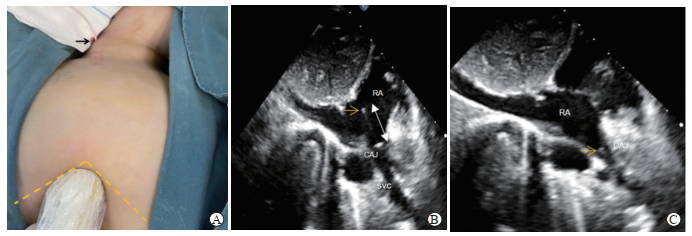
完善术前检查排除颈部血管畸形和心、肝、肺、肾等重要器官功能异常,确定拟手术区无感染、外伤及放射治疗等情况。患儿平卧于手术台上,全身麻醉插管成功后垫高肩部,取轻度头低脚高位,头部偏向左侧。常规消毒铺巾,选择右侧颈部胸锁乳突肌中段内侧缘,用浅表超声探头辅助定位颈内静脉穿刺点。颈内静脉穿刺成功后退出穿刺针,经穿刺针鞘引入导丝进入颈内静脉,然后经导丝引入导管鞘并送入导管,退出鞘体后在X线片定位或经胸心脏超声定位辅助下调整导管尖端位置并固定导管。在右侧锁骨下、乳腺上方胸壁位置选择皮下脂肪较厚处做横切口,依次切开皮肤、皮下组织,锐性分离至胸大肌表面筋膜层,再向足侧钝性分离出一皮囊,大小刚好能容纳输液港座并用纱布填塞止血。用隧道针打通至颈内静脉穿刺点,引导导管至切口处,去除多余导管,连接输液港座和导管,牢固固定并锁上,将输液港座埋入皮下,缝合切口,插入无损针行试验性注药。X线片定位组通过拍摄床边胸部X线片观察导管植入位置,若导管与上腔静脉走行一致,且导管尖端位于T5~T7胸椎水平则认为导管尖端达到位置理想,若未达到理想位置则调整植入深度后再次拍摄X线片,直至到达理想位置。超声定位组在剑突下四腔心切面的基础上,将探头逆时针旋转45°~90°并指向头侧,即显示剑突下双心房切面,此切面可以清晰显示左心房、右心房、上腔静脉、下腔静脉及右心房的上、下腔静脉口,能全程监测上腔静脉下段至右心房的情况。确定右心房内导管尖端后冻结图像,测量导管尖端与右心房上腔静脉口的距离(L)后调整导管位置,向上腔静脉内退出L+0.5 cm长度,观察确认导管在上腔静脉内(图 1)。由于上腔静脉及右心房内血流速度较快,导管在右心房内或上腔静脉内处于漂浮摆动状态,不同的切面下导管可能显示为点状或带状强回声,为了准确定位可从导管远端注入2~3 mL生理盐水,借助液体流动的动态图像辨别导管尖端的位置。由于肋骨、胸骨及肺的遮挡,超声下上腔静脉的中上段显示不佳,因此超声不能监视导管全程。超声定位时如果导管植入一定长度后右心房内始终看不到导管,说明导管异位需调整置管方法或拍摄X线片观察导管位置。
|
图 1 经胸心脏超声辅助下完全植入式静脉输液港导管尖端定位 A:经胸心脏超声导管定位时超声探头的位置.黄色虚线表示双侧肋弓下缘,黑色箭头示颈部穿刺部位.B:右心房(RA)和上腔静脉(SVC)内导管的超声图像.黄色箭头指位于RA内的导管尖端,白色双箭头线为导管尖端到右心房上腔静脉口(CAJ)的距离(L).C:导管尖端调整到理想位置的超声图像.将导管向SVC内退回L+0.5 cm长度,导管尖端(黄色箭头所示)最终位于CAJ. |
1.3 随访
两组患儿术后第1天均行立位胸部X线片检查,评估导管尖端位置,以导管尖端位于T5~T7胸椎水平为理想位置,超过此范围说明位置不理想,若发现严重异位影响使用则再次行植入手术进行调整。出院后采取门诊方式进行随访,随访时均行颈部血管超声和胸部X线片检查,随访内容包括输液港导管相关血栓形成、导管周围纤维蛋白鞘形成、导管异位、导管相关感染、伤口感染、导管断裂、导管相关性血流感染、非计划取出输液港等并发症的发生情况。术后第1次门诊随访为术后1周,若输液港使用过程中无异常情况则每3个月随访1次。随访截止日期为2020年7月30日或取出输液港或死亡。
1.4 统计学处理应用SPSS 22.0软件进行统计学分析。计量资料以x±s表示,两组间比较采用独立样本t检验。计数资料以例数和百分数表示,两组间比较采用χ2检验或连续校正χ2检验。检验水准(α)为0.05。
2 结果共200例患儿入组,男96例,女104例;月龄为3~40个月,平均月龄为(13.78±6.66)个月;身高为57~101 cm,平均身高为(72.02±8.80)cm;体重为5.1~15.0 kg,平均体重为(8.49±2.17)kg;BMI为12.81~22.72 kg/m2,平均BMI为(16.15±1.50)kg/m2;血液系统恶性肿瘤152例,恶性实体瘤48例。X线片定位组105例,男50例(47.6%)、女55例(52.4%);月龄为3~40个月,平均(13.55±6.81)个月;80例为血液系统恶性肿瘤,25例为恶性实体瘤。超声定位组95例,男46例(48.4%)、女49例(51.6%);月龄为5~40个月,平均(14.53±6.03)个月;72例为血液系统恶性肿瘤,23例为恶性实体瘤。两组患儿在年龄、性别、身高、体重、BMI、肿瘤类型方面差异均无统计学意义(P均>0.05)。X线片定位组患儿的手术时长长于超声定位组,差异有统计学意义(P<0.01);两组患儿导管尖端位置理想率差异无统计学意义(P=0.167);两组患儿在置管过程中均未发生气胸、血气胸、气体栓塞、心包及血管穿透伤、严重心律失常等并发症。术后随访过程中两组患儿均未出现导管断裂。术后随访期间,两组患儿伤口感染、导管相关性血栓形成、导管周围纤维蛋白鞘形成、导管异位、导管相关血流感染、非计划取出输液港的发生率差异均无统计学意义(P均>0.05)。见表 1。
|
|
表 1 两组行完全植入式静脉输液港植入术的恶性肿瘤患儿资料比较 |
3 讨论
输液港的临床应用由Niederhuber等[5]于1982年首次报道,目前输液港已广泛应用于肿瘤的化学治疗。儿童患者血管细小、静脉穿刺困难、输液依从性较低,输液港的应用避免了多次穿刺对患儿造成的痛苦,但儿童输液港需要在全身麻醉下植入,后期若出现导管堵塞、弯折、异位等并发症时其调整也要在全身麻醉下进行,因此儿童输液港一次性准确植入极为重要。
儿童输液港静脉入路主要为颈内静脉,输液港导管尖端的理想位置被认为是上腔静脉下1/3或右心房的上腔静脉口[3-4, 6]。此处血管管腔较大,导管尖端易漂浮在管腔中,不易贴壁,且此处血液流量大能迅速稀释药物浓度,避免药物对血管壁造成刺激和损伤。研究显示若导管尖端位置过深,患儿活动上肢时容易发生胸闷、心悸等不适,也可能导致心律失常,甚至可能因为导管反复摩擦、刺激导致心肌穿孔、瓣膜损伤、心内膜炎、心房内血栓形成等危及患儿生命;导管尖端位置过浅容易因活动致导管漂移而引起导管尖端异位、导管相关性血栓形成、导管周围纤维蛋白鞘形成、药物稀释不够导致静脉壁腐蚀性静脉炎、静脉穿孔等[7-10]。因此,输液港尖端的位置关系着输液港的安全留置和正常使用,置管后及时确定导管尖端位置是否符合要求非常重要。
目前床边X线片定位被认为是术中确定导管尖端位置的标准方法,此方式主要应用X线下胸部的特定解剖学标志辅助定位,这些标志包括胸椎、肋间隙、气管隆突等。X线片定位为间接定位,术中不能直观地观察到导管在上腔静脉内的位置,因此不能排除因患者解剖学标志的个体差异造成的误差。咸玉涛等[11]的研究显示同一患者导管尖端位置会随患者的体位变化发生改变,由立位变为卧位时导管尖端易向心房内移动,深度平均差异可达约9 mm。这可能也是本研究中X线片定位组术后复查时有8例患儿导管尖端不在理想位置的主要原因。术中患儿取平卧位拍摄X线片定位,术后立位摄片复查时可能由于体位变化造成导管尖端移位。另外由于术中颈内静脉穿刺的需要,患儿肩颈部会被垫高,此时人体躯干与床水平面有一定角度,导致床边摄片时X射线与患儿身体成一定角度,这也可能影响术中定位的准确性。
经食管心脏超声最初被用来确定ICU患者中心静脉导管尖端位置,但其费用昂贵且为有创操作。随着超声技术的进步,研究者们逐渐将经胸心脏超声用于中心静脉导管尖端位置的判断,且与X线片定位的准确度呈高度一致性[12-13]。本研究首次将经胸心脏超声辅助导管尖端定位应用在儿童输液港植入术中,结果显示超声定位组与X线片定位组导管尖端位置理想率差异无统计学意义,与既往研究结果[12-13]一致。超声可直接观察导管在右心房及上腔静脉下段中的位置,并且能实时监测调整,也可在置管过程中随时冻结图像,准确测量导管尖端与右心房上腔静脉口的相对距离,使导管尖端位置调节更精确,一步到位,避免了反复调整置管深度,这既能确保定位的准确性又能节约手术时间。另外,目前颈内静脉穿刺已常规应用超声引导,心脏超声定位仅需更换不同的超声探头,不需要额外增加其他设备,患者体位也不需要变动。而X线片定位需另外搬运床边X线机,摄片时可能需要搬动患者,这或许也是应用超声定位时手术时间相对较短的原因。
本研究中,采用2种定位方式的患儿术后导管相关性血栓形成、导管周围纤维蛋白鞘形成、导管异位、导管相关血流感染、非计划取出输液港等并发症的发生率差异均无统计学意义(P均>0.05)。既往文献报道输液港伤口局部感染率为2.5%~3%[14],年龄<10岁的患儿更容易发生感染[15]。本研究中X线片定位组伤口感染率(7.6%,8/105)略高于超声定位组(1.1%,1/95),但两组间比较差异无统计学意义(P=0.058)。造成X线片定位组伤口感染率相对偏高的原因可能有以下2个方面:(1)术中床边拍摄X线片时,为将数字X线摄影平板探测器放在患儿背部需搬动患儿,且为避免X线暴露,摄片时手术人员反复进出手术室可能破坏了手术室无菌区环境,这些都增加了患儿伤口感染的机会;(2)X线片定位组手术时间较超声定位组长,伤口暴露于空气中的时间较长使患儿发生伤口感染的概率更大。
综上所述,在儿童输液港植入术中经胸心脏超声能准确地定位输液港导管尖端。与传统X线片定位相比,经胸心脏超声定位能直观、实时地监测输液港导管位置,且具有无X线辐射、手术时间短、设备要求简单、手术开展方便等优势,值得在临床推广应用。
| [1] |
牛传强, 姜华, 李海波, 周少毅, 陈昆山, 张靖. 完全植入式静脉输液港在儿童的应用价值[J]. 中华放射学杂志, 2018, 52: 560-561. DOI:10.3760/cma.j.issn.1005-1201.2018.07.014 |
| [2] |
李晨晨, 胡明, 褚珺, 陈其民, 蔡金晶. 外周穿刺中心静脉导管与完全植入式静脉输液港在儿童肿瘤的临床比较[J]. 介入放射学杂志, 2018, 27: 735-739. DOI:10.3969/j.issn.1008-794X.2018.08.008 |
| [3] |
GORSKI L A. The 2016 infusion therapy standards of practice[J]. Home Healthc Now, 2017, 35: 10-18. DOI:10.1097/NHH.0000000000000481 |
| [4] |
中心静脉通路上海协作组, 上海市抗癌协会实体肿瘤聚焦诊疗专委会血管通路专家委员会. 完全植入式输液港上海专家共识(2019)[J]. 介入放射学杂志, 2019, 28: 1123-1128. |
| [5] |
NIEDERHUBER J E, ENSMINGER W, GYVES J W, LIEPMAN M, DOAN K, COZZI E. Totally implanted venous and arterial access system to replace external catheters in cancer treatment[J]. Surgery, 1982, 92: 706-712. |
| [6] |
CAERS J, FONTAINE C, VINH-HUNG V, DE MEY J, PONNET G, OOST C, et al. Catheter tip position as a risk factor for thrombosis associated with the use of subcutaneous infusion Ports[J]. Support Care Cancer, 2005, 13: 325-331. DOI:10.1007/s00520-004-0723-1 |
| [7] |
MA L, LIU Y P, WANG J X, CHANG Y, YU L, GENG C Z. Totally implantable venous access port systems and associated complications: a single-institution retrospective analysis of 2, 996 breast cancer patients[J]. Mol Clin Oncol, 2016, 4: 456-460. DOI:10.3892/mco.2016.726 |
| [8] |
REVEL-VILK S, YACOBOVICH J, TAMARY H, GOLDSTEIN G, NEMET S, WEINTRAUB M, et al. Risk factors for central venous catheter thrombotic complications in children and adolescents with cancer[J]. Cancer, 2010, 116: 4197-4205. DOI:10.1002/cncr.25199 |
| [9] |
GOMINET M, COMPAIN F, BELOIN C, LEBEAUX D. Central venous catheters and biofilms: where do we stand in 2017?[J]. APMIS, 2017, 125: 365-375. DOI:10.1111/apm.12665 |
| [10] |
GRANZIERA E, SCARPA M, CICCARESE A, FILIP B, CAGOL M, MANFREDI V, et al. Totally implantable venous access devices: retrospective analysis of different insertion techniques and predictors of complications in 796 devices implanted in a single institution[J/OL]. BMC Surg, 2014, 14: 27. DOI: 10.1186/1471-2482-14-27.
|
| [11] |
咸玉涛, 杨正强, 夏金国, 王磊, 施海彬. 体位改变对完全植入式静脉输液港导管头端位置影响[J]. 介入放射学杂志, 2018, 27: 20-23. |
| [12] |
ZANOBETTI M, COPPA A, BULLETTI F, PIAZZA S, NAZERIAN P, CONTI A, et al. Verification of correct central venous catheter placement in the emergency department: comparison between ultrasonography and chest radiography[J]. Intern Emerg Med, 2013, 8: 173-180. DOI:10.1007/s11739-012-0885-7 |
| [13] |
ZAGHLOUL N, WATKINS L, CHOI-ROSEN J, PERVEEN S, KUREPA D. The superiority of point of care ultrasound in localizing central venous line tip position over time[J]. Eur J Pediatr, 2019, 178: 173-179. DOI:10.1007/s00431-018-3269-9 |
| [14] |
KARANLIK H, KURUL S, SAIP P, UNAL E S, SEN F, DISCI R, et al. The role of antibiotic prophylaxis in totally implantable venous access device placement: results of a single-center prospective randomized trial[J]. Am J Surg, 2011, 202: 10-15. DOI:10.1016/j.amjsurg.2010.05.005 |
| [15] |
PENEL N, NEU J C, CLISANT S, HOPPE H, DEVOS P, YAZDANPANAH Y. Risk factors for early catheter-related infections in cancer patients[J]. Cancer, 2007, 110: 1586-1592. DOI:10.1002/cncr.22942 |
 2021, Vol. 42
2021, Vol. 42


