2. 武警上海市总队医院肾内科, 上海 201103
2. Department of Nephrology, Hospital of Shanghai Armed Police, Shanghai 201103, China
肾细胞癌是泌尿生殖系统恶性肿瘤,近年来其发病率明显上升[1-2]。早期肾细胞癌可通过手术切除进行治疗,然而早期患者通常缺乏明显症状,疾病发现困难[3]。此外,即使成功手术切除,仍有30%~40%的局部肾细胞癌患者会复发或转移[4-5]。肾细胞癌通常对放射治疗和化学治疗不敏感,因此治疗手段极为有限,迫切需要研发新的治疗策略。
黄芪是一种传统中草药,已被广泛用于多种恶性肿瘤的辅助治疗[6-7]。研究发现,黄芪的某些成分可以促进肿瘤细胞的凋亡并激活免疫系统;黄芪皂苷可以在体外诱导细胞周期停滞并抑制荷瘤小鼠模型肿瘤的生长[8]。但目前尚不明确黄芪是否会对肾细胞癌造成影响,也不清楚其作用机制。
滤泡辅助性T细胞(follicular helper T cell,Tfh细胞)在抗肿瘤免疫中发挥着重要作用,有可能成为免疫疗法的靶点。Tfh细胞的结构特征在于转录因子Bcl-6及表面分子C-X-C基序趋化因子受体5(C-X-C motif chemokine receptor 5,CXCR5)和程序性死亡1蛋白的表达[9],活化的Tfh细胞不仅表达C-X-C基序趋化因子配体13(C-X-C motif chemokine ligand 13,CXCL13)、与CXCR5相互作用、介导B细胞和Tfh细胞的迁移与共定位,还表达CD40L、IL-21和IL-4,在B细胞活化、增殖、类别转换重组和/或浆细胞分化中发挥作用[9-11]。Tfh细胞可以浸润乳腺癌,与患者存活期呈正相关[12]。在肿瘤内,Tfh细胞被认为可通过表达IL-21和CXCL13促进第三级淋巴器官的形成并介导抗肿瘤免疫[10]。此外,结直肠癌患者的生存率也与Tfh细胞的效应基因IL-21和CXCL13表达呈正相关[13]。本研究通过评估黄芪提取物对Tfh细胞的影响,探究其对肾细胞癌的生长及Tfh细胞肿瘤浸润的作用。
1 材料和方法 1.1 肾细胞癌小鼠模型的建立与分组56只BALB/c小鼠购自北京维通利华实验动物技术有限公司[实验动物生产许可证号:SCXK(京)-2016-0011],饲养至8周时建模。小鼠肾癌细胞系Renca细胞(美国ATCC公司)以每50 µL 5×106个细胞的密度重悬于PBS(美国Gibco公司),然后与50 µL低生长因子基底膜基质(美国Corning公司)混合。经皮下途径将细胞悬液注射到小鼠背部建立肾细胞癌模型。
黄芪提取物购自济南益诺生物科技有限公司,产品采用水提取法,其中黄芪甲苷的质量分数为95.2%。将56只小鼠随机分为2组:黄芪治疗组,每天通过管饲法予0.5 mg/g黄芪提取物处理;对照组,每天给予相等体积的纯净水。将所有小鼠置于SPF级、20~22 ℃、45%~55%相对湿度、12 h明暗循环条件下饲养。肿瘤建模后继续饲养21 d。两组分别于建模第0、9、12、15、18、21天各处死3只小鼠,切取肿瘤和脾脏后,测量肿瘤体积和质量;两组余10只小鼠均饲养至建模后第21天处死,分析Tfh细胞在黄芪治疗肿瘤中的作用。
1.2 细胞分离与Tfh细胞分析参照文献[14]分离小鼠脾细胞和肿瘤浸润淋巴细胞。用抗小鼠CD3、CD4和CXCR5抗体(美国BioLegend公司)或抗小鼠CD3和CD8抗体(美国BioLegend公司)对小鼠脾细胞和肿瘤浸润淋巴细胞染色30 min。洗涤后,用FACSAria型流式细胞仪(美国Becton Dickinson公司)分离CD3+CD4+CXCR5+ T细胞或CD3+CD8+ T细胞。CD3+CD4+CXCR5+ T细胞定义为Tfh细胞,用流式细胞术检测CD8+ T细胞水平及Tfh细胞占CD4+ T细胞的比例。
1.3 qRT-PCR检测IL-21 mRNA表达用TRIzol试剂(美国Invitrogen公司)处理Tfh细胞和CD3+CD8+CXCR5- T细胞,提取总RNA,方法如下:每5×106个细胞加入1 mL TRIzol试剂,充分震荡后12 000×g离心5 min,弃沉淀;加入200 µL氯仿,手动振荡混匀,室温放置10 min;4 ℃ 12 000×g离心15 min,吸取上层水相移至另一新的离心管中,按每1 mL TRIzol试剂0.6 mL异戊醇的比例加入异戊醇,混匀后室温放置10 min;4 ℃ 12 000×g离心10 min,弃上清液,按每1 mL TRIzol试剂1 mL 75%乙醇的比例加入75%乙醇,温和振荡,悬浮沉淀,真空干燥。然后定量RNA浓度。之后用SuperScript Ⅳ反转录试剂盒(美国Invitrogen公司)进行反转录,获得cDNA。采用IL-21基因表达检测试剂盒(Mm00517640_m1,美国ThermoFisher Scientific公司)进行TaqMan分析,以β-actin(Mm02619580_g1,美国ThermoFisher Scientific公司)为内参基因,检测IL-21 mRNA表达水平。每个分析独立重复3次。
1.4 ELISA检测细胞培养基中IL-21的水平利用DynabeadsTM小鼠T细胞激活剂CD3/CD28(美国ThermoFisher Scientific公司)刺激Tfh细胞24 h。收集上清液,按照小鼠IL-21 ELISA检测试剂盒(美国BioLegend公司)说明书检测细胞培养基中IL-21水平。
1.5 统计学处理应用GraphPad Prism 7.0软件进行统计学分析。计量资料以x±s表示,两组不同时间点数据的比较采用双因素方差分析和Sidak法多重比较,两组间数据的比较采用独立样本t检验。采用Pearson相关分析进行相关性分析。检验水准(α)为0.05。
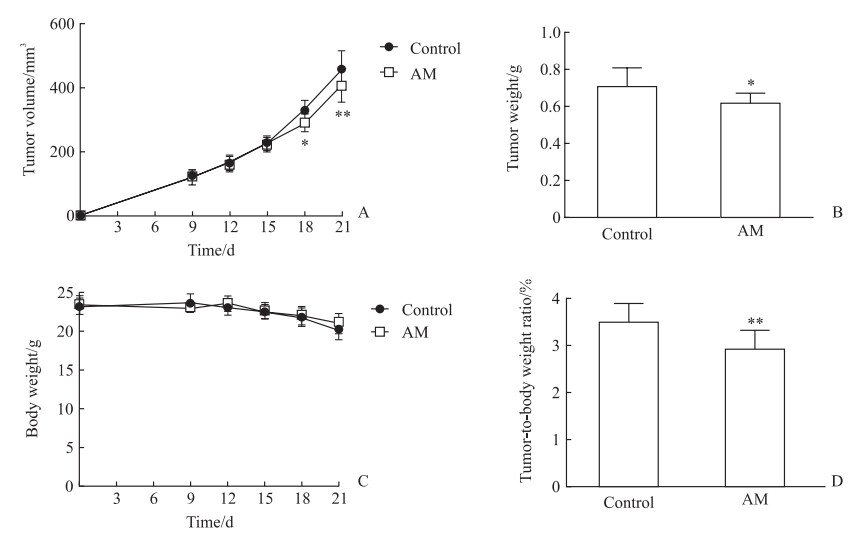
2 结果 2.1 黄芪提取物抑制肾细胞癌的生长56只肾细胞癌小鼠模型均建模成功,用于进一步实验。从建模后第9天(当肿瘤体积达到100 mm3以上时)至第21天每3 d监测1次肿瘤的生长情况,结果显示在建模后第9、12、15天时,黄芪治疗组和对照组小鼠的肿瘤体积差异均无统计学意义(P均>0.05),在建模后第18天和第21天时黄芪治疗组小鼠的肿瘤体积均较对照组小,差异均有统计学意义(P<0.05、P<0.01,图 1A)。在建模后第21天,黄芪治疗组小鼠的肿瘤质量轻于对照组[(0.61±0.06)g vs(0.71±0.10 g)],差异有统计学意义(P<0.05,图 1B)。在建模后第9~21天黄芪治疗组和对照组小鼠的体重差异均无统计学意义(P均>0.05,图 1C)。在建模后第21天,黄芪治疗组小鼠的肿瘤占体重的百分比低于对照组[(2.92±0.40)% vs(3.50±0.41)%,P<0.01,图 1D]。结果表明,黄芪提取物减缓了肾细胞癌的生长。
|
图 1 AM提取物对小鼠肾细胞癌生长的影响 Fig 1 Effect of AM extract on growth of renal cell carcinoma in mice A: The tumor volume of the mice at different time points after modeling; B: The tumor weight of the mice 21 d after modeling; C: The body weight of the mice at different time points after modeling; D: The tumor weight as a percentage of the body weight of mice 21 d after modeling. *P < 0.05, **P < 0.01 vs control group at same time point. n=3 (Fig 1A and 1C) or 10 (Fig 1B and 1D), x±s. AM: Astragalus membranaceus. |
2.2 黄芪提取物促进肾细胞癌模型小鼠肿瘤微环境中Tfh细胞的浸润
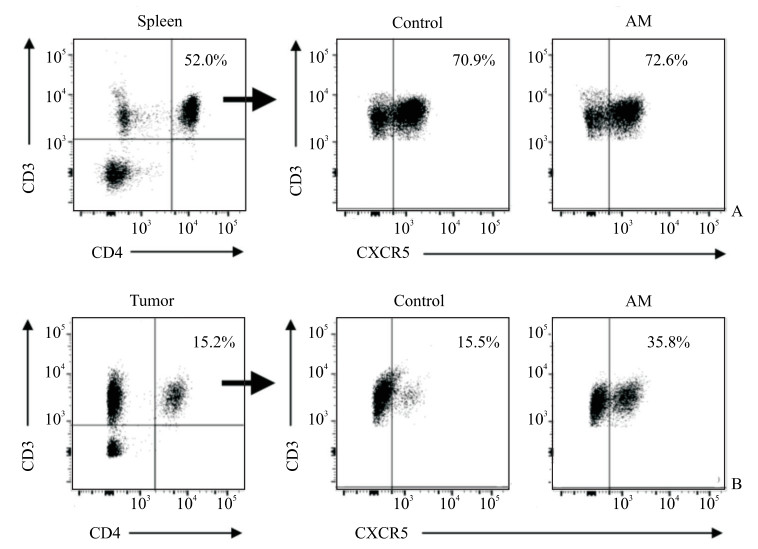
流式细胞术检测结果(图 2)显示,建模后第21天黄芪治疗组和对照组小鼠脾脏中Tfh细胞的比例分别为(73.59±6.63)%和(71.54±3.17)%,差异无统计学意义(P>0.05);但黄芪治疗组小鼠肿瘤中Tfh细胞的比例高于对照组[(29.78±6.19)% vs(22.61±5.88)%],差异有统计学意义(P<0.05)。
|
图 2 流式细胞术检测肾细胞癌小鼠脾脏和肿瘤组织中Tfh细胞的比例 Fig 2 Tfh cell proportions in spleen and tumor of renal cell carcinoma mice detected by flow cytometry A: Identification strategy of CD3+CD4+CXCR5+ cells in mouse spleen 21 d after modeling; B: Identification strategy of CD3+CD4+CXCR5+ cells in mouse tumor 21 d after modeling. Thf cell: Follicular helper T cell; AM: Astragalus membranaceus; CXCR5: C-X-C motif chemokine receptor 5. |
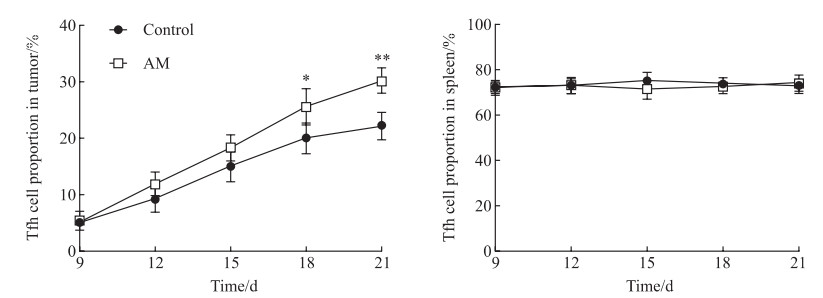
如图 3所示,建模后第9天至第21天两组小鼠肿瘤中Tfh细胞水平均逐渐增加,至建模后第18天和第21天,黄芪治疗组小鼠肿瘤中Tfh细胞比例均高于对照组且差异均有统计学意义(P<0.05、P<0.01);在小鼠脾脏中,Tfh细胞的比例从第9天到第21天保持稳定,两组之间差异无统计学意义(P>0.05)。
|
图 3 流式细胞术检测肾细胞癌小鼠肿瘤和脾脏中Tfh细胞水平 Fig 3 Tfh cell proportions in tumor and spleen of renal cell carcinoma mice detected by flow cytometry *P < 0.05, **P < 0.01 vs control group at same time point. n=3, x±s. Tfh cell: Follicular helper T cell; AM: Astragalus membranaceus. |
2.3 黄芪提取物使小鼠Tfh细胞中IL-21表达水平升高
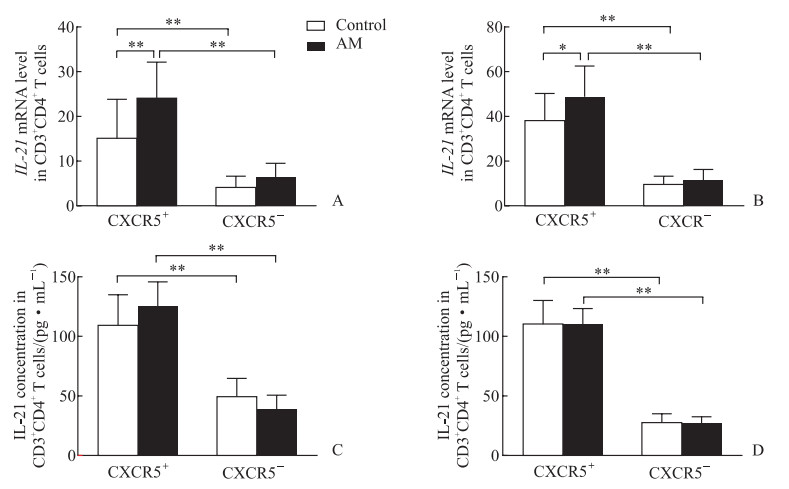
对照组小鼠脾脏Tfh细胞中IL-21 mRNA表达水平高于CD3 + CD4 + CXCR5 - T细胞中的表达水平(P<0.01),表明IL-21主要由Tfh细胞表达;黄芪治疗组小鼠脾脏Tfh细胞中IL-21 mRNA表达水平高于对照组Tfh细胞(P<0.01,图 4A)。在肿瘤组织中观察到相似现象,即Tfh细胞是IL-21主要的产生者,而黄芪治疗组小鼠Tfh细胞的IL-21 mRNA表达水平高于对照组Tfh细胞(P<0.05,图 4B)。用抗CD3/CD28刺激小鼠脾脏和肿瘤Tfh细胞后,其IL-21分泌水平均高于CD3 + CD4 + CXCR5 - T细胞(P均<0.01),黄芪治疗组和对照组Tfh细胞的IL-21分泌水平比较差异无统计学意义(图 4C、4D)。
|
图 4 肾细胞癌小鼠脾脏和肿瘤浸润性Tfh细胞中IL-21的表达水平 Fig 4 Expression levels of IL-21 in splenic and tumor-infiltrating Tfh cells of renal cell carcinoma mice A: IL-21 mRNA level in splenic CD3+CD4+ T cells 21 d after modeling detected by qRT-PCR; B: IL-21 mRNA level in tumor-infiltrating CD3+CD4+ T cells 21 d after modeling detected by qRT-PCR; C: IL-21 secretion mediated by CD3/CD28-activated splenic CD3+CD4+ T cells 21 d after modeling detected by ELISA; D: IL-21 secretion mediated by CD3/CD28-activated tumor-infiltrating CD3+CD4+ T cells 21 d after modeling detected by ELISA. *P < 0.05, **P < 0.01. n=10, x±s. Tfh cell: Follicular helper T cell; IL-21: Interleukin 21; CXCR5: C-X-C motif chemokine receptor 5; qRT-PCR: Quantitative real-time polymerase chain reaction; ELISA: Enzyme-linked immunosorbent assay. |
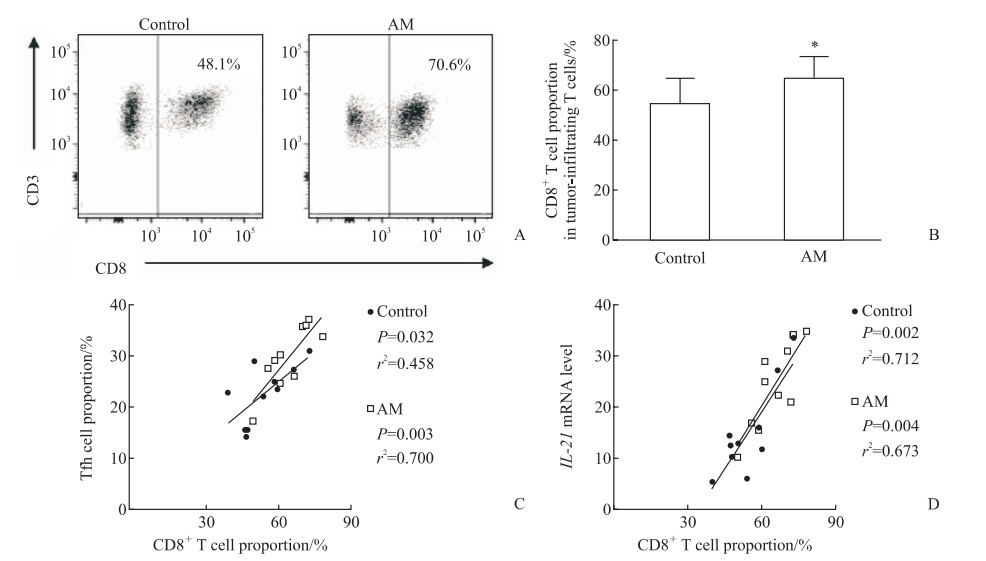
2.4 黄芪提取物促进肿瘤中CD8 + T细胞的浸润且与Tfh细胞水平呈正相关
流式细胞术检测结果显示,黄芪治疗组小鼠肿瘤中CD8 + T细胞水平高于对照组(P<0.05,图 5A、5B)。Pearson相关分析结果显示,两组小鼠肿瘤浸润性CD8 + T细胞的水平均与肿瘤浸润性Tfh细胞的水平呈正相关(P<0.05、P<0.01,图 5C),也均与Tfh细胞中的IL-21 mRNA表达水平呈正相关(P均<0.01,图 5D)。
|
图 5 肾细胞癌小鼠肿瘤中CD8+ T细胞水平及其与Tfh细胞的相关性 Fig 5 CD8+ T cell proportion and the correlation with Tfh cells in tumor of renal cell carcinoma mice A: Representative flow cytometry chart of CD8+ T cell proportion 21 d after modeling; B: The proportion of CD8+ T cells in tumor-infiltrating T cells 21 d after modeling; C: Correlation between tumor Tfh cell proportion and tumor CD8+ T cell proportion 21 d after modeling; D: The correlation between tumor IL-21 mRNA expression level and tumor CD8+ T cell proportion 21 d after modeling. *P < 0.05 vs control group. n=10, x±s. Tfh cell: Follicular helper T cell; AM: Astragalus membranaceus; IL-21: Interleukin 21. |
3 讨论
肾细胞癌是泌尿生殖系统常见的恶性肿瘤,目前尚无有效的治疗方法[1]。黄芪在多种肿瘤中发挥抗癌作用[7-9],黄芪提取物可以促进小鼠肝癌细胞H22凋亡、提高Bcl-2关联X蛋白基因的表达、降低Bcl-2基因的表达,并可增加荷瘤小鼠脾脏CD4/CD8比值,提高腹腔巨噬细胞吞噬能力[7]。此外,黄芪提取物可使人鼻咽癌CNE-2细胞贴壁减少、细胞收缩变小,增殖明显受到抑制且有浓度和作用时间依赖性[7]。黄芪注射液可以延长肺癌荷瘤小鼠的生存时间、增加T细胞的比例和血清IL-2水平[8]。然而,黄芪与肾细胞癌的关系及作用机制仍不明确。
本实验中黄芪治疗组肾细胞癌模型小鼠的肿瘤体积小于对照组,而两组小鼠整体体重却相当,说明黄芪对肾细胞癌模型小鼠有抗肿瘤作用。本研究多项数据表明黄芪通过促进Tfh细胞的功能发挥抗癌作用。(1)与对照组相比,黄芪治疗组小鼠脾脏中Tfh细胞水平无变化,但肿瘤浸润Tfh细胞水平更高(P<0.05);(2)在肿瘤形成的第18天和第21天黄芪治疗组Tfh细胞向肿瘤的迁移多于对照组(P<0.05、P<0.01),与此同时黄芪治疗组的肿瘤体积小于对照组(P<0.05、P<0.01);(3)黄芪治疗组脾脏和肿瘤中Tfh细胞的IL-21 mRNA表达水平均更高(P均<0.01),原因并不是对照组缺乏IL-21表达潜力,之后的实验数据证明在体外激活的Tfh细胞中IL-21的水平在对照组和黄芪治疗组之间是相当的,推测黄芪治疗升高了肿瘤内Tfh细胞的激活水平;(4)黄芪治疗组肿瘤中CD8+ T细胞浸润水平高于对照组(P<0.05),且与Tfh细胞水平和Tfh介导的IL-21产生均呈正相关(P均<0.01)。
本实验也发现了一些问题,黄芪对小鼠肿瘤的影响总体很弱,目前尚不清楚这种较小的差异是否对黄芪治疗肾细胞癌患者有影响。此外,本实验仅利用少数指标对干预过程与研究结局之间的相关性进行了探索,进一步研究中将对黄芪提取物干预下Tfh细胞的各项功能改变进行全面探讨。另外,本实验使用的黄芪提取物含多种成分,还应进一步分析黄芪中特定成分的作用,这可能有助于确定黄芪的抗肿瘤活性成分。
| [1] |
SIEGEL R, NAISHADHAM D, JEMAL A. Cancer statistics, 2013[J]. CA Cancer J Clin, 2013, 63: 11-30. DOI:10.3322/caac.21166 |
| [2] |
USHER-SMITH J, SIMMONS R K, ROSSI S H, STEWART G D. Current evidence on screening for renal cancer[J]. Nat Rev Urol, 2020, 17: 637-642. DOI:10.1038/s41585-020-0363-3 |
| [3] |
CLARK D J, ZHANG H. Proteomic approaches for characterizing renal cell carcinoma[J/OL]. Clin Proteomics, 2020, 17: 28. DOI: 10.1186/s12014-020-09291-w.
|
| [4] |
HAAS N B, MANOLA J, DUTCHER J P, FLAHERTY K T, UZZO R G, ATKINS M B, et al. Adjuvant treatment for high-risk clear cell renal cancer: updated results of a high-risk subset of the ASSURE randomized trial[J]. JAMA Oncol, 2017, 3: 1249-1252. DOI:10.1001/jamaoncol.2017.0076 |
| [5] |
CHIN A I, LAM J S, FIGLIN R A, BELLDEGRUN A S. Surveillance strategies for renal cell carcinoma patients following nephrectomy[J]. Rev Urol, 2006, 8: 1-7. |
| [6] |
LI S, SUN Y, HUANG J, WANG B, GONG Y, FANG Y, et al. Anti-tumor effects and mechanisms of Astragalus membranaceus (AM) and its specific immunopotentiation: status and prospect[J/OL]. J Ethnopharmacol, 2020, 258: 112797. DOI: 10.1016/j.jep.2020.112797.
|
| [7] |
AUYEUNG K K, HAN Q B, KO J K. Astragalus membranaceus: a review of its protection against inflammation and gastrointestinal cancers[J]. Am J Chin Med, 2016, 44: 1-22. DOI:10.1142/S0192415X16500014 |
| [8] |
AUYEUNG K K, MOK N L, WONG C M, CHO C H, KO J K. Astragalus saponins modulate mTOR and ERK signaling to promote apoptosis through the extrinsic pathway in HT-29 colon cancer cells[J]. Int J Mol Med, 2010, 26: 341-349. |
| [9] |
MINTZ M A, CYSTER J G. T follicular helper cells in germinal center B cell selection and lymphomagenesis[J]. Immunol Rev, 2020, 296: 48-61. DOI:10.1111/imr.12860 |
| [10] |
CROTTY S. T follicular helper cell differentiation, function, and roles in disease[J]. Immunity, 2014, 41: 529-542. DOI:10.1016/j.immuni.2014.10.004 |
| [11] |
PANNETON V, CHANG J, WITALIS M, LI J, SUH W K. Inducible T-cell co-stimulator: signaling mechanisms in T follicular helper cells and beyond[J]. Immunol Rev, 2019, 291: 91-103. DOI:10.1111/imr.12771 |
| [12] |
GU-TRANTIEN C, LOI S, GARAUD S, EQUETER C, LIBIN M, DE WIND A, et al. CD4+ follicular helper T cell infiltration predicts breast cancer survival[J]. J Clin Invest, 2013, 123: 2873-2892. DOI:10.1172/JCI67428 |
| [13] |
HETTA H F, ELKADY A, YAHIA R, MESHALL A K, SAAD M M, MEKKY M A, et al. T follicular helper and T follicular regulatory cells in colorectal cancer: a complex interplay[J/OL]. J Immunol Methods, 2020, 480: 112753. DOI: 10.1016/j.jim.2020.112753.
|
| [14] |
TAN Y S, LEI Y L. Isolation of tumor-infiltrating lymphocytes by ficoll-paque density gradient centrifugation[J]. Methods Mol Biol, 2019, 1960: 93-99. |
 2021, Vol. 42
2021, Vol. 42


