心肌梗死是冠状动脉急性、持续性缺血缺氧引起的心肌坏死,临床上多有剧烈而持久的胸骨后疼痛,可并发心律失常、休克或心力衰竭,常可危及生命。柚皮素(naringenin)是柚皮苷的苷元,属于二氢黄酮类化合物,主要存在于柑橘和葡萄柚中,具有抗炎、抗菌、抗氧化、抗癌等生物学效应[1-2]。Meng等[3]研究发现,柚皮素能通过激活ATP敏感性钾通道保护大鼠心脏免受缺血/再灌注损伤。Yu等[4]通过体内、体外研究发现,柚皮素可通过环磷酸鸟苷-蛋白激酶G信号通路抑制缺血/再灌注损伤心肌细胞凋亡,起到保护心肌损伤的作用。但是,柚皮素对梗死后心肌的血管再生等作用的研究目前尚未见报道,本研究以大鼠心肌细胞为研究对象,制备心肌细胞缺氧损伤模型,探究柚皮素对缺氧损伤心肌细胞的保护作用。
1 材料和方法 1.1 材料H9c2细胞(大鼠心肌细胞)来源于中国科学院上海细胞库/干细胞库;DMEM培养基购自美国HyClone公司,货号为SH30022.01B;FBS购自美国Gibco公司,货号为10270-106;CCK-8试剂盒、抗荧光衰减封片剂、Alexa Fluor® 594共轭标签抗体、羊抗兔二抗IgG、α辅肌动蛋白(α-actinin)抗体、Bcl-2抗体、Bcl-2关联X蛋白(Bcl-2-associated X protein,Bax)抗体、caspase 3抗体、GAPDH抗体均购自武汉贝茵莱生物科技有限公司,货号分别为C1706、I1722、SAB43732、SAB43714、PAB43935、PAB33482、PAB30861、PAB33236、PAB36269;膜联蛋白(annexin)Ⅴ-FITC/PI凋亡检测试剂盒购自美国BD公司,货号为556547;乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒购自南京建成生物工程研究所有限公司,货号为A020-1;SYBR® Green qRT-PCR试剂盒购自美国KAPABiosystems公司,货号为KM4101;反转录试剂盒购自日本TaKaRa公司,货号为639505;柚皮素购自美国Sigma公司,货号为N5893(粉末,纯度95%,用无水乙醇配制)。
1.2 仪器qRT-PCR仪、电泳仪、凝胶成像系统,美国Bio-Rad公司,型号分别为T100-Thermal Cycler、mini protean 3 cell、Universal HoodⅡ;倒置荧光显微镜,德国Leica公司,型号为DMIL LED;酶标仪,芬兰Ladsystems公司,型号为MK3;全自动化学发光分析仪,上海天能科技有限公司,型号为Tanon-5200;CO2恒温培养箱,美国Thermo公司,型号为311;激光共聚焦显微镜,日本Nikon公司,型号为C2;流式细胞仪,美国ACEABiosciences公司,型号为NovoCyte。
1.3 大鼠心肌细胞缺氧损伤模型的建立与实验分组将H9c2细胞先在94% N2、5% CO2、1% O2条件下培养6 h构建缺氧模型,然后在95%空气、5% CO2条件下进行复氧培养12 h。参考de Oliveira等[5]研究设计将实验分为5组。(1)对照组:细胞在常氧条件下培养;(2)模型组:细胞进行缺氧模型构建;(3)柚皮素低剂量组:细胞进行缺氧模型构建联合柚皮素20 μmol/L干预;(4)柚皮素中剂量组:细胞进行缺氧模型构建联合柚皮素40 μmol/L干预;(5)柚皮素高剂量组:细胞进行缺氧模型构建联合柚皮素80 μmol/L干预。柚皮素各剂量组细胞均缺氧培养6 h,复氧时加柚皮素培养24 h。
1.4 大鼠心肌细胞缺氧损伤模型鉴定用LDH检测试剂盒检测对照组和模型组的细胞死亡率,方法如下:设置空白对照、阳性对照孔,同时设置标准品对照孔。首先加入基质缓冲液25 μL,然后加入各组细胞上清液20 μL;加辅酶Ⅰ 5 μL,混匀,37 ℃孵育15 min;加2, 4-二硝基苯肼25 μL,混匀,37 ℃孵育15 min;加0.4 mol/L NaOH溶液250 μL,混匀,室温放置5 min,采用酶标仪测定450 nm波长处的光密度(D)值。细胞上清液LDH活性(U/L)=(测定孔D值-阳性对照D值)/(标准品D值-空白对照D值)×标准品浓度(0.2 mmol/L)×1 000。
1.5 CCK-8检测大鼠心肌细胞增殖情况收集H9c2细胞,调整细胞密度,按每孔180 µL(5×103个细胞)接种于96孔板,置于37 ℃、5% CO2培养箱中培养过夜,按照不同分组处理细胞,继续培养24 h。取出细胞培养板,向每孔加入10 μL CCK-8试剂,继续培养4 h。采用酶标仪测定450 nm波长处的D值,计算细胞增殖抑制率。
1.6 间接免疫荧光法检测大鼠心肌细胞的肥大情况将各组H9c2细胞消化成单个细胞后接种到对应的孔中,37 ℃、5% CO2培养过夜,弃培养基,用PBS洗2次,加入4%多聚甲醛溶液室温固定30 min;用PBS洗涤3次,加入0.5% Triton X-100室温通透20 min;用PBS洗涤3次,加入5%牛血清白蛋白溶液37 ℃封闭1 h;吸去培养皿中的洗涤液,加α辅肌动蛋白抗体(1∶200稀释)、Alexa Fluor® 594共轭标签抗体(1∶200稀释)4 ℃过夜;用PBS洗涤3次,加羊抗兔二抗IgG(1∶1 000稀释)37 ℃孵育1 h;用PBS洗3次,滴加抗荧光衰减封片剂(含DAPI)15~20 µL;荧光显微镜下观察。用激光共聚焦显微镜观察并拍照,然后用ImageJ软件分析细胞表面积。
1.7 流式细胞术检测大鼠心肌细胞凋亡情况将H9c2细胞转移到离心管内,400×g常温离心5 min,弃上清,收集细胞,用PBS轻轻重悬细胞并计数。取5×104~1×105个重悬的细胞,400×g 4 ℃离心5 min,弃上清;加入1 mL预冷PBS轻轻震荡使细胞悬浮,400×g 4 ℃离心5 min,弃上清;将细胞重悬于200 μL结合缓冲液;加入10 μL膜联蛋白Ⅴ-FITC和10 μL PI,轻轻混匀,4 ℃避光孵育30 min;加入300 μL结合缓冲液,随即进行流式细胞术检测。
1.8 蛋白质印迹法检测凋亡相关蛋白表达各组H9c2细胞用适量的预冷PBS洗涤后,加入含有蛋白酶和磷酸酶抑制剂的裂解液充分裂解细胞,离心后取上清液测定蛋白质浓度。用12%的分离胶、5%的浓缩胶进行SDS-PAGE,之后依次90 V转膜50 min、5%脱脂奶粉溶液室温封闭2 h,然后加入Bcl-2、Bax、caspase 3、GAPDH抗体(均为1∶1 000稀释)37 ℃孵育2 h,洗涤3次;加羊抗兔二抗IgG(1∶20 000稀释)37 ℃孵育1 h,洗涤3次。将膜放置在暗室中,取适量ECL发光液A和B等量混匀,加在膜的正面与之充分接触,然后将膜置于全自动化学发光分析仪中扫描。
1.9 qRT-PCR检测血管再生相关因子的mRNA表达水平分别提取各组H9c2细胞总RNA,反转录成cDNA,进行qRT-PCR扩增,反应体系:SYBR® Green qRT-PCR预混液10 μL,上、下游引物各0.5 μL,cDNA模板1 μL,ddH2O 8 μL,总体积20 μL。反应条件:95 ℃ 3 min,95 ℃ 5 s、56 ℃ 10 s、72 ℃ 25 s循环39次,65 ℃ 5 s,95 ℃ 50 s。以GAPDH为内参,采用2-ΔΔCt法进行分析。引物序列:血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)正义引物5'-CAACTTCTGGGCTCTT-3',反义引物5'-CCTCTCCTCTTCCTTC-3';NK2型同源异形框基因5(NK2 homeobox 5,Nkx2.5)正义引物5'-AAG-TGCTCTCCTGCTTTCCC-3',反义引物5'-CGTCT-GTCTCGGCTTTGTCC-3';α-平滑肌肌动蛋白(alpha-smooth muscle actin,α-SMA)正义引物5'-GGGAGTGATGGTTGGA-3',反义引物5'-GGCA-GGGACATTGAAG-3';GAPDH正义引物5'-CAAG-TTCAACGGCACAG-3',反义引物5'-CCAGTAGA-CTCCACGACAT-3'。
1.10 统计学处理应用SPSS 18.0软件进行统计学分析,使用GraphPad Prism 5软件绘制统计图。计量资料以x±s表示,组间比较采用单因素方差分析,多重比较采用最小显著性差异(least-significant difference,LSD)-t检验。检验水准(α)为0.05。
2 结果 2.1 大鼠心肌细胞缺氧损伤模型鉴定LDH检测试剂盒检测结果显示,模型组H9c2细胞上清液中LDH活性高于对照组[(420.3±8.40)U/L vs(104.10±3.02)U/L],差异有统计学意义(P<0.01),表明大鼠心肌细胞缺氧损伤模型构建成功。
2.2 各组H9c2细胞增殖抑制率CCK-8法检测结果(图 1)显示,与模型组相比,柚皮素各剂量组H9c2细胞的增殖抑制率均降低(P<0.05、P<0.01),柚皮素各剂量组间差异也均有统计学意义(P<0.05、P<0.01),且呈剂量依赖性。

|
图 1 CCK-8法检测柚皮素对大鼠缺氧损伤心肌细胞增殖的影响 Fig 1 Effect of naringenin on cell proliferation of rat hypoxia-injured myocardial cells detected by CCK-8 Low-dose: 20 μmol/L naringenin; Medium-dose: 40 μmol/L naringenin; High-dose: 80 μmol/L naringenin. *P < 0.05, **P < 0.01. n=3, x±s. CCK-8: Cell counting kit 8. |
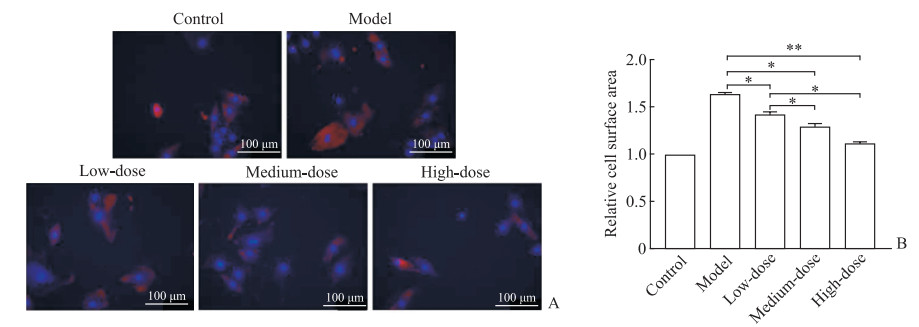
2.3 各组大鼠心肌细胞肥大状况
间接免疫荧光法检测结果(图 2)显示,和模型组相比,柚皮素各剂量组H9c2细胞表面积均减小(P<0.05、P<0.01),除柚皮素中剂量组与高剂量组差异无统计学意义外,其余剂量组之间差异均有统计学意义(P均<0.05)。表明柚皮素干预后缺氧损伤心肌细胞的肥大状况有所缓解。
|
图 2 间接免疫荧光法检测柚皮素对大鼠缺氧损伤心肌细胞肥大状况的影响 Fig 2 Effect of naringenin on cell hypertrophy of rat hypoxia-injured myocardial cells detected by indirect immunofluorescence method A: Indirect immunofluorescence images; B: Relative cell surface area. Low-dose: 20 μmol/L naringenin; Medium-dose: 40 μmol/L naringenin; High-dose: 80 μmol/L naringenin. *P < 0.05, **P < 0.01. n=3, x±s. |
2.4 各组大鼠心肌细胞凋亡水平
流式细胞术检测结果(图 3)显示,和模型组相比,柚皮素各剂量组凋亡H9c2细胞数和凋亡细胞比例有所降低,其中柚皮素中、高剂量组与模型组细胞凋亡比例比较差异均有统计学意义(P均<0.01)。

|
图 3 流式细胞术检测柚皮素对大鼠缺氧损伤心肌细胞凋亡的影响 Fig 3 Effect of naringenin on cell apoptosis of rat hypoxia-injured myocardial cells detected by flow cytometry A: The chart of flow cytometry. The upper left quadrant of each small picture shows necrosis cells, the lower left quadrant shows live cells, the upper right quadrant shows late apoptotic cells, and the lower right quadrant shows early apoptotic cells. B: Proportion of the apoptotic cells. Low-dose: 20 μmol/L naringenin; Medium-dose: 40 μmol/L naringenin; High-dose: 80 μmol/L naringenin. *P < 0.05, **P < 0.01. n=3, x±s. |
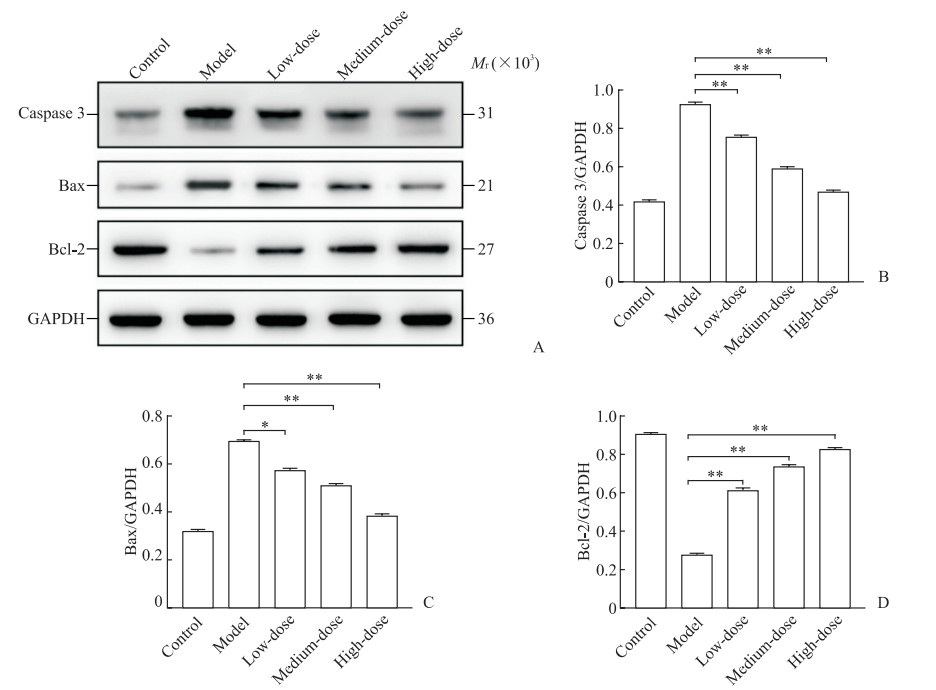
2.5 各组大鼠心肌细胞凋亡相关蛋白的表达水平
蛋白质印迹法检测结果(图 4)显示,和模型组相比,柚皮素各剂量组凋亡蛋白caspase 3、Bax表达均降低,凋亡抑制蛋白Bcl-2表达升高(P<0.05、P<0.01)。
|
图 4 蛋白质印迹法检测柚皮素对大鼠缺氧损伤心肌细胞凋亡相关蛋白表达的影响 Fig 4 Effect of naringenin on expression of apoptosis-related proteins in rat hypoxia-injured myocardial cells detected by Western blotting A: Representative Western blotting images; B: Relative expression of caspase 3; C: Relative expression of Bax; D: Relative expression of Bcl-2. Low-dose: 20 μmol/L naringenin; Medium-dose: 40 μmol/L naringenin; High-dose: 80 μmol/L naringenin. *P < 0.05, **P < 0.01. n=3, x±s. Bax: Bcl-2-associated X protein; Bcl-2: B-cell lymphoma 2; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase. |
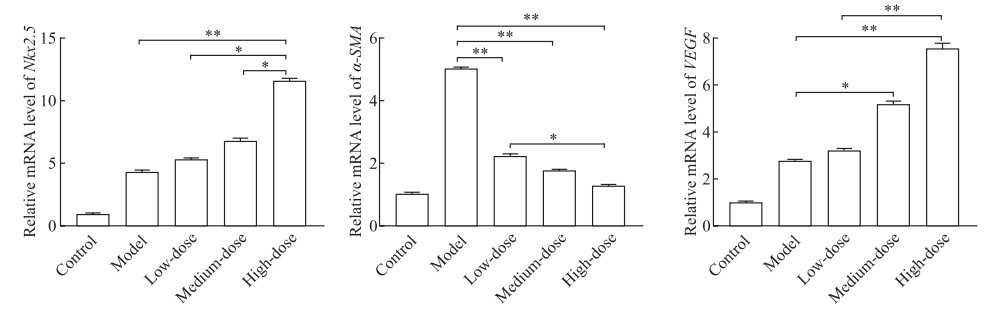
2.6 各组大鼠心肌细胞血管再生相关因子mRNA表达水平
qRT-PCR检测结果(图 5)显示,和模型组相比,柚皮素高剂量组Nkx2.5 mRNA表达水平升高(P<0.01),柚皮素中、高剂量组VEGF mRNA表达水平均升高(P<0.05、P<0.01),柚皮素各剂量组α-SMA mRNA表达水平均降低(P均<0.01);Nkx2.5 mRNA表达在柚皮素低、高剂量组之间和中、高剂量组之间差异均有统计学意义(P均<0.05),VEGF和α-SMA mRNA表达在柚皮素低、高剂量组之间差异有统计学意义(P<0.05)。
|
图 5 qRT-PCR检测柚皮素对大鼠缺氧损伤心肌细胞血管再生相关因子mRNA表达的影响 Fig 5 Effect of naringenin on mRNA expression of angiogenesis-related factors in rat hypoxia-injured myocardial cells detected by qRT-PCR Low-dose: 20 μmol/L naringenin; Medium-dose: 40 μmol/L naringenin; High-dose: 80 μmol/L naringenin. *P < 0.05, **P < 0.01. n=3, x±s. qRT-PCR: Quantitative real-time polymerase chain reaction; Nkx2.5: NK2 homeobox 5; α-SMA: Alpha-smooth muscle actin; VEGF: Vascular endothelial growth factor. |
3 讨论
心肌梗死以冠状动脉病变为基础病理,以动脉供血障碍、心输出量减少及缺血性心肌坏死为主要病理特征,是心血管常见急症。在治疗心肌梗死时需要利用手术重新开通堵塞的冠状动脉来帮助心脏恢复供氧功能[6],或者给予心肌缺血保护药物以减少心肌再灌注损伤[7]。本研究以H9c2大鼠心肌细胞制备心肌细胞缺氧损伤模型,探究柚皮素对心肌梗死后心肌细胞血管再生等的作用。LDH是一种稳定的蛋白质,存在于正常细胞的细胞质中,一旦细胞膜受损LDH即被释放到细胞外,可通过检测细胞培养上清中LDH活性判断建模是否成功[8]。
心肌细胞肥大参与诱发心肌梗死[9],本实验检测了H9c2心肌细胞的肥大状况,结果显示和模型组相比,柚皮素各剂量组H9c2细胞的相对表面积均减小,表明柚皮素能缓解大鼠缺氧损伤心肌细胞的肥大状况。
心肌细胞的增殖情况能较好地反映心肌梗死患者的预后[7, 10]。本实验CCK-8检测结果显示,和模型组相比,柚皮素各剂量组细胞的增殖抑制率降低,表明柚皮素能促进大鼠缺氧损伤心肌细胞的增殖。
心肌细胞坏死是心肌梗死的主要病理学变化,本实验通过流式细胞术检测H9c2心肌细胞的凋亡状况发现,柚皮素能有效地抑制大鼠缺氧损伤心肌细胞的凋亡,对心肌梗死有一定的缓解作用。
caspase 3为caspase家族的成员,是参与细胞凋亡的关键酶,其能通过降解细胞内底物激活细胞凋亡通路从而导致细胞凋亡[11-12]。Bcl-2家族在调节细胞死亡信号通路中起主要作用,其中Bcl-2是调节细胞凋亡的主要抑制蛋白。Bcl-2基因和蛋白质表达变化会影响细胞的凋亡水平[13-15],Bax与Bcl-2通过激活癌细胞内钙离子相关信号通路,导致程序性凋亡细胞比例上升[16]。本实验结果显示,与模型组相比,柚皮素各剂量组cacpase 3、Bax蛋白表达均降低,Bcl-2表达升高,表明柚皮素能有效抑制大鼠缺氧损伤心肌细胞的凋亡。
VEGF、Nkx2.5、α-SMA都是和心肌相关的重要细胞因子,VEGF可促进血管新生,有助于改善梗死区域的血流灌注,也能通过调节血管通透性促进内皮细胞增殖。VEGF作为一种促血管生长因子,特异性较强,可反映细胞的损伤情况[17]。Nkx2.5基因是心脏前体细胞分化的最早标志之一,也是目前研究最多的与心脏发育密切相关的转录因子之一[18-20]。α-SMA是心肌成纤维细胞分泌的一种肌动蛋白,在正常心肌组织中表达较少,而在心脏受到损伤时大量表达[21]。本实验结果显示,与模型组相比,Nkx2.5 mRNA在柚皮素高剂量组表达升高,VEGF mRNA在中、高剂量组表达升高,α-SMA mRNA在柚皮素各剂量组表达均降低,与既往研究结果[22]一致,表明柚皮素有助于缓解心肌梗死。
综上所述,柚皮素能降低大鼠缺氧损伤心肌细胞的增殖抑制、促进细胞增殖、缓解细胞肥大、抑制细胞凋亡,并能促进血管再生,或许对心肌梗死有良好的治疗作用。
| [1] |
陈彦, 辛然, 陈良慧, 贺俊杰. 柚皮素、橙皮素的大鼠在体肠吸收特性研究[J]. 中国现代应用药学, 2013, 30: 465-469. |
| [2] |
JOSHI R, KULKARNI Y A, WAIRKAR S. Pharmacokinetic, pharmacodynamic and formulations aspects of naringenin: an update[J]. Life Sci, 2018, 215: 43-56. DOI:10.1016/j.lfs.2018.10.066 |
| [3] |
MENG L M, MA H J, GUO H, KONG Q Q, ZHANG Y. The cardioprotective effect of naringenin against ischemia-reperfusion injury through activation of ATP-sensitive potassium channel in rat[J]. Can J Physiol Pharmacol, 2016, 94: 973-978. DOI:10.1139/cjpp-2016-0008 |
| [4] |
YU L M, DONG X, ZHANG J, LI Z, XUE X D, WU H J, et al. Naringenin attenuates myocardial ischemia-reperfusion injury via cGMP-PKGIα signaling and in vivo and in vitro studies[J/OL]. Oxid Med Cell Longev, 2019, 2019: 7670854. DOI: 10.1155/2019/7670854.
|
| [5] |
DE OLIVEIRA M R, BRASIL F B, ANDRADE C M B. Naringenin attenuates H2O2-induced mitochondrial dysfunction by an Nrf2-dependent mechanism in SH-SY5Y cells[J]. Neurochem Res, 2017, 42: 3341-3350. DOI:10.1007/s11064-017-2376-8 |
| [6] |
IBANEZ B, JAMES S, AGEWALL S, ANTUNES M J, BUCCIARELLI-DUCCI C, BUENO H, et al. 2017 ESC guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: the task force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC)[J]. Eur Heart J, 2018, 39: 119-177. DOI:10.1093/eurheartj/ehx393 |
| [7] |
孙冰, 王海昌, 孙冬冬. 急性ST段抬高型心肌梗死溶栓治疗的最新进展[J]. 心脏杂志, 2020, 32: 93-98. |
| [8] |
LIU J, SUI H, ZHAO J, WANG Y. Osmotin protects H9c2 cells from simulated ischemia-reperfusion injury through AdipoR1/PI3K/AKT signaling pathway[J/OL]. Front Physiol, 2017, 8: 611. DOI: 10.3389/fphys.2017.00611.
|
| [9] |
WU X, YOU W, WU Z, YE F, CHEN S. Ivabradine promotes angiogenesis and reduces cardiac hypertrophy in mice with myocardial infarction[J]. Anatol J Cardiol, 2018, 20: 266-272. |
| [10] |
RAI V, SHARMA P, AGRAWAL S, AGRAWAL D K. Relevance of mouse models of cardiac fibrosis and hypertrophy in cardiac research[J]. Mol Cell Biochem, 2017, 424(1/2): 123-145. |
| [11] |
PRADEEP A R, SUKE D K, PRASAD M V, SINGH S P, MARTANDE S S, NAGPAL K, et al. Expression of key executioner of apoptosis caspase-3 in periodontal health and disease[J]. J Investig Clin Dent, 2016, 7: 174-179. DOI:10.1111/jicd.12134 |
| [12] |
刘春华, 刘捷. 神经元凋亡与Caspase家族及细胞周期研究进展[J]. 人民军医, 2018(7): 641-644. |
| [13] |
FU F, LI Y, LI R, LEI T Y, WANG D, YANG X, et al. NDUFA4 enhances neuron growth by triggering growth factors and inhibiting neuron apoptosis through Bcl-2 and cytochrome C mediated signaling path-way[J]. Am J Transl Res, 2018, 10: 164-172. |
| [14] |
ZHENG J H, VIACAVA FOLLIS A, KRIWACKI R W, MOLDOVEANU T. Discoveries and controversies in BCL-2 protein-mediated apoptosis[J]. FEBS J, 2016, 283: 2690-2700. DOI:10.1111/febs.13527 |
| [15] |
CHENG C Y, TANG N Y, KAO S T, HSIEH C. Ferulic acid administered at various time points protects against cerebral infarction by activating p38 MAPK/p90RSK/ CREB/Bcl-2 anti-apoptotic signaling in the subacute phase of cerebral ischemia-reperfusion injury in rats[J/OL]. PLoS One, 2016, 11: e0155748. DOI: 10.1371/journal.pone.0155748.
|
| [16] |
HU J, ZHANG Y, JIANG X, ZHANG H, GAO Z, LI Y, et al. ROS-mediated activation and mitochondrial translocation of CaMKⅡ contributes to Drp1-dependent mitochondrial fission and apoptosis in triple-negative breast cancer cells by isorhamnetin and chloroquine[J/OL]. J Exp Clin Cancer Res, 2019, 38: 225. DOI: 10.1186/s13046-019-1201-4.
|
| [17] |
YANG Z, WAN J, PAN W, ZOU J. Expression of vascular endothelial growth factor in cardiac repair: signaling mechanisms mediating vascular protective effects[J]. Int J Biol Macromol, 2018, 113: 179-185. DOI:10.1016/j.ijbiomac.2018.02.111 |
| [18] |
SCHOTT J J, BENSON D W, BASSON C T, PEASE W, SILBERBACH G M, MOAK J P, et al. Congenital heart disease caused by mutations in the transcription factor NKX2-5[J]. Science, 1998, 281: 108-111. DOI:10.1126/science.281.5373.108 |
| [19] |
MALAKAR A K, HALDER B, PAUL P, DEKA H, CHAKRABORTY S. Genetic evolution and codon usage analysis of NKX-2.5 gene governing heart development in some mammals[J]. Genomics, 2020, 112: 1319-1329. DOI:10.1016/j.ygeno.2019.07.023 |
| [20] |
GENEAD R, FISCHER H, HUSSAIN A, JAKSCH M, ANDERSSON A B, LJUNG K, et al. Ischemia-reperfusion injury and pregnancy initiate time-dependent and robust signs of up-regulation of cardiac progenitor cells[J/OL]. PLoS One, 2012, 7: e36804. DOI: 10.1371/journal.pone.0036804.
|
| [21] |
何砚如. DNA甲基化在心脏成纤维细胞分化过程中调控α平滑肌肌动蛋白表达的机制研究[D]. 南京: 东南大学, 2019.
|
| [22] |
王欣, 李磊, 陈元友, 吴潇. 柚皮素对心肌梗死大鼠血管新生的促进作用及机制研究[J]. 新医学, 2020, 51: 915-921. DOI:10.3969/j.issn.0253-9802.2020.12.006 |
 2021, Vol. 42
2021, Vol. 42


