2. 海军军医大学(第二军医大学)基础医学院学员四大队, 上海 200433;
3. 海军军医大学(第二军医大学)基础医学院学员一大队, 上海 200433
2. The Fourth Student Team, College of Basic Medical Sciences, Naval Medical University(Second Military Medical University), Shanghai 200433, China;
3. The First Student Team, College of Basic Medical Sciences, Naval Medical University(Second Military Medical University), Shanghai 200433, China
近年研究显示,神经束膜细胞除了形成血-神经屏障,还对周围神经损伤的修复起着重要作用,如在受损区域形成神经束膜桥、吞噬细胞碎片、与施万细胞发生相互作用等[1]。在周围神经受损后,神经束膜细胞的启动早于施万细胞,率先向受损处迁移并吞噬细胞碎片,形成细胞桥以桥接神经缺损处;而施万细胞的迁移和轴突的再生则在此之后发生[2-3]。因此,神经束膜细胞可能在多细胞动员修复长距离周围神经损伤的过程中发挥关键作用。但神经束膜细胞增殖缓慢、迁移能力较弱,提高其增殖和迁移能力、加速神经束膜桥的形成有望为周围神经损伤修复提供新思路。然而,目前对于神经束膜细胞的培养仍然没有十分理想的方案,使得神经束膜细胞参与神经再生的机制研究受到较大限制。
毛囊神经嵴干细胞(hair follicle neural crest stem cell,hfNCSC)源自神经嵴,位于毛囊隆突部。由于hfNCSC像神经干细胞一样特异性表达神经上皮干细胞蛋白(巢蛋白),可分化为神经元、施万细胞及其他多种类型的细胞,亦有学者称之为毛囊相关多能干细胞(hair follicle-associated-pluripotent stem cell,HAP干细胞)[4-6]。研究发现hfNCSC可促进损伤的坐骨神经再生[6-7],将其移植至脊髓损伤处可促进小鼠的脊髓功能恢复[8-10],hfNCSC还可分化为运动神经元以减缓肌肉萎缩[11]。目前对于hfNCSC可促进神经损伤修复已形成共识,但其是否可激活神经束膜细胞仍未知。本研究采用“限时消化-差速贴壁-化学药物”方法培养获得了高纯度的神经束膜细胞,并通过建立hfNCSC和神经束膜细胞的共培养体系探索hfNCSC对神经束膜细胞的激活作用,以期为提高神经束膜细胞的增殖和迁移能力及加速神经束膜桥的形成提供实验依据。
1 材料和方法 1.1 神经束膜细胞的培养、纯化及鉴定 1.1.1 原代培养雄性SD大鼠(4周龄,体重约100 g)2只,购自上海吉辉实验动物饲养有限公司[实验动物生产许可证号:SCXK(沪)2017-0012]。大鼠经戊巴比妥(40 mg/kg)腹腔注射麻醉后,分离获取坐骨神经,在体视显微镜下仔细剥离神经外膜,剖开坐骨神经段,剔除内部神经纤维,获取神经束膜。将神经束膜贴块于鼠尾胶原(美国Corning公司)包被的12孔培养板内,置于孵箱(37 ℃,95% CO2、5% O2)贴附1 h后,每孔添加200 μL神经束膜培养基。3 d后每孔补加200 μL神经束膜培养基,此后每3 d更换半液。神经束膜细胞培养基配制:DMEM/F-12(美国Corning公司)、10% FBS(美国Gibco公司)、2 μmol/L毛喉素(美国Sigma公司)、12.5 ng/mL调节蛋白β1(美国Peprotech公司)、1% 青霉素/链霉素(美国Corning公司)。
1.1.2 细胞纯化及传代培养神经束膜贴块培养10 d后获得混合细胞(神经束膜细胞、施万细胞及成纤维细胞)。去除组织块,首先采用限时消化法,用0.25%胰酶消化10 s,轻晃培养板去除施万细胞,弃培养基,将剩余细胞用0.25%胰酶消化2~3 min,离心后重悬细胞。接着采用差速贴壁法,将细胞悬液转移至T75培养瓶内培养30 min使成纤维细胞贴壁后,再将细胞悬液转移至新的T75培养瓶内培养。3 d后重复上述步骤。最后采用化学药物处理,将所得细胞重新接种24 h后,以阿糖胞苷(100 μmol/L,美国Sigma公司)处理24 h,获得纯度较高的神经束膜细胞。每3 d更换半液。
1.1.3 免疫细胞化学染色鉴定将细胞爬片用4%多聚甲醛溶液室温固定30 min,常规Triton X-100处理和血清封闭后,加入一抗稀释液4 ℃孵育过夜。一抗包括标记神经束膜细胞的抗密封蛋白1兔多克隆抗体(1∶80稀释,美国Sigma公司)、标记成纤维细胞的抗波形蛋白兔单克隆抗体(1∶200稀释,美国CST公司)、标记施万细胞的抗S100β兔单克隆抗体(1∶200稀释,英国Abcam公司)。第2天取出细胞爬片,用PBS重复清洗,加入FITC偶联山羊抗兔IgG二抗(1∶1 000稀释,美国CST公司)室温避光孵育1 h。然后用DAPI(1∶200,武汉谷歌生物科技有限公司)室温染核5 min,封片后置于荧光显微镜(德国Leica Microsystems GmbH公司)下拍照并记录结果。每孔随机取5个视野计算阳性率。
1.2 hfNCSC的培养及鉴定 1.2.1 细胞培养雄性SD大鼠(3周龄,体重50~60 g)2只,购自上海吉辉实验动物饲养有限公司。大鼠经戊巴比妥(40 mg/kg)腹腔注射麻醉后,取触须垫,用75%乙醇消毒,在体视显微镜下解剖获得毛囊隆突。将毛囊隆突用PBS清洗3次,贴附于鼠尾胶原(美国Corning公司)包被的12孔培养板内,置于孵箱(37 ℃,95% CO2、5% O2)静置30 min后,每孔添加200 μL hfNCSC培养基。3 d后每孔补加200 μL hfNCSC培养基,此后每3 d更换半液。hfNCSC培养基配制:DMEM/F-12、5% FBS、1% N2(美国Invitrogen公司)、2% B27(美国Invitrogen公司)、200 mmol/L L-谷氨酰胺(美国Corning公司)、0.25%胰岛素-转铁蛋白-亚硒酸钠(insulin, transferrin, selenium,ITS)溶液(美国Corning公司)、20 ng/mL表皮生长因子(上海普飞生物技术有限公司)、20 ng/mL碱性成纤维细胞生长因子(上海普飞生物技术有限公司)、1%青霉素/链霉素(美国Corning公司)。传代培养时将hfNCSC培养基内的FBS浓度降至2%。当细胞生长至80%~90%融合时,以1︰2的比例传代培养。用倒置显微镜观察细胞的生长状态。取第2~3代的hfNCSC作为工作细胞。
1.2.2 细胞鉴定将细胞爬片用4%多聚甲醛溶液室温固定30 min,进行常规Triton X-100透膜处理和血清封闭,加入一抗稀释液4 ℃孵育过夜。一抗包括标记hfNCSC的抗巢蛋白小鼠单克隆抗体(1∶200稀释,英国Abcam公司)、标记施万细胞的抗S100β兔单克隆抗体(1∶200稀释,英国Abcam公司)、标记神经元的抗微管蛋白小鼠单克隆抗体(1∶200稀释,美国Millipore公司)。第2天取出细胞爬片,用PBS充分洗涤后,加入FITC偶联山羊抗兔IgG二抗(1∶1 000稀释,美国CST公司)和山羊抗小鼠IgG二抗(1∶1 000稀释,美国CST公司)室温避光孵育1 h。用DAPI在室温下染核5 min,封片后置于荧光显微镜(德国Leica Microsystems GmbH公司)下拍照并记录结果。
1.3 神经束膜细胞与hfNCSC的共培养及细胞迁移观测神经束膜细胞以无血清DMEM培养基饥饿预处理24 h。将神经束膜细胞(1.5×104个,悬于0.2 mL DMEM培养基)接种于24孔Transwell上室(滤膜孔径为8 μm,美国Corning公司),hfNCSC(105个,悬于0.8 mL含5% FBS的DMEM培养基)接种于下室;对照组上室接种神经束膜细胞、下室不接种细胞(仅有含5% FBS的DMEM培养基)。共培养6、12和18 h后,取出Transwell小室,擦除滤膜上面的细胞,将滤膜下面的细胞以4%多聚甲醛溶液室温固定30 min,加入结晶紫染色5 min。在显微镜(德国Leica Microsystems GmbH公司)下观察,每孔随机取5个视野拍照并记录结果。以每组所有照片中细胞数的平均值作为每组细胞的迁移数。
1.4 神经束膜细胞CCK-8增殖实验用含2% FBS的DMEM培养基培养hfNCSC,2 d后除去细胞,获得hfNCSC条件培养基。将神经束膜细胞接种于96孔板(3 000个/孔),加入hfNCSC条件培养基处理24、48和72 h;对照组神经束膜细胞以含2% FBS的DMEM培养基处理。使用CCK-8试剂盒(日本Dojindo公司)检测神经束膜细胞的增殖情况,将细胞用CCK-8工作液(DMEM培养基与CCK-8溶液的比例为9∶1)在37 ℃、5% CO2的条件下避光孵育1 h,以不加细胞的CCK-8工作液作为空白对照,使用酶标仪检测450 nm波长处不同处理组的平均光密度(D)值,计算细胞活力。细胞活力(%)=(D处理组-D空白组)/(D对照组-D空白组)×100%。
1.5 统计学处理所有实验每组至少设3个重复,每次实验至少重复3次。采用GraphPad Prism 8.0软件进行统计学分析。数据以x±s表示,两组间比较采用独立样本t检验。所有的统计检验均为双侧检验,检验水准(α)为0.05。
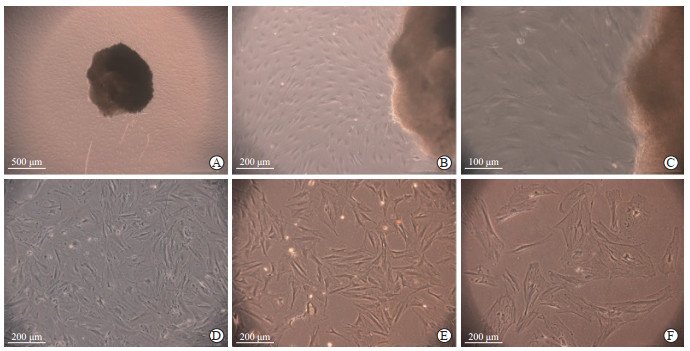
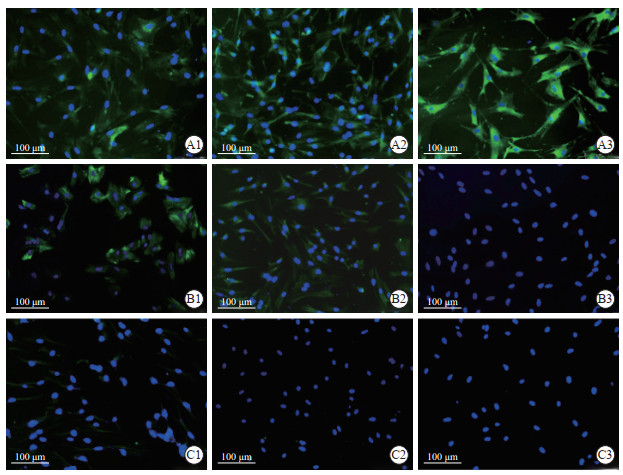
2 结果 2.1 神经束膜细胞的培养、纯化及鉴定在原代培养的过程中,大鼠神经束膜细胞于第4~6天时迁出,第10天时可进行传代培养。神经束膜细胞大而扁平、增殖缓慢。成纤维细胞形态不规则,呈多角形、梭形和扁平星形等,增殖迅速。施万细胞形态较小,大多呈双极梭形,有2个细长突起,少数呈多个细胞突起。原代及未纯化的传代培养中,3种细胞混合存在(图 1A~1D)。免疫细胞化学染色结果显示,未经纯化的传代培养细胞中,密封蛋白1(神经束膜细胞标志物)阳性率为(42.33±3.05)%,波形蛋白(成纤维细胞标志物)阳性率为(50.33±2.08)%,S100(施万细胞标志物)阳性率为(15.00±2.64)%(图 2A1、2B1、2C1)。
|
图 1 倒置显微镜下观察神经束膜细胞的原代及纯化培养 Fig 1 Primary culture and purification of perineurial cells under an inverted microscope A-C: Primary culture of perineurial cells; D: Perineurial cells without purification; E: Perineurial cells purified with limited digestion and differential adherence; F: Perineurial cells purified with chemical drug after limited digestion and differential adherence. |
|
图 2 免疫细胞化学染色鉴定纯化过程中的神经束膜细胞 Fig 2 Perineurial cells during purification by immunocytochemistry staining A-C: Immunofluorescence staining of claudin 1, vimentin, and S100; 1-3: Perineurial cells without purification, cells purified with limited digestion and differential adherence, and cells purified with chemical drug after limited digestion and differential adherence. |
经“限时消化-差速贴壁”纯化后,施万细胞被去除,而成纤维细胞仍然存在(图 1E)。免疫细胞化学染色结果显示,密封蛋白1的阳性率增加至(65.00±6.00)%,波形蛋白阳性率降至(37.66±2.08)%,而几乎无细胞表达S100(图 2A2、2B2、2C2)。由此可见,经“限时消化-差速贴壁”纯化后,虽然尚存在一些成纤维细胞,但神经束膜细胞的纯度得到了较大提升。
以此为基础,应用化学药物阿糖胞苷(100 μmol/L)处理后,成纤维细胞数量显著下降,神经束膜细胞的纯度得到进一步提升,且细胞生长状态较好(图 1F)。免疫细胞化学染色结果显示,波形蛋白阳性率为(5.66±1.52)%,密封蛋白1阳性率为(97.66±2.08)%,几乎无细胞表达S100(图 2A3、2B3、2C3)。上述结果表明,采用“限时消化-差速贴壁-化学药物”方法能够获得纯度较高的神经束膜细胞。
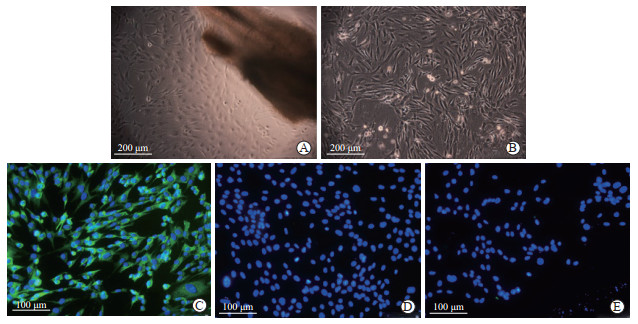
2.2 hfNCSC的培养及鉴定原代培养的第4天,hfNCSC从毛囊的隆突部迁出(图 3A);原代培养第7天时,80%~90%融合的细胞按1︰2的比例进行传代培养(图 3B),每4~5 d对hfNCSC进行传代培养。免疫细胞化学染色结果显示,细胞中巢蛋白阳性率超过96%,而S100和微管蛋白阳性率几乎为0,提示获得的细胞大部分为未分化的巢蛋白阳性的hfNCSC(图 3C~3E)。
|
图 3 hfNCSC的培养和免疫细胞化学染色鉴定 Fig 3 Culture and immunocytochemistry staining of hfNCSCs A: Primary culture of hfNCSCs; B: Subculture of hfNCSCs; C-E: Immunocytochemistry showing that 96% cells were positive for nestin (C), while S100 (D) and tubulin (E) were almost negative. hfNCSC: Hair follicle neural crest stem cell. |
2.3 hfNCSC促进神经束膜细胞的迁移
由图 4可见,hfNCSC与神经束膜细胞共培养6、12和18 h后,对照组有少量的神经束膜细胞发生迁移,hfNCSC共培养组神经束膜细胞的迁移数明显增加,与对照组比较差异均有统计学意义(P<0.05,P<0.01)。在不同时间点,hfNCSC共培养组的神经束膜细胞迁移数差异无统计学意义(P>0.05)。上述结果说明hfNCSC可以促进神经束膜细胞的迁移。

|
图 4 共培养体系中hfNCSC对神经束膜细胞迁移的影响 Fig 4 Effect of hfNCSCs on migration of perineurial cells in co-culture system A, C, E: Control group at 6, 12, and 18 h, respectively; B, D, F: Co-culture with hfNCSCs group at 6, 12, and 18 h, respectively; G: Statistical analysis of the migrating cells in Transwell co-cultures of perineurial cells and hfNCSCs. *P < 0.05, **P < 0.01. n=3, x±s. hfNCSC: Hair follicle neural crest stem cell. |
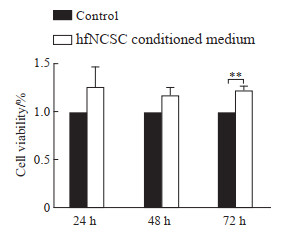
2.4 hfNCSC条件培养基促进神经束膜细胞的增殖
由图 5可见,使用hfNCSC条件培养基作用于神经束膜细胞24 h和48 h后,神经束膜细胞的细胞活力增加,与对照组比较差异无统计学意义(P>0.05);使用hfNCSC条件培养基作用于神经束膜细胞72 h后,神经束膜细胞的细胞活力与对照组比较差异有统计学意义(P<0.01)。上述结果表明,hfNCSC条件培养基可促进神经束膜细胞的增殖。
|
图 5 hfNCSC条件培养基对神经束膜细胞增殖的影响 Fig 5 Effect of hfNCSCs conditioned medium on proliferation of perineurial cells **P < 0.01. n=3, x±s. hfNCSC: Hair follicle neural crest stem cell. |
3 讨论
近年来已有较多文献肯定了神经束膜细胞对周围神经损伤修复的重要作用[1-3],但神经束膜细胞的体外培养和纯化仍是难题。目前关于神经束膜细胞的培养研究国内仍处于空白,国外也少有报道。Peltonen等[12]仅采用含10% FBS的DMEM培养基对坐骨神经段进行1~10次的反复贴块培养,90%以上的组织块内迁出的是成纤维细胞、施万细胞与神经束膜细胞的混合细胞,而仅有1%~5%的组织块内迁出较纯的神经束膜细胞。本研究创新性地采用“限时消化-差速贴壁-化学药物”方案对神经束膜细胞进行培养和纯化,经过限时消化及差速贴壁处理后,再添加化学药物即100 μmol/L的阿糖胞苷,可以消除近95%的成纤维细胞和几乎所有的施万细胞,得到生长状态良好、纯度高的神经束膜细胞。此外,为减少成纤维细胞和施万细胞的污染,本研究在取材时仔细剔除神经外膜和神经纤维,获得较纯的神经束膜组织块,并在培养液中添加2 μmol/L毛喉素和12.5 ng/mL调节蛋白β1以促进神经束膜细胞的迁出和增殖,这些举措均有利于获得更高纯度的神经束膜细胞。本方案可以在2周的时间内获得纯度高达(97.66±2.08)%的神经束膜细胞。与国外既往报道[12]相比,本研究方法更为简便,可获得更高纯度的神经束膜细胞,且缩短了培养和纯化周期,为研究周围神经损伤再生的机制提供稳定的细胞来源。
hfNCSC可来于自体,且容易获取,产量丰富,不存在免疫原性及伦理问题。目前研究已证实其对神经损伤修复有重要的促进作用,具有较好的临床应用前景。干细胞对周围神经损伤修复的作用主要体现在3个方面:(1)分化为类施万细胞发挥作用[13-15];(2)通过旁分泌作用缓解炎症反应或营养神经,为周围神经再生创造良好的微环境[16-17];(3)促进轴突再生及髓鞘形成[18-19]。干细胞是否可通过激活神经束膜细胞加速神经束膜桥的形成以促进神经再生尚不明确。本研究通过应用Transwell共培养体系及hfNCSC条件培养基,发现hfNCSC可以促进神经束膜细胞的迁移和增殖,推测hfNCSC很可能是通过旁分泌对神经束膜细胞发挥作用,其作用机制尚待深入研究。
| [1] |
KUCENAS S. Perineurial glia[J/OL]. Cold Spring Harb Perspect Biol, 2015, 7: a020511. DOI: 10.1101/cshperspect.a020511.
|
| [2] |
SCHRÖDER J M, MAY R, WEIS J. Perineurial cells are the first to traverse gaps of peripheral nerves in silicone tubes[J]. Clin Neurol Neurosurg, 1993, 95: S78-S83. DOI:10.1016/0303-8467(93)90040-N |
| [3] |
LEWIS G M, KUCENAS S. Perineurial glia are essential for motor axon regrowth following nerve injury[J]. J Neurosci, 2014, 34: 12762-12777. DOI:10.1523/JNEUROSCI.1906-14.2014 |
| [4] |
LI L, MIGNONE J, YANG M, MATIC M, PENMAN S, ENIKOLOPOV G, et al. Nestin expression in hair follicle sheath progenitor cells[J]. Proc Natl Acad Sci USA, 2003, 100: 9958-9961. DOI:10.1073/pnas.1733025100 |
| [5] |
AMOH Y, LI L, KATSUOKA K, PENMAN S, HOFFMAN R M. Multipotent nestin-positive, keratin-negative hair-follicle bulge stem cells can form neurons[J]. Proc Natl Acad Sci USA, 2005, 102: 5530-5534. DOI:10.1073/pnas.0501263102 |
| [6] |
AMOH Y, HOFFMAN R M. Hair follicle-associated-pluripotent (HAP) stem cells[J]. Cell Cycle, 2017, 16: 2169-2175. DOI:10.1080/15384101.2017.1356513 |
| [7] |
AMOH Y, AKI R, HAMADA Y, NⅡYAMA S, ESHIMA K, KAWAHARA K, et al. Nestin-positive hair follicle pluripotent stem cells can promote regeneration of impinged peripheral nerve injury[J]. J Dermatol, 2012, 39: 33-38. DOI:10.1111/j.1346-8138.2011.01413.x |
| [8] |
OBARA K, TOHGI N, SHIRAI K, MⅡ S, HAMADA Y, ARAKAWA N, et al. Hair-follicle-associated pluripotent (HAP) stem cells encapsulated on polyvinylidene fluoride membranes (PFM) promote functional recovery from spinal cord injury[J]. Stem Cell Rev Rep, 2019, 15: 59-66. DOI:10.1007/s12015-018-9856-3 |
| [9] |
AMOH Y, LI L N, KATSUOKA K, HOFFMAN R M. Multipotent hair follicle stem cells promote repair of spinal cord injury and recovery of walking function[J]. Cell Cycle, 2008, 7: 1865-1869. DOI:10.4161/cc.7.12.6056 |
| [10] |
LIU F, UCHUGONOVA A, KIMURA H, ZHANG C S, ZHAO M, ZHANG L, et al. The bulge area is the major hair follicle source of nestin-expressing pluripotent stem cells which can repair the spinal cord compared to the dermal papilla[J]. Cell Cycle, 2011, 10: 830-839. DOI:10.4161/cc.10.5.14969 |
| [11] |
LIU F, ZHANG C S, HOFFMAN R M. Nestin-expressing stem cells from the hair follicle can differentiate into motor neurons and reduce muscle atrophy after transplantation to injured nerves[J]. Tissue Eng Part A, 2014, 20(3/4): 656-662. |
| [12] |
PELTONEN J, JAAKKOLA S, VIRTANEN I, PELLINIEMI L. Perineural cells in culture. An immunocytochemical and electron microscopic study[J]. Lab Investig, 1987, 57: 480-488. |
| [13] |
CUI L, JIANG J, WEI L, ZHOU X, FRASER J L, SNIDER B J, et al. Transplantation of embryonic stem cells improves nerve repair and functional recovery after severe sciatic nerve axotomy in rats[J]. Stem Cells, 2008, 26: 1356-1365. DOI:10.1634/stemcells.2007-0333 |
| [14] |
ZIEGLER L, GRIGORYAN S, YANG I H, THAKOR N V, GOLDSTEIN R S. Efficient generation of Schwann cells from human embryonic stem cell-derived neurospheres[J]. Stem Cell Rev Rep, 2011, 7: 394-403. DOI:10.1007/s12015-010-9198-2 |
| [15] |
NIJHUIS T H, BODAR C W, VAN NECK J W, WALBEEHM E T, SIEMIONOW M, MADAJKA M, et al. Natural conduits for bridging a 15-mm nerve defect: comparison of the vein supported by muscle and bone marrow stromal cells with a nerve autograft[J]. J Plast Reconstr Aesthet Surg, 2013, 66: 251-259. DOI:10.1016/j.bjps.2012.09.011 |
| [16] |
SOWA Y, IMURA T, NUMAJIRI T, NISHINO K, FUSHIKI S. Adipose-derived stem cells produce factors enhancing peripheral nerve regeneration: influence of age and anatomic site of origin[J]. Stem Cells Dev, 2012, 21: 1852-1862. DOI:10.1089/scd.2011.0403 |
| [17] |
REID A J, SUN M, WIBERG M, DOWNES S, TERENGHI G, KINGHAM P J. Nerve repair with adipose-derived stem cells protects dorsal root ganglia neurons from apoptosis[J]. Neuroscience, 2011, 199: 515-522. DOI:10.1016/j.neuroscience.2011.09.064 |
| [18] |
XU Y F, LIU L, LI Y, ZHOU C, XIONG F, LIU Z S, et al. Myelin-forming ability of Schwann cell-like cells induced from rat adipose-derived stem cells in vitro[J]. Brain Res, 2008, 1239: 49-55. DOI:10.1016/j.brainres.2008.08.088 |
| [19] |
WANG X M, LUO E, LI Y F, HU J. Schwann-like mesenchymal stem cells within vein graft facilitate facial nerve regeneration and remyelination[J]. Brain Res, 2011, 1383: 71-80. DOI:10.1016/j.brainres.2011.01.098 |
 2021, Vol. 42
2021, Vol. 42


