尿道狭窄的治疗是泌尿外科手术的难点之一,对于前尿道狭窄患者,尤其是较长段的前尿道狭窄者,由于组织缺损较多和修复材料相对缺乏,导致治疗较为棘手。随着技术的发展,众多自体移植物如带蒂阴茎皮瓣或阴囊皮瓣、膀胱黏膜、口腔黏膜和直肠黏膜等相继成为手术中的应用材料[1-4]。口腔黏膜移植物和带蒂阴茎皮瓣因其固有的特点,在尿道重建手术中获得广泛应用。2012年8月至2018年5月,我科采用口腔黏膜移植物或带蒂阴茎皮瓣修复治疗的33例前尿道狭窄患者临床疗效满意,现报告如下。
1 资料和方法 1.1 资料来源回顾性分析2012年8月至2018年5月我科收治的因各种原因引起的复杂性男性前尿道狭窄行口腔黏膜移植物或带蒂阴茎皮瓣修复治疗的33例患者资料。纳入标准:(1)各种原因导致的前尿道狭窄,包括尿道狭窄或尿道闭锁;(2)能够耐受手术。排除标准:(1)合并存在尿道瘘,如尿道直肠瘘等;(2)合并存在后尿道狭窄;(3)膀胱颈挛缩或尿失禁,严重尿路感染不能控制;(4)合并高血糖、高血压等基础疾病。本研究通过海军军医大学(第二军医大学)长海医院伦理委员会审批。
1.2 治疗方法对于阴茎包皮组织预估不足、多段尿道狭窄或有尿道手术史的患者采用口腔黏膜移植物尿道成形术,对于阴茎包皮组织预估足够且无尿道手术史者采用带蒂阴茎皮瓣尿道成形术。对于口腔黏膜组织的选择,我科一般首选下唇黏膜,其暴露和取材方便,在下唇黏膜组织不足的情况下可考虑联合舌黏膜行尿道重建。
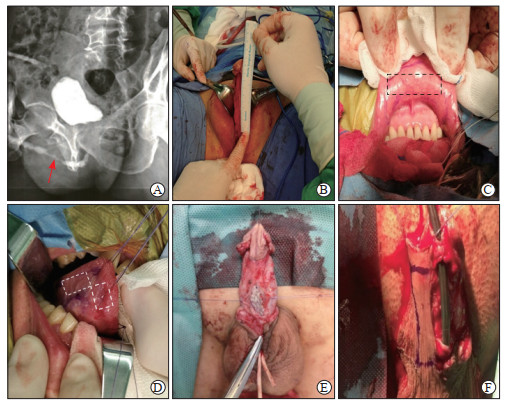
1.2.1 口腔黏膜移植物尿道成形术手术方法鼻导管插管麻醉成功后,患者取平卧位或截石位。依据术前尿道造影确定尿道狭窄部位(图 1A),根据尿道狭窄部位选取经阴茎、阴囊或会阴部切口,逐层切开皮下组织,暴露尿道海绵体;切开狭窄段尿道,并测量尿道狭窄或缺损长度(图 1B)。口腔黏膜裁取:牵开口腔,用洗必泰行口腔消毒,暴露下唇黏膜(图 1C),如取舌黏膜则需用3-0线在舌前部行贯穿缝合进行牵引(图 1D)。根据手术需要用无菌记号笔标注切口,将混有肾上腺素的生理盐水(1 mg/mL肾上腺素与生理盐水按1∶100体积比混合)注射至黏膜下,沿标记线切至黏膜下层,沿黏膜下层分离;切取黏膜,用剪刀修剪,并剥除脂肪及纤维组织,制成黏膜条置于生理盐水中备用。若单一种类口腔黏膜相对不足,则取下唇黏膜及舌黏膜进行缝合拼接。舌黏膜采用5-0可吸收线缝合。下唇黏膜不缝合,用数块明胶海绵加压止血。切开狭窄段尿道背侧壁,完全切除瘢痕组织直至暴露阴茎海绵体白膜,并向两侧适当游离以保证裁取的口腔黏膜可平整铺展于阴茎海绵体白膜表面,用6-0可吸收缝线将口腔黏膜与上下侧正常尿道黏膜吻合,并多点固定于海绵体表面,重建尿道板完整性(图 1E)。留置支撑管(根据尿道周径选择14~18 F导尿管),缝合尿道腹侧壁。术后阴茎段用弹力绷带包扎,阴囊及会阴部切口适当加压包扎2~3 d,术后2~4周拔除导尿管,观察排尿情况。
|
图 1 口腔黏膜移植物尿道成形术及带蒂阴茎皮瓣尿道成形术手术过程 Fig 1 Oral mucosa graft urethroplasty and penile skin flap urethroplasty A: Preoperative urethral angiography showed complicated anterior urethral stricture (red arrow indicates the urethral stricture); B: Measurement of the urethral stricture length; C: Excision range of lower lip mucosa graft tissue (shown by the black dotted box); D: Excision range of tongue mucosa graft tissue (shown by the white dashed box); E: Oral mucosa covered the dorsal side defect urethra; F: Penile flap covered the ventral urethra. |
1.2.2 带蒂阴茎皮瓣尿道成形术手术方法
鼻导管插管麻醉成功后患者取平卧位,根据术前尿道造影确定尿道狭窄位置并于相应部位取一纵向切口,逐层切开皮下组织以暴露尿道,于狭窄段尿道海绵体腹侧纵向切开,明确狭窄段长度,切除尿道瘢痕组织,游离阴茎腹侧肉膜血供良好的包皮。在游离阴茎皮瓣时,注意保留深筋膜组织,以保证带蒂皮瓣的血供。留置支撑管(根据尿道周径选择14~18 F导尿管),翻转带蒂皮瓣,覆盖尿道缺损处,用5-0可吸收线将皮瓣与上下端尿道黏膜缝合(图 1F)。分离阴囊鞘膜组织或部分肉膜组织覆盖尿道吻合处,防止渗漏。其余术后处理同口腔黏膜移植物尿道成形术。
1.3 研究方法收集患者术前基本信息、自由尿流率及术后复查、随访资料。对比分析术前及术后1年患者最大自由尿流率、国际勃起功能指数问卷表5(international index of erectile function 5,IIEF-5)评分的差异及术后随访期并发症发生情况,以判断口腔黏膜移植物及带蒂阴茎皮瓣替代尿道组织修复前尿道狭窄的疗效。
1.4 统计学处理应用SPSS 25.0软件进行统计学分析。呈正态分布的计量资料以x±s表示,两组间比较采用独立样本t检验;呈偏态分布的计量资料以中位数(范围)表示,两组间比较采用独立样本的Wilcoxon秩和检验,组内术前和术后资料的比较采用Wilcoxon符号秩检验;计数资料以例数和百分数表示,两组间比较采用Fisher确切概率法。检验水准(α)为0.05。
2 结果 2.1 两组患者基本资料33例患者年龄为12~80岁,平均年龄为(43.5±19.3)岁。口腔黏膜移植物尿道成形术组有23例患者,平均年龄为(43.8±19.4)岁,病程为1.0~600.0个月,尿道狭窄长度为3.0~12.0 cm;6例患者行术前膀胱造瘘术;导致尿道狭窄的病因有炎症、外伤、尿道下裂术后和医源性损伤。带蒂阴茎皮瓣尿道成形术组有10例患者,平均年龄为(42.8±20.2)岁,病程为6.0~480.0个月,尿道狭窄长度为3.0~7.0 cm,2例行术前膀胱造瘘术;导致尿道狭窄的病因有炎症、外伤、医源性损伤和尖锐湿疣。口腔黏膜移植物尿道成形术组患者尿道狭窄长度长于带蒂阴茎皮瓣尿道成形术组,差异有统计学意义(P<0.05);两组患者年龄、病程、术前最大自由尿流率、行术前膀胱造瘘术的患者占比和尿道狭窄病因比较差异均无统计学意义(P均>0.05)。见表 1。
|
|
表 1 两组患者的基本资料及病因分类资料 Tab 1 Basic information and etiological classification data of the two groups |
2.2 两组患者治疗效果比较
术后随访时间为20(12~36)个月。23例行口腔黏膜移植物尿道成形术的患者中有21例采用下唇黏膜行尿道重建,其中1例患者于术于后第3个月出现尿道狭窄;2例患者采用下唇黏膜联合舌黏膜行尿道重建,其中1例患者于术后第2个月出现尿道狭窄。尿道狭窄复发的2例患者经内镜切开治疗后排尿症状得到改善。10例行带蒂阴茎皮瓣尿道成形术的患者中有1例于术后第6个月出现尿瘘,由于患者高龄(80岁)、身体条件较差,无法耐受二次手术治疗,遂以会阴处尿道造瘘进行排尿。口腔黏膜移植物尿道成形术组和带蒂阴茎皮瓣尿道成形术组手术成功的患者,术后1年最大自由尿流率均较术前提高,差异均有统计学意义[口腔黏膜移植物尿道成形术组19.6(12.2~21.7)mL/s vs 5.0(0.0~8.2)mL/s,Z=-4.199,P<0.01,n=21;带蒂阴茎皮瓣尿道成形术组20.4(13.6~23.6)mL/s vs 6.1(0.0~12.0)mL/s,Z=-2.803,P<0.01,n=9];两组手术成功的患者性功能均未见明显损害,IIEF-5评分与术前相比差异均无统计学意义[口腔黏膜移植物尿道成形术组16.0(4.0~21.0)分vs 14.0(5.0~18.0)分,Z=-1.768,P>0.05,n=21;带蒂阴茎皮瓣尿道成形术组15.0(7.0~19.0)分vs 17.5(3.0~23.0)分,Z=-1.014,P>0.05,n=9]。
2.3 两组患者术后并发症情况33例患者手术切口均甲级愈合,术后均无尿道感染、憩室形成、痛性勃起。行口腔黏膜移植物尿道成形术患者中有3例术后出现口腔切口部位麻木不适感,未做特殊处理,患者症状均于术后1年内逐渐好转,术后均无张口困难、发音异常等并发症。
3 讨论尿道狭窄的病因复杂,本研究入组患者前尿道狭窄的主要病因为炎症、尿道下裂术后并发症、医源性操作损伤、创伤等。尿道修复重建是治疗长段尿道狭窄的主要方式,对于长段(>2 cm)前尿道狭窄,由于尿道组织材料缺乏,应考虑利用其他替代组织行尿道重建术[5]。复杂性尿道狭窄的治疗尚无广泛接受的标准方法。目前报道的用于复杂性尿道狭窄修复的组织包括阴茎皮瓣、口腔黏膜移植物、膀胱黏膜移植物、直肠黏膜移植物等[1-4],但是,没有一种技术适用于做所有情况。因此,必须根据每例患者的自身情况选择合适的尿道重建方案。
口腔黏膜是一种理想的尿道替代物,Simonato等[6]首次报道了将舌黏膜作为自体移植物运用到尿道重建手术,取得了良好效果。舌黏膜具有良好的免疫学特性(对感染有抵抗力),上皮厚,固有层薄且含有许多弹性纤维,血液供应丰富,适合作为移植替代物。此外,舌黏膜易于获取,切取黏膜后伤口愈合较快,患者术后第2天即可进食。对于复杂性前尿道狭窄患者,运用舌黏膜移植物行尿道重建术,手术效果良好,术后并发症发生率较低[7]。Bürger等[8]于1992年率先报道利用颊黏膜移植物成功修复尿道下裂手术失败后尿道狭窄的病例。至今,颊黏膜移植物仍是用于修复各种前尿道狭窄的优良移植物之一[9]。但是颊黏膜分离时暴露相对困难,且口腔血管神经束位于颊肌内、面神经在其下方走行,分离时不易过深以免进入肌层,同时还应注意保护腮腺管(位于第2磨牙相对处颊部)。与颊黏膜相比,下唇黏膜牵引暴露简单,切取黏膜过程也较容易,但下唇黏膜切取长度不易过长、过宽,以免造成下唇变形。下唇黏膜、颊黏膜及舌黏膜等都是优良的尿道替代物[10],可根据患者自身情况灵活运用各种口腔黏膜进行尿道修复。此外,在进行长段的前尿道狭窄修复时,如果单一种类的口腔黏膜组织不足,也可以联合利用多部位口腔黏膜移植物行尿道重建[11]。
口腔黏膜替代尿道术分腹侧加盖和背侧扩大尿道成形术。虽然腹侧加盖手术操作相对简单,但因黏膜缺乏良好的支撑及稳定的血管床,容易导致狭窄复发及尿道憩室和小囊形成。而背侧扩大成形术虽游离尿道组织较多,操作相对复杂,但背侧的阴茎海绵体可提供较好的血管床及支撑,能显著提高尿道成形术的成功率[12-13]。本研究中,23例采用口腔黏膜移植物尿道成形术的患者尿道狭窄段长度为5.0(3.0~12.0)cm,均应用背侧扩大尿道成形术式,手术成功率为91.3%(21/23)。
带蒂阴茎或阴囊皮瓣尿道成形术也是治疗前尿道狭窄最常用的术式之一。采用带蒂阴茎或阴囊皮瓣行尿道修复手术,要求患者阴茎或阴囊皮肤组织充裕、皮肤及肉膜层血供良好。我科经严格评估阴茎包皮长度及质量后,对本组10例患者采用了带蒂阴茎皮瓣移植术,手术效果良好,仅1例高龄患者术后6个月出现尿瘘情况。阴茎皮肤作为尿道替代组织具有许多优势,如靠近手术区域、取材方便、手术时间短等。
结合我科对前尿道狭窄患者的治疗经验及回顾文献,总结手术经验如下:(1)对于手术方式的选择,根据不同尿道狭窄长度、狭窄部位,可灵活采用下唇黏膜、舌黏膜或带蒂阴茎皮瓣进行尿道修复。对于狭窄段相对较短、无尿道手术史、阴茎包皮预估足够的患者,可采用带蒂阴茎皮瓣行尿道修复重建,以减少创伤、降低手术难度。(2)为避免黏膜与正常尿道黏膜吻合处狭窄,可将黏膜两端修剪成楔形,且切缘至正常黏膜边缘≥0.5 cm,以保证狭窄段瘢痕组织被彻底清除。(3)行背侧黏膜覆盖操作时,为保证充足血供,仅对活动性出血予双极电凝止血,对于尿道背侧切开后少量渗血及阴茎白膜表面出血点常不做特殊处理,以保证黏膜存活。将黏膜移植物镶嵌于背侧时,在黏膜条内行“钉状”固定,并用尖刀在黏膜中心多处戳孔,可在保证血供的同时充分引流,避免淤血沉积引起感染,有利于毛细血管生长和黏膜存活。(4)切取口腔黏膜时,尽量减少组织损伤、缩短游离旷置时间,以利于黏膜早期成活。下唇黏膜取材方便,但范围不易过大,以免造成下唇变形。颊黏膜取材注意保护腮腺管。(5)利用肉膜或阴囊鞘膜层等作为“隔水层”,可起到加固支撑的作用,能减少重建尿道的渗漏。
综上所述,对于复杂性前尿道狭窄患者采用口腔黏膜或带蒂阴茎皮瓣等自体组织行尿道修复,短期效果良好。可在充分评估患者口腔黏膜质量、阴茎包皮质量、前尿道狭窄部位及长度的基础上,灵活选用自体移植物行尿道修复手术。但这2种自体移植物用于修复前尿道狭窄的长期临床效果仍需要大样本量和长期随访的临床研究来确定。
| [1] |
HMIDA W, OTHMEN M B, BAKO A, JAIDANE M, MOSBAH F. Penile skin flap: a versatile substitute for anterior urethral stricture[J]. Int Braz J Urol, 2019, 45: 1057-1063. |
| [2] |
WANG Z, ZENG X, CHEN R, WANG T, HU J, WANG S, et al. Free bladder mucosa graft harvested by water-jet: a novel, minimally invasive technique for urethral reconstruction[J]. Exp Ther Med, 2018, 16: 2251-2256. |
| [3] |
GRANIERI M A, ZHAO L C, BREYER B N, VOELZKE B B, BARADARAN N, GRUCELA A L, et al. Multi-institutional outcomes of minimally invasive harvest of rectal mucosa graft for anterior urethral reconstruction[J]. J Urol, 2019, 201: 1164-1170. DOI:10.1097/JU.0000000000000087 |
| [4] |
BARBAGLI G, BALÒ S, MONTORSI F, SANSALONE S, LAZZERI M. History and evolution of the use of oral mucosa for urethral reconstruction[J]. Asian J Urol, 2017, 4: 96-101. DOI:10.1016/j.ajur.2016.05.006 |
| [5] |
CHENG L, LI S, WANG Z, HUANG B, LIN J. A brief review on anterior urethral strictures[J]. Asian J Urol, 2018, 5: 88-93. DOI:10.1016/j.ajur.2017.12.005 |
| [6] |
SIMONATO A, GREGORI A, LISSIANI A, GALLI S, OTTAVIANI F, ROSSI R, et al. The tongue as an alternative donor site for graft urethroplasty: a pilot study[J]. J Urol, 2006, 175: 589-592. DOI:10.1016/S0022-5347(05)00166-7 |
| [7] |
ABDELHAMEED H, ELGAMAL S, FARHA M A, EL-ABD A, TAWFIK A, SOLIMAN M. The long-term results of lingual mucosal grafts for repairing long anterior urethral strictures[J]. Arab J Urol, 2015, 13: 128-133. |
| [8] |
BÜRGER R A, MÜLLER S C, EL-DAMANHOURY H, TSCHAKALOFF A, RIEDMILLER H, HOHENFELLNER R. The buccal mucosal graft for urethral reconstruction: a preliminary report[J]. J Urol, 1992, 147: 662-664. |
| [9] |
PAVONE C, FONTANA D, GIACALONE N, DISPENSA N, VELLA M, SIMONATO A. Urethroplasty with dorsal buccal mucosa graft. Is it still the method of choice in long term urethral stenosis?[J]. Arch Ital Urol Androl, 2017, 89: 42-44. |
| [10] |
LUMEN N, VIERSTRAETE-VERLINDE S, OOSTERLINCK W, HOEBEKE P, PALMINTERI E, GOES C, et al. Buccal versus lingual mucosa graft in anterior urethroplasty: a prospective comparison of surgical outcome and donor site morbidity[J]. J Urol, 2016, 195: 112-117. |
| [11] |
XU Y M, SA Y L, FU Q, ZHANG J, SI J M, LIU Z S. Oral mucosal grafts urethroplasty for the treatment of long segmented anterior urethral strictures[J]. World J Urol, 2009, 27: 565-571. DOI:10.1007/s00345-009-0378-0 |
| [12] |
MARTINS F E, KULKARNI S B, JOSHI P, WARNER J, MARTINS N. Management of long-segment and panurethral stricture disease[J/OL]. Adv Urol, 2015, 2015: 853914. DOI: 10.1155/2015/853914.
|
| [13] |
VERLA W, OOSTERLINCK W, SPINOIT A F, WATERLOOS M. A comprehensive review emphasizing anatomy, etiology, diagnosis, and treatment of male urethral stricture disease[J/OL]. Biomed Res Int, 2019, 2019: 9046430. DOI: 10.1155/2019/9046430.
|
 2021, Vol. 42
2021, Vol. 42


