早产是导致新生儿死亡或残疾的主要原因[1]。早产儿脏器尚未发育成熟,且又受宫外多种不良因素影响,因此容易出现早期损伤,尤其中枢神经系统的损伤较为显著。中枢神经系统功能和结构发育的关键期是在胎儿期的最后3个月及出生后半年内[2],这段时间易发生脑白质损伤。近年来随着新生儿医学技术的不断进步及孕期护理措施的加强,早产儿脑白质损伤的比例逐渐降低。研究发现无脑损伤的早产儿在后期随访过程中未遗留明显后遗症或仅存在轻度精神、运动发育迟缓,相比合并脑损伤的早产儿预后较好[3]。目前MRI是动态观察脑白质髓鞘化进程的唯一无创检查手段,既往国内外文献大多集中在对早产儿脑白质损伤的研究[4-5],尚无利用T2加权液体衰减反转恢复(T2 weighted-fluid attenuated inversion recovery,T2WI-FLAIR)序列成像对无脑损伤早产儿脑白质发育评估的报道。T2WI-FLAIR序列是基于将自由水转变成低信号的极重T2WI这一原理进行的成像[6],由于早产儿的脑白质髓鞘主要成分疏水糖脂蛋白含量较少,而含水量较高且以自由水为主(胎龄越小自由水所占比例越高),因此早产儿脑白质T2WI-FLAIR序列成像后表现为相对低信号[7]。本研究利用T2WI-FLAIR序列成像,从脑白质低信号区的面积及信号强度比值2个方面定量评估无脑损伤早产儿的脑白质髓鞘化程度,旨在为临床评估无脑损伤早产儿的脑白质发育状况提供客观依据。
1 资料和方法 1.1 资料来源收集2015年7月至2018年7月山东大学齐鲁儿童医院新生儿监护室收治的157例无脑损伤早产儿的MRI资料和临床资料。所有早产儿于出生后1~3 d内及纠正胎龄为40周时行标准头颅MRI检查,出院后均能按时(间期为6~8个月)门诊复查头颅MRI及进行Gesell发育量表评估,患儿均无明显后遗症(不包括精神、运动发育迟缓)。所有早产儿按出生胎龄分为5组:28~29周、30~31周、32~33周、34~35周、36~37周组。于2016年8月至2018年7月募集33名足月新生儿(>37周)为志愿者(部分来源于山东大学齐鲁儿童医院协作体医院,部分为社会征集志愿者),均于胎龄为40周时行标准头颅MRI检查。本研究通过山东大学齐鲁儿童医院伦理委员会审批(ETYY-2021216),所有监护人均签署研究知情同意书。
1.2 早产儿无脑损伤的诊断标准(1)无窒息、缺氧及缺血等病因及由此导致的脑实质出血、梗死等。(2)无先天性颅脑发育畸形(神经元移行异常、脊柱裂伴脑膜膨出等)。(3)无中枢神经系统感染等相关疾病,如脑膜炎、脑炎及中枢神经系统炎性脱髓鞘病变等。(4)无家族遗传性染色体疾病及先天性代谢性疾病病史。(5)无早产儿溶血等可能导致胆红素脑病、低血糖脑损伤等,或其他可能导致神经系统后遗症的病变。(6)Apgar评分在正常参考范围(分别在出生后1、5、10 min进行评价,总分8~10分为正常,4~7分为轻度窒息,0~3分为重度窒息)内或接近正常最低分。(7)生命体征平稳,且生物化学指标无严重异常。
1.3 设备与参数采用荷兰Philips公司Ingenia型3.0 T超导型磁共振扫描仪,标准头颅线圈。对于无法配合的早产儿,检查前予5%的水合氯醛(0.5 mL/kg)口服,帮助其进入深睡眠状态。T2WI-FLAIR序列参数:回波时间为120 ms,重复时间为11 000 ms,视野为270 mm×270 mm,矩阵为285×285,层厚为5 mm,间隔为1 mm。
1.4 图像分析与观察指标测量(1)按解剖学标准[8]将枕、顶、额、颞叶白质分为中央区、周围区及邻近脑室区3个区域。(2)不同脑叶白质低信号区最大截面积的衡量标准:在T2WI-FLAIR水平面图像上,于白质内低信号区最大层面的中心点分别作水平线与垂直线,以这2条线为基准每间隔3 mm作若干平行线,在图像上形成矩阵方格,然后根据白质内低信号区所占的格子总数(大于半格、不足1格的按照1格计算,小于半格的忽略不计)计算出白质低信号区最大截面积(图 1A、1B),双侧取平均值。(3)采用专业线性灰度测量软件(LGM 19.0)对T2WI-FLAIR图像上低信号区域进行信号强度测量(图 1C),以脑脊液信号强度为参照计算信号强度比值。测量时选取T2WI-FLAIR图像上信号最低的区域作为感兴趣区,注意测量区域外缘距低信号区最外缘应≥5 mm,以避免容积效应对信号强度的影响,尽可能减小数据测量的误差。选取≥3个测量点,求平均值。(4)由3名经验丰富的影像科副主任医师以盲法进行图像分析和指标测量,每人测量2次(2次间隔时间为3 d),最终数据取3名医师2次测量结果的平均值。
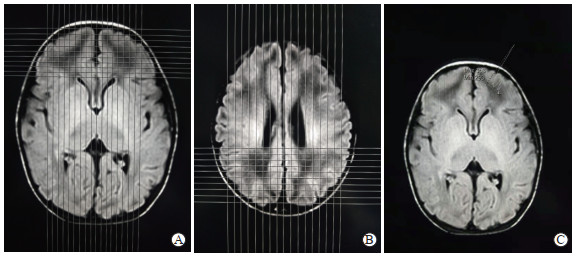
|
图 1 早产儿T2WI-FLAIR序列脑白质低信号区最大截面积及信号强度测量方法 Fig 1 Measurement of maximum cross-sectional area and signal intensity of low signal region in brain white matter of T2WI-FLAIR sequence in preterm infants Male, preterm at 30 weeks, without brain injury. A, B: Matrix square plots of frontal lobe (A) and parietal lobe (B) in axial T2WI-FLAIR, and the maximum cross-sectional areas of low signal region were about 2.29 cm2 and 2.16 cm2, respectively; C: The signal intensity of frontal lobe was measured using linear grayscale measurement tool, and the signal intensity ratio to cerebrospinal fluid was 5.24. T2WI-FLAIR: T2 weighted-fluid attenuated inversion recovery. |
1.5 统计学处理
应用SPSS 20.0软件进行统计学分析。采用组内相关系数(intraclass correlation coefficient,ICC)与Cronbach’s α系数评估3名影像科医师对脑白质低信号区最大截面积及信号强度比值测量结果的组内一致性及可重复性,ICC<0.40提示一致性差,0.40≤ICC<0.75提示一致性中等,ICC≥0.75提示一致性较好;Cronbach’s α系数>0.6说明可重复性较好。呈正态分布的计量资料以x±s表示,多组间比较采用单因素方差分析,两两比较采用最小显著性差异(least significant difference,LSD)-t检验。等级资料比较采用Wilcoxon秩和检验。检验水准(α)为0.05。
2 结果 2.1 一般资料157例无脑损伤早产儿中男87例、女70例。28~29周、30~31周、32~33周、34~35周、36~37周组分别有16例(男9例、女7例)、26例(男14例、女12例)、34例(男19例、女15例)、39例(男22例、女17例)、42例(男23例、女19例)。33名足月新生儿(>37周)中男21例、女12例。各组早产儿及足月新生儿性别构成差异无统计学意义(Z=0.366,P=0.947)。
2.2 测量结果的组内一致性及可重复性分析由表 1可见,3名影像科医师对早产儿(出生后1~3 d)T2WI-FLAIR序列脑白质低信号区最大截面积及信号强度比值测量结果有着高度一致性及较好的可重复性。
|
|
表 1 早产儿T2WI-FLAIR序列脑白质低信号区最大截面积及信号强度比值测量的组内一致性及可重复性 Tab 1 Intra-group consistency and repeatability of measurement of maximum cross-sectional area and signal intensity ratio of low signal region in brain white matter of T2WI-FLAIR sequence in preterm infants |
2.3 各组早产儿不同脑叶白质低信号区最大截面积比较
由表 2可见,28~29周、30~31周、32~33周、34~35周、36~37周组早产儿枕、顶、额、颞叶T2WI-FLAIR序列白质低信号区最大截面积均随出生胎龄的增加而降低,差异均有统计学意义(P均<0.01)。其中枕、顶叶白质低信号区最大截面积在28~29周、30~31周组均大于32~33周、34~35周及36~37周组(P均<0.05),在32~33周组均大于34~35周及36~37周组(P均<0.05),在34~35周组大于36~37周组(P<0.05);额、颞叶白质低信号区最大截面积在28~29周、30~31周、32~33周组均大于34~35周及36~37周组(P均<0.05),在34~35周组大于36~37周组(P<0.05)。
|
|
表 2 各组早产儿不同脑叶T2WI-FLAIR序列白质低信号区最大截面积比较 Tab 2 Comparison of maximum cross-sectional areas of low signal region in white matter of T2WI-FLAIR sequence in different cerebral lobes of preterm infants |
2.4 各组早产儿不同脑叶白质低信号区信号强度比值的比较
28~29周、30~31周、32~33周、34~35周、36~37周组早产儿枕、顶、额、颞叶T2WI-FLAIR序列白质低信号区信号强度比值均随出生胎龄的增加而升高,差异均有统计学意义(P均<0.01)。其中枕叶白质低信号区信号强度比值在28~29周、30~31周组均小于32~33周、34~35周及36~37周组(P均<0.05),在32~33周组小于34~35周及36~37周组(P均<0.05),在34~35周组小于36~37周组(P<0.05);顶、额、颞叶白质低信号区信号强度比值在28~29周、30~31周、32~33周组均小于34~35周及36~37周组(P均<0.05),在34~35周组小于36~37周组(P<0.05)。并且,各组早产儿不同脑叶T2WI-FLAIR序列白质低信号区信号强度比值按照枕、顶、额、颞叶的顺序依次降低,差异均有统计学意义(P均<0.01)。见表 3。
|
|
表 3 各组早产儿不同脑叶T2WI-FLAIR序列白质低信号区信号强度比值的比较 Tab 3 Comparison of signal intensity ratios of low signal region in white matter of T2WI-FLAIR sequence in different cerebral lobes of preterm infants |
2.5 各组早产儿不同脑区白质低信号区信号强度比值的比较
32~33周、34~35周、36~37周组早产儿不同脑区的T2WI-FLAIR序列白质低信号区信号强度比值不同,均按照中央区、周围区及邻近脑室区的顺序依次降低,差异均有统计学意义(P均<0.01)。见表 4。
|
|
表 4 各组早产儿不同脑区T2WI-FLAIR序列白质低信号区信号强度比值的比较 Tab 4 Comparison of signal intensity ratios of low signal region in white matter of T2WI-FLAIR sequence in different brain regions of preterm infants |
2.6 早产儿纠正胎龄40周时与足月新生儿胎龄40周时脑白质低信号区最大截面积及信号强度比值的比较
早产儿在纠正胎龄为40周时T2WI-FLAIR序列脑白质低信号区的最大截面积(枕、顶、额、颞叶测量结果的平均值)随出生胎龄的增加而降低(F=21.337,P<0.01),组间两两比较结果显示28~29周组>30~31周组>32~33周组>34~35周组和36~37周组,差异均有统计学意义(P均<0.05);信号强度比值(枕、顶、额、颞叶测量结果的平均值)随出生胎龄的增加而升高(F=17.154,P<0.01),组间两两比较结果显示28~29周组<30~31周组<32~33周组<34~35周组和36~37周组,差异均有统计学意义(P均<0.05)。足月新生儿胎龄40周时T2WI-FLAIR序列脑白质低信号区的最大截面积小于各组纠正胎龄为40周时的早产儿(F=26.204,P<0.01),其中足月新生儿胎龄40周时白质低信号区的最大截面积小于28~29周、30~31周、32~33周组早产儿(P均<0.05);足月新生儿40周时信号强度比值大于各组纠正胎龄为40周时的早产儿(F=18.379,P<0.01),其中足月新生儿40周时信号强度比值大于28~29周、30~31周、32~33周组早产儿(P均<0.05)。见表 5。
|
|
表 5 早产儿纠正胎龄40周时与足月新生儿胎龄40周时T2WI-FLAIR序列脑白质低信号区最大截面积及信号强度比值的比较 Tab 5 Comparison of maximum cross-sectional areas and signal intensity ratios of low signal region in brain white matter of T2WI-FLAIR sequence between preterm infants at 40 weeks of corrected gestational age and full-term newborns at 40 weeks of gestational age |
3 讨论
本研究结果显示早产儿脑白质低信号区最大截面积随出生胎龄的增加而降低(P均<0.01),其原因是随着胎龄的增加,白质内结合水含量升高[9],T2WI-FLAIR序列成像后能够被抑制为低信号的自由水减少,导致低信号区面积缩小,这与文献报道[10]一致。但这种变化在早产儿的不同脑叶白质内并不一致,本研究中枕、顶叶白质区28~29周与30~31周组间比较差异无统计学意义(P均>0.05),也就是说出生胎龄28~31周的早产儿枕、顶叶脑白质自由水含量变化不明显;而额、颞叶白质区28~29周、30~31周、32~33周组3组间差异均无统计学意义(P均>0.05),说明出生胎龄28~33周的早产儿额、颞叶脑白质自由水含量变化也不明显。枕、顶叶与额、颞叶白质低信号区面积随着胎龄的变化趋势不一致,分析原因可能是脑白质的髓鞘化最早开始于胚胎第5个月(约21周),90%的髓鞘化发生于胚胎8个月(约34周)以后[11],此时髓鞘主要成分疏水糖脂蛋白含量极低,且差异不明显,故34周前自由水含量的变化不显著,导致T2WI-FLAIR序列成像后不同出生胎龄组脑白质低信号面积差异不明显。但本研究中,出生胎龄32~33周组枕、顶叶白质低信号区的最大截面积与28~31周组(极早产儿)比较差异有统计学意义(P均<0.05),原因可能是因为脑白质髓鞘化顺序是从尾侧向头侧进行[12],枕、顶叶髓鞘化较额、顶叶早,故在出生胎龄32~33周时枕、顶叶白质的疏水糖脂蛋白含量可能多于额、颞叶。在早产儿中,这些枕、顶、额、颞叶白质区髓鞘成分较少,含水量较高,组织松散,因此T2WI-FLAIR序列表现为明显低信号,测量时较为直观,能够尽可能小地减少误差;而胼胝体及内囊等深部白质在早期,即便是早产儿中,其组织结构也较为致密,T2WI-FLAIR序列呈等信号,与周围结构很难辨识,故测量较为困难,误差较大,因此本研究未将深部白质区列为评估区域。
各组早产儿不同脑叶白质低信号区信号强度比值随出生胎龄的增加而升高,差异均有统计学意义(P均<0.01),原因为随着胎龄增加,疏水糖脂蛋白及结合水含量增多、自由水减少,T2WI-FLAIR序列白质信号会相应增高,这与Arroyo等[13]的研究结果一致。但本研究结果显示,枕叶白质区信号强度比值在28~29周与30~31周组之间比较差异无统计学意义(P>0.05),额、顶、颞叶白质区28~29周、30~31周、32~33周组3组之间比较差异亦均无统计学意义(P均>0.05),即以上出生胎龄组早产儿脑白质的自由水含量无明显差异,原因与前文所述90%的髓鞘化发生于胚胎8个月(约34周)以后[11]有关,枕叶的髓鞘化程度早于其他脑叶[12],故出生胎龄32~33周时枕叶疏水糖脂蛋白含量高于其他区域,从而表现为出生胎龄32~33周时枕叶信号强度比值高于前两组(出生胎龄28~29周、30~31周)早产儿。本研究中,各出生胎龄组早产儿脑白质低信号区信号强度比值按照枕、顶、额、颞叶的顺序减低(P均<0.01),原因为髓鞘化是由尾侧到头侧的顺序进行[12],枕叶髓鞘化最早故其信号最高,颞叶最晚故同时期内信号是最低的。这一结论对实际临床工作有重要意义,当测量数值与上述顺序不一致时,提示可能存在局部髓鞘化障碍,或者有合并早产儿脑损伤的可能性[14]。
本研究按照解剖学标准[8]将脑白质分为中央区、周围区及邻近脑室区,分析不同区域的测量结果发现,28~29周及30~31周组早产儿中央区、周围区及邻近脑室区信号强度比值差异均无统计学意义(P均>0.05),其余各出生胎龄组早产儿白质低信号强度比值按照中央区、周围区及邻近脑室区的顺序依次降低。说明在极早产儿(出生胎龄28~31周)不同脑区髓鞘发育无明显先后顺序,但从胎龄>32周开始,中央区是最早发育的部位,外周区次之,邻近脑室区最晚。原因为极早产儿白质内疏水糖脂蛋白含量较低,自由水含量较大,故T2WI-FLAIR序列成像后信号强度比值差别不大;文献报道脑白质髓鞘化是按照从背侧向腹侧、先中央后外周的顺序进行[15],故当胎龄大于32周后,髓鞘化程度逐渐加快,从而使T2WI-FLAIR序列成像上3个脑区白质的髓鞘化出现差异。
各组早产儿纠正胎龄为40周时T2WI-FLAIR序列脑白质低信号区最大截面积随着出生胎龄的增加而降低,信号强度比值随出生胎龄的增加而升高(P均<0.01)。足月新生儿胎龄40周时T2WI-FLAIR序列脑白质低信号区的最大截面积小于各组纠正胎龄为40周时的早产儿(P<0.01),信号强度比值大于各组纠正胎龄为40周时的早产儿(P<0.01)。提示早产儿虽然未合并脑损伤,但其纠正胎龄为40周时髓鞘化水平仍然落后于足月新生儿40周。原因为早产儿尤其是小于32周的极早产儿脑发育非常不成熟,如果此时脱离母体环境,早产儿便会产生一种与其周围环境相适应的机制,环境会对其大脑的发育产生一种塑形模式[16],而周围环境又会存在诸多对早产儿生长不利的因素[17],从而出现髓鞘化落后现象。研究证明早产儿较足月新生儿更容易受到周围不利因素的影响[18]。但本研究结果显示,出生胎龄34~35周早产儿(纠正胎龄40周)、出生胎龄36~37周早产儿(纠正胎龄40周)、足月新生儿(40周)3组间白质低信号区最大截面积和信号强度比值差异无统计学意义(P均>0.05),即34~35周、36~37周早产儿与足月新生儿在纠正胎龄为40周时白质低信号区最大截面积和信号强度比值是一致的,原因可能为34~37周属于晚期早产,胎儿发育相对较成熟,出生后不容易受环境因素的影响,故其纠正胎龄为40周时的髓鞘化程度与足月儿40周时相近。这一结果提示,当早产儿出生胎龄小于32周时,即使未合并明显脑损伤,纠正胎龄为40周时其髓鞘发育程度也落后于晚期早产儿及足月新生儿。
本研究明确了无脑损伤早产儿不同时期T2WI-FLAIR序列成像后白质低信号最大截面积及信号强度比值的差异,能够间接推测出早产儿的脑白质髓鞘化程度,有助于判断早产儿的脑白质发育状况。极早产儿脑白质发育更容易受到各种环境因素的影响,提示新生儿监护室对这部分患儿的诊疗方案应更细致和具体化。本研究对无脑损伤早产儿的脑白质髓鞘发育状况进行了定量分析,对开展合并脑损伤早产儿的相关研究提供了一个参考标准,因为后者的脑损伤更严重,并发症更多,能及时监测到其髓鞘化发育状况至关重要。本研究所采用的方法虽然能够定量评估早产儿的脑白质发育状况,但均为间接评估,可能会存在一定误差,相信随着研究的深入,评估手段会越来越精准。
| [1] |
DUERDEN E G, TAYLOR M J, MILLER S P. Brain development in infants born preterm: looking beyond injury[J]. Semin Pediatr Neurol, 2013, 20: 65-74. DOI:10.1016/j.spen.2013.06.007 |
| [2] |
VASUNG L, ABACI TURK E, FERRADAL S L, SUTIN J, STOUT J N, AHTAM B, et al. Exploring early human brain development with structural and physiological neuroimaging[J]. Neuroimage, 2019, 187: 226-254. DOI:10.1016/j.neuroimage.2018.07.041 |
| [3] |
ORTON J L, OLSEN J E, ONG K, LESTER R, SPITTLE A J. NICU graduates: the role of the allied health team in follow-up[J/OL]. Pediatr Ann, 2018, 47: e165-e171. DOI: 10.3928/19382359-20180325-02.
|
| [4] |
刘畅, 富建华, 薛辛东. 早产儿脑白质损伤的早期影像学改变及其对预后的影响[J]. 中华儿科杂志, 2012, 50: 762-766. DOI:10.3760/cma.j.issn.0578-1310.2012.10.013 |
| [5] |
VAN TILBORG E, HEIJNEN C J, BENDERS M J, VAN BEL F, FLEISS B, GRESSENS P, et al. Impaired oligodendrocyte maturation in preterm infants: potential therapeutic targets[J]. Prog Neurobiol, 2016, 136: 28-49. DOI:10.1016/j.pneurobio.2015.11.002 |
| [6] |
VENKATASAMY A, HUYNH T T, WOHLHUTER N, VUONG H, ROHMER D, CHARPIOT A, et al. Superior vestibular neuritis: improved detection using FLAIR sequence with delayed enhancement (1 h)[J]. Eur Arch Otorhinolaryngol, 2019, 276: 3309-3316. DOI:10.1007/s00405-019-05639-7 |
| [7] |
GANO D. White matter injury in premature newborns[J]. Neonatal Netw, 2016, 35: 73-77. DOI:10.1891/0730-0832.35.2.73 |
| [8] |
PATANIA A, SELVAGGI P, VERONESE M, DIPASQUALE O, EXPERT P, PETRI G. Topological gene expression networks recapitulate brain anatomy and function[J]. Netw Neurosci, 2019, 3: 744-762. DOI:10.1162/netn_a_00094 |
| [9] |
BEKIESIŃSKA-FIGATOWSKA M, RUTKOWSKA M, STANKIEWICZ J, KRUPA K, IWANOWSKA B, ROMANIUK-DOROSZEWSKA A, et al. Neonatal brain and body imaging in the MR-compatible incubator[J]. Adv Clin Exp Med, 2019, 28: 945-954. DOI:10.17219/acem/94155 |
| [10] |
OTSUKA Y, CHANG L, KAWASAKI Y, WU D, CERITOGLU C, OISHI K, et al. A multi-atlas label fusion tool for neonatal brain MRI parcellation and quantification[J]. J Neuroimaging, 2019, 29: 431-439. |
| [11] |
MCLACHLAN K, VAVASOUR I, MACKAY A, BRAIN U, OBERLANDER T, LOOCK C, et al. Myelin water fraction imaging of the brain in children with prenatal alcohol exposure[J]. Alcohol Clin Exp Res, 2019, 43: 833-841. DOI:10.1111/acer.14024 |
| [12] |
RUTH GRÜNDAHL F, HAMMER K, BRAUN J, OELMEIER DE MURCIA K, KÖSTER H A, MÖLLERS M, et al. Fetal brain development in diabetic pregnancies and normal controls[J]. J Perinat Med, 2018, 46: 797-803. DOI:10.1515/jpm-2017-0341 |
| [13] |
ARROYO M S, HOPKIN R J, NAGARAJ U D, KLINE-FATH B, VENKATESAN C. Fetal brain MRI findings and neonatal outcome of common diagnosis at a tertiary care center[J]. J Perinatol, 2019, 39: 1072-1077. DOI:10.1038/s41372-019-0407-9 |
| [14] |
BURKITT K, KANG O, JYOTI R, MOHAMED A L, CHAUDHARI T. Comparison of cranial ultrasound and MRI for detecting brain injury in extremely preterm infants and correlation with neurological outcomes at 1 and 3 years[J]. Eur J Pediatr, 2019, 178: 1053-1061. DOI:10.1007/s00431-019-03388-7 |
| [15] |
MAYER J A, FIGARI C, RADCLIFF A B, MCKEE C, DUNCAN I D. Myelin and oligodendrocyte development in the canine spinal cord[J]. J Comp Neurol, 2016, 524: 930-939. DOI:10.1002/cne.23882 |
| [16] |
LEA C L, SMITH-COLLINS A, LUYT K. Protecting the premature brain: current evidence-based strategies for minimising perinatal brain injury in preterm infants[J]. Arch Dis Child Fetal Neonatal Ed, 2017, 102: F176-F182. DOI:10.1136/archdischild-2016-311949 |
| [17] |
CARRASCO M, STAFSTROM C E. How early can a seizure happen? Pathophysiological considerations of extremely premature infant brain development[J]. Dev Neurosci, 2018, 40: 417-436. DOI:10.1159/000497471 |
| [18] |
AWAYSHEH F, ALHMAIEDEEN N, AL-GHANANIM R, BSHARAT A, AL-HASAN M. Criteria for using INSURE in management of premature babies with respiratory distress syndrome[J]. Med Arch, 2019, 73: 240-243. DOI:10.5455/medarh.2019.73.240-243 |
 2021, Vol. 42
2021, Vol. 42


