2. 同济大学附属上海市第四人民医院呼吸与危重症医学科, 上海 200439
2. Department of Respiratory and Critical Care Medicine, Shanghai Fourth People's Hospital, Tongji University, Shanghai 200439, China
2020年统计数据显示,肺癌是全球发病率居第2位的恶性肿瘤,死亡率居世界首位[1-2]。肺鳞状细胞癌是原发性支气管肺癌的一种常见类型,其对放射治疗、化学治疗均不敏感[3]。肺鳞状细胞癌的病理特征、生物学行为及诊治过程与其他类型肺癌有着明显区别,既往多作为单独分类进行研究。肺鳞状细胞癌常发生于老年患者,多表现为中央型肿瘤,确诊时多为晚期,呼吸道及心血管系统并发症多,靶向治疗获益不佳[4]。近年来,免疫治疗进展迅速,被应用于多种恶性肿瘤的治疗并获得认可,已成为个体化治疗的主要驱动力[5-7]。针对免疫检查点的治疗如抗程序性死亡因子1(programmed death 1,PD-1)/程序性死亡因子配体1(programmed death-ligand 1,PD-L1)与抗细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen 4,CTLA-4)被认为具有广阔的应用前景[7-9]。除此之外的免疫治疗靶点仍在不断探索中[10-12]。因此,探讨免疫细胞募集的机制、免疫细胞浸润的全景及相关标志物的识别具有重要意义。
免疫细胞浸润与肿瘤的发生、进展、转移、预后及治疗策略选择有关[13-17],但在肺鳞状细胞癌中相关研究较少。为了更好地了解肺鳞状细胞癌免疫细胞浸润全景、识别预后相关免疫细胞亚群、评估患者预后、探索免疫细胞招募机制,本研究利用癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库数据进行分析。
1 材料和方法 1.1 数据收集从TCGA数据库(https://cancergenome.nih.gov/)下载肺鳞状细胞癌全转录组数据(n=551),并将其合并为同一矩阵,其中正常组织49例、肺鳞状细胞癌组织502例。同时下载相应的肺鳞状细胞癌患者临床资料。
1.2 免疫细胞浸润相对含量全景通过R 4.0.3软件和利用CIBERSORT反卷积算法[18],随机运算1 000次,以P<0.05为样本筛选标准。剔除部分不符合筛选标准的样本后,最后保留样本495例,其中正常组织49例、肺鳞状细胞癌组织446例。利用肺鳞状细胞癌全转录组测序结果,推算每个样本中不同免疫细胞浸润相对比例并绘图;使用聚类分析区分正常组织和肺鳞状细胞癌组织,绘制不同免疫细胞浸润相对含量的热图;采用Wilcoxon检验比较正常组织与肺鳞状细胞癌组织中免疫细胞浸润相对含量的差异;用R 4.0.3软件corrplot工具包分析不同免疫细胞浸润相对含量之间的相关性;对免疫细胞浸润相对含量进行主成分分析。
1.3 免疫细胞亚群与预后分析结合从临床数据资料中提取的变量,首先整合免疫细胞含量矩阵和生存时间,采用log-rank检验对不同免疫细胞浸润相对含量进行生存分析,并绘制Kaplan-Meier曲线。同时,进一步分析不同免疫细胞浸润相对含量与肿瘤分期、分级的关系。通过单因素Cox分析,研究不同免疫细胞浸润相对含量与患者生存时间及状态之间的关系,通过多因素Cox分析构建预后风险评估模型。根据构建的预后风险评估模型,计算每例肺鳞状细胞癌患者的风险值并分为高、低风险两组,对两组患者进行生存分析。绘制ROC曲线,评价预后风险评估模型的效能。为进一步提高模型评估患者预后的能力,结合临床变量,绘制列线图,预测3、5、10年生存率。检验水准(α)为0.05。
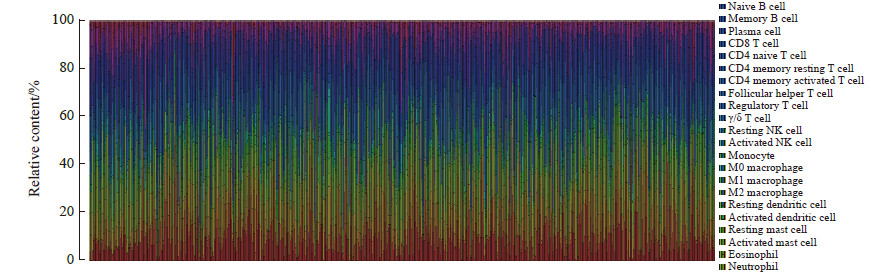
2 结果 2.1 免疫细胞浸润相对含量全景本研究共涉及22种免疫细胞的类型,包括初始B细胞、记忆性B细胞、浆细胞、CD8 T细胞、初始CD4 T细胞、休眠记忆CD4 T细胞、激活记忆CD4 T细胞、滤泡辅助性T细胞、调节性T细胞、γ/δ T细胞、休眠自然杀伤(natural killer,NK)细胞、激活NK细胞、单核细胞、M0型巨噬细胞、M1型巨噬细胞、M2型巨噬细胞、休眠树突状细胞、激活树突状细胞、休眠肥大细胞、激活肥大细胞、嗜酸性粒细胞、中性粒细胞。采用CIBERSORT反卷积算法估计每个样本中22种免疫细胞浸润相对含量,结果(图 1)显示495例样本之间22种免疫细胞浸润含量不同。22种免疫细胞在正常组织和肺鳞状细胞癌组织中浸润相对含量差异分析小提琴图(图 2)显示,初始B细胞、浆细胞、激活记忆CD4 T细胞、滤泡辅助性T细胞、调节性T细胞、M0型巨噬细胞、M1型巨噬细胞、休眠树突状细胞在正常组织中的浸润相对含量均低于肺鳞状细胞癌组织(P<0.05或P<0.01);休眠记忆CD4 T细胞、休眠NK细胞、单核细胞、M2型巨噬细胞、激活树突状细胞、休眠肥大细胞、嗜酸性粒细胞、中性粒细胞在正常组织中的浸润相对含量均高于肺鳞状细胞癌组织(P<0.01或P<0.05);记忆B细胞、CD8 T细胞、初始CD4 T细胞、γ/δ T细胞、激活NK细胞、激活肥大细胞在正常组织和肺鳞状细胞癌组织中的差异均无统计学意义(P均>0.05)。相关性分析结果(图 3)表明,22种免疫细胞浸润相对含量之间存在相关性。主成分分析结果(图 4)表明,免疫细胞浸润相对含量可以区分正常组织和肺鳞状细胞癌组织。
|
图 1 495例样本中22种免疫细胞浸润相对含量 Fig 1 Relative infiltration rates of 22 types of immune cells in 495 samples The abscissa is the tissue sample and the ordinate is the relative infiltration rate of immune cells. n=49 in normal tissues and n=446 in lung squamous cell carcinoma tissues. NK: Natural killer. |

|
图 2 22种免疫细胞在正常组织和肺鳞状细胞癌组织中浸润相对含量差异分析 Fig 2 Comparative analysis of relative infiltration rates of 22 types of immune cells in normal tissues and lung squamous cell carcinoma tissues Blue indicates normal tissues (n=49) and red indicates lung squamous cell carcinoma tissues (n=446). NK: Natural killer. |

|
图 3 22种免疫细胞浸润相对含量的相关性分析 Fig 3 Correlation analysis of relative infiltration rates of 22 types of immune cells A: Normal tissues (n=49); B: Lung squamous cell carcinoma tissues (n=446). NK: Natural killer. |

|
图 4 免疫细胞浸润相对含量主成分分析(PCA) Fig 4 Principal component analysis (PCA) of relative infiltration rates of the immune cells |
2.2 免疫细胞亚群与患者预后之间的关系
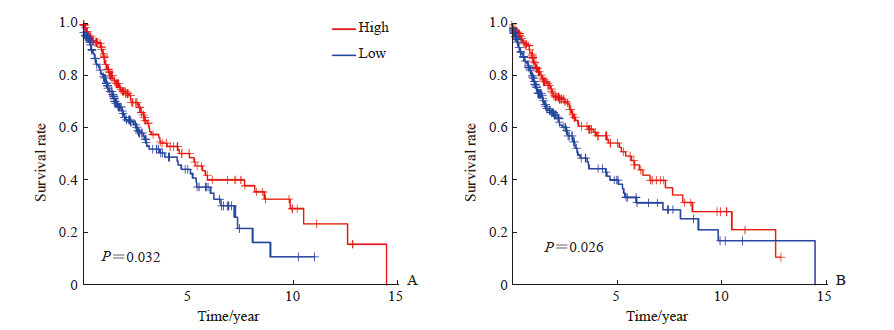
单因素Cox分析结果(表 1)显示,初始CD4 T细胞、休眠记忆CD4 T细胞、激活记忆CD4 T细胞、滤泡辅助性T细胞、休眠树突状细胞与肺鳞状细胞癌患者总生存期有关(P<0.05),其中初始CD4 T细胞、休眠记忆CD4 T细胞是危险因素(HR>1),而激活记忆CD4 T细胞、滤泡辅助性T细胞、休眠树突状细胞是保护因素(HR<1)。Kaplan-Meier生存分析结果(图 5)显示,激活记忆CD4 T细胞、休眠树突状细胞浸润含量高的肺鳞状细胞癌患者预后较含量低的患者好(P<0.05)。
|
|
表 1 肺鳞状细胞癌患者总生存率单因素Cox分析 Tab 1 Univariate Cox analysis of overall survival in patients with lung squamous cell carcinoma |
|
图 5 激活记忆CD4 T细胞(A)、休眠树突状细胞(B)浸润与肺鳞状细胞癌患者总生存期的Kaplan-Meier分析 Fig 5 Kaplan-Meier surival analysis of overall survival of patients with lung squamous cell carcinoma and infiltration of CD4 memory activated T cells (A) or resting dendritic cells (B) |
2.3 预后风险评估模型建立
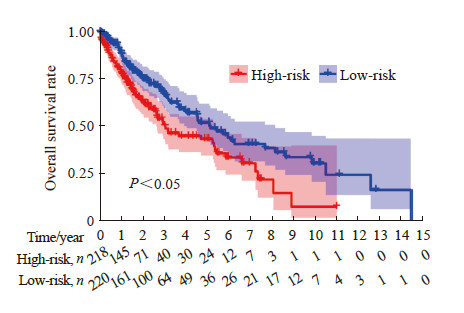
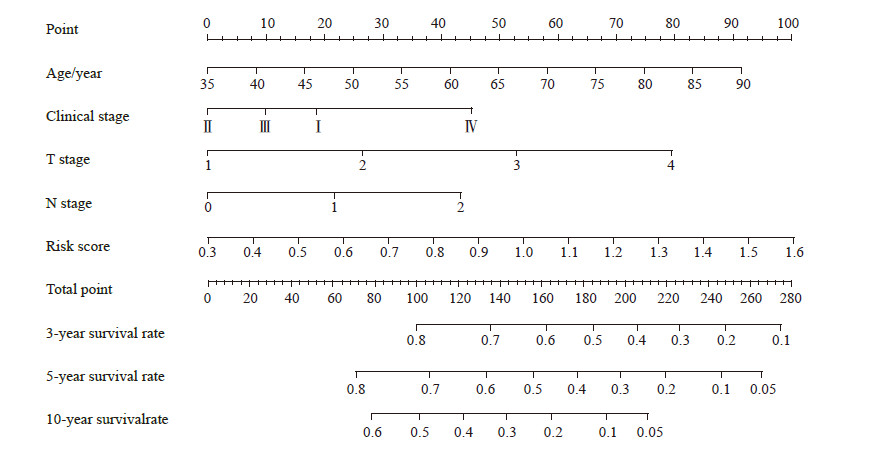
在单因素Cox分析基础上,利用多因素Cox分析建立肺鳞状细胞癌患者预后风险评估模型:风险值=0.070×激活记忆CD4 T细胞浸润相对含量+0.019×滤泡辅助性T细胞浸润相对含量+0.029×休眠树突状细胞浸润相对含量。根据患者的风险值将其分为高、低风险两组,生存分析结果(图 6)表明,低风险患者预后好于高风险患者(P<0.05)。为进一步评估模型效能,绘制了ROC曲线(图 7),AUC为0.678,表明预后风险评估模型效能良好。将风险值和临床因素结合,进行单因素和多因素Cox分析,结果(表 2)表明预后风险评估模型的风险值可以作为肺鳞状细胞癌患者的独立预后因子。结合风险评分和临床相关变量,肺鳞状细胞癌患者3、5、10年生存率列线图如图 8所示。
|
图 6 高风险组与低风险组肺鳞状细胞癌患者总生存期分析 Fig 6 Analysis of overall survival of patients with lung squamous cell carcinoma in high-risk and low-risk groups |

|
图 7 ROC曲线验证预后风险评估模型的预后价值 Fig 7 ROC curve verification of the prognostic value of the prognostic risk assessment model ROC: Receiver operating characteristic; AUC: Area under curve. |
|
|
表 2 临床因素与风险值评估预后的单因素和多因素Cox回归分析 Tab 2 Univariate and multivariate Cox regression analyses of clinical factors and risk score for assessing prognosis |
|
图 8 预测肺鳞状细胞癌患者3、5、10年生存率列线图 Fig 8 Nomograph for predicting 3-, 5-, and 10-year survival rates in patients with lung squamous cell carcinoma |
3 讨论
近年来,以免疫检查点为靶点的免疫疗法被应用于多种恶性肿瘤的治疗,如肺癌、膀胱癌、乳腺癌、胆管癌等[19-24]。研究表明,免疫细胞浸润与肿瘤分期、分级、预后等临床特征有关,而基于免疫细胞浸润的聚类分析有利于治疗策略的选择[5, 25-26]。
既往研究多采用免疫组织化学染色和流式细胞术研究肿瘤组织中免疫细胞浸润情况,但这2种方法均存在局限性[27-28]。免疫组织化学染色依赖细胞蛋白标记来识别免疫细胞亚群,该方法只能识别少数免疫细胞亚群,由于此类蛋白标记也存在于其他细胞中,因此研究结果会存在一定程度的偏倚。而流式细胞术依赖多种蛋白标记物分析免疫细胞类型,但会受到荧光通道的限制。CIBERSORT是一种基于基因表达数据的复杂的反卷积算法,其以高分辨率而闻名。该算法经流式细胞术验证,已应用于多种肿瘤组织中免疫细胞浸润图景的研究[5, 18, 25, 28]。
我们从TCGA数据库中获得了肺鳞状细胞癌全转录组数据和相应患者的临床信息,并通过CIBERSORT反卷积算法计算出每个样本中22种免疫细胞的含量,经过1 000次运算模拟剔除了差异无统计学意义的数据。我们发现每个样本中22种免疫细胞浸润相对含量均不同。22种免疫细胞中,有8种免疫细胞(初始B细胞、浆细胞、激活记忆CD4 T细胞、滤泡辅助性T细胞、调节性T细胞、M0型巨噬细胞、M1型巨噬细胞、休眠树突状细胞)在肺鳞状细胞癌组织中浸润相对含量均高于正常组织(P<0.05或P<0.01),另有8种免疫细胞(休眠记忆CD4 T细胞、休眠NK细胞、单核细胞、M2型巨噬细胞、激活树突状细胞、休眠肥大细胞、嗜酸性粒细胞、中性粒细胞)在正常组织中的浸润相对含量均高于肺鳞状细胞癌组织(P<0.01或P<0.05),其余免疫细胞在正常组织与肺鳞状细胞癌组织中的差异无统计学意义(P均>0.05)。因此,可以认为免疫细胞与肿瘤的发生有关。
相关性分析和主成分分析结果表明,免疫细胞浸润相对含量存在聚类偏倚和个体差异。我们认为免疫细胞浸润相对含量是样本的本质特征,表征个体差异性。这与之前其他肿瘤中的研究结果[29-32]相符。通过单因素Cox分析和生存分析,探索了22种免疫细胞浸润相对含量与肺鳞状细胞癌患者总生存率的关系。许多研究均表明,免疫细胞浸润相对含量与患者预后相关。本研究发现初始CD4 T细胞、休眠记忆CD4 T细胞为预后危险因素(HR>1),而激活记忆CD4 T细胞、滤泡辅助性T细胞、休眠树突状细胞为预后保护因素(HR<1),认为免疫细胞浸润与患者预后有关。在此基础上,通过多因素Cox回归分析建立了肺鳞状细胞癌患者预后风险评估模型,ROC曲线分析结果显示AUC为0.678,表明该风险评估模型效能良好。
本研究也存在一些局限性。第一,肺鳞状细胞癌患者预后生存风险评估模型缺少外部验证;第二,研究结果需要进一步在肺癌患者临床病理样本中验证各个免疫细胞侵润对肺磷状细胞癌患者预后的影响;第三,受限于TCGA数据库的临床资料,本研究结合风险值与相关临床因素绘制列线图存在一定偏倚。
综上所述,免疫细胞浸润相对含量是肿瘤组织的本质特征,表征个体差异性,与肿瘤的发生、预后密切相关;激活记忆CD4 T细胞、休眠树突状细胞可以作为肺鳞状细胞癌的独立预后因子。该结果有助于评估患者预后,进一步探索免疫细胞浸润的驱动力,发现新的治疗靶点。
| [1] |
高鸣, 周清. 晚期肺鳞癌治疗进展[J]. 中国肺癌杂志, 2020, 23: 866-874. DOI:10.3779/j.issn.1009-3419.2020.101.35 |
| [2] |
SUNG H, FERLAY J, SIEGEL R L, LAVERSANNE M, SOERJOMATARAM I, JEMAL A, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J/OL]. CA Cancer J Clin, 2021. DOI: 10.3322/caac.21660.
|
| [3] |
李伟, 王兆松, 董秋萍, 徐玥, 陈永孜, 许世磊. 肺鳞癌中miR-144靶基因预测及其生物信息学分析[J]. 天津医科大学学报, 2018, 24: 287-290. |
| [4] |
MENG X, LU H, JIANG X, HUANG B, WU S, YU G, et al. Understanding the molecular association between hyperkalemia and lung squamous cell carcinomas[J/OL]. BMC Med Genet, 2020, 21(Suppl 1): 176. DOI: 10.1186/s12881-020-01099-7.
|
| [5] |
XIONG Y, WANG K, ZHOU H, PENG L, YOU W, FU Z. Profiles of immune infiltration in colorectal cancer and their clinical significant: a gene expression-based study[J]. Cancer Med, 2018, 7: 4496-4508. DOI:10.1002/cam4.1745 |
| [6] |
NAKAMURA K, SMYTH M J. Myeloid immunosuppression and immune checkpoints in the tumor microenvironment[J]. Cell Mol Immunol, 2020, 17: 1-12. DOI:10.1038/s41423-019-0306-1 |
| [7] |
HARGADON K M, JOHNSON C E, WILLIAMS C J. Immune checkpoint blockade therapy for cancer: an overview of FDA-approved immune checkpoint inhibitors[J]. Int Immunopharmacol, 2018, 62: 29-39. DOI:10.1016/j.intimp.2018.06.001 |
| [8] |
LOMBARDO S D, BRAMANTI A, CIURLEO R, BASILE M S, PENNISI M, BELLA R, et al. Profiling of inhibitory immune checkpoints in glioblastoma: potential pathogenetic players[J/OL]. Oncol Lett, 2020, 20: 332. DOI: 10.3892/ol.2020.12195.
|
| [9] |
张雯, 宋启斌. 肺癌免疫治疗超进展的研究进展[J]. 中国医药导报, 2020, 17: 58-61. |
| [10] |
PANT A, MEDIKONDA R, LIM M. Alternative checkpoints as targets for immunotherapy[J/OL]. Curr Oncol Rep, 2020, 22: 126. DOI: 10.1007/s11912-020-00983-y.
|
| [11] |
曾林梅, 龙金华, 金风. 树突状细胞在肿瘤免疫治疗中的临床应用进展[J]. 医学综述, 2020, 26: 4629-4633, 4642. DOI:10.3969/j.issn.1006-2084.2020.23.010 |
| [12] |
许阳阳, 展平, 宋勇. 小细胞肺癌免疫治疗的临床研究进展[J]. 中国肺癌杂志, 2020, 23: 989-998. DOI:10.3779/j.issn.1009-3419.2020.105.02 |
| [13] |
BREMNES R M, AL-SHIBLI K, DONNEM T, SIRERA R, AL-SAAD S, ANDERSEN S, et al. The role of tumor-infiltrating immune cells and chronic inflammation at the tumor site on cancer development, progression, and prognosis: emphasis on non-small cell lung cancer[J]. J Thorac Oncol, 2011, 6: 824-833. DOI:10.1097/JTO.0b013e3182037b76 |
| [14] |
HILMI M, VIENOT A, ROUSSEAU B, NEUZILLET C. Immune therapy for liver cancers[J/OL]. Cancers (Basel), 2019, 12: 77. DOI: 10.3390/cancers12010077.
|
| [15] |
GANATRA S, PARIKH R, NEILAN T G. Cardiotoxicity of immune therapy[J]. Cardiol Clin, 2019, 37: 385-397. DOI:10.1016/j.ccl.2019.07.008 |
| [16] |
DALVIN L A, SHIELDS C L, ORLOFF M, SATO T, SHIELDS J A. CHECKPOINT INHIBITOR IMMUNE THERAPY: systemic indications and ophthalmic side effects[J]. Retina, 2018, 38: 1063-1078. DOI:10.1097/IAE.0000000000002181 |
| [17] |
GOMEZ S, TABERNACKI T, KOBYRA J, ROBERTS P, CHIAPPINELLI K B. Combining epigenetic and immune therapy to overcome cancer resistance[J]. Semin Cancer Biol, 2020, 65: 99-113. DOI:10.1016/j.semcancer.2019.12.019 |
| [18] |
CHEN B, KHODADOUST M S, LIU C L, NEWMAN A M, ALIZADEH A A. Profiling tumor infiltrating immune cells with CIBERSORT[J]. Methods Mol Biol, 2018, 1711: 243-259. |
| [19] |
PORPORATO P E, FILIGHEDDU N, PEDRO J M B, KROEMER G, GALLUZZI L. Mitochondrial metabolism and cancer[J]. Cell Res, 2018, 28: 265-280. DOI:10.1038/cr.2017.155 |
| [20] |
PICARDO S L, COBURN B, HANSEN A R. The microbiome and cancer for clinicians[J]. Crit Rev Oncol Hematol, 2019, 141: 1-12. DOI:10.1016/j.critrevonc.2019.06.004 |
| [21] |
PATEL C H, LEONE R D, HORTON M R, POWELL J D. Targeting metabolism to regulate immune responses in autoimmunity and cancer[J]. Nat Rev Drug Discov, 2019, 18: 669-688. DOI:10.1038/s41573-019-0032-5 |
| [22] |
FU H C, ZHU Y, WANG Y W, LIU Z, ZHANG J Y, XIE H Y, et al. Identification and validation of stromal immunotype predict survival and benefit from adjuvant chemotherapy in patients with muscle-invasive bladder cancer[J]. Clin Cancer Res, 2018, 24: 3069-3078. DOI:10.1158/1078-0432.CCR-17-2687 |
| [23] |
赵伟鹏, 孙琳琳, 佟仲生. 三阴性乳腺癌的免疫治疗研究进展[J]. 天津中医药, 2020, 37: 1309-1315. DOI:10.11656/j.issn.1672-1519.2020.11.23 |
| [24] |
陈璐, 宋天强, 李强. 晚期胆道系统肿瘤免疫治疗研究进展[J]. 中国实用外科杂志, 2020, 40: 1340-1344. |
| [25] |
MAIBACH F, SADOZAI H, SEYED JAFARI S M, HUNGER R E, SCHENK M. Tumor-infiltrating lymphocytes and their prognostic value in cutaneous melanoma[J/OL]. Front Immunol, 2020, 11: 2105. DOI: 10.3389/fimmu.2020.02105.
|
| [26] |
ALI H R, CHLON L, PHAROAH P D, MARKOWETZ F, CALDAS C. Patterns of immune infiltration in breast cancer and their clinical implications: a gene-expression-based retrospective study[J/OL]. PLoS Med, 2016, 13: e1002194. DOI: 10.1371/journal.pmed.1002194.
|
| [27] |
GENTLES A J, NEWMAN A M, LIU C L, BRATMAN S V, FENG W, KIM D, et al. The prognostic landscape of genes and infiltrating immune cells across human cancers[J]. Nat Med, 2015, 21: 938-945. DOI:10.1038/nm.3909 |
| [28] |
KARPINSKI P, ROSSOWSKA J, SASIADEK M M. Immunological landscape of consensus clusters in colorectal cancer[J]. Oncotarget, 2017, 8: 105299-105311. DOI:10.18632/oncotarget.22169 |
| [29] |
WANG Z Z, YUAN H B, HUANG J, HU D X, QIN X, SUN C Y, et al. Prognostic value of immune-related genes and immune cell infiltration analysis in the tumor microenvironment of head and neck squamous cell carcinoma[J]. Head Neck, 2021, 43: 182-197. DOI:10.1002/hed.26474 |
| [30] |
HUANG R Z, ZENG Z W, YAN P H, YIN H B, ZHU X L, HU P, et al. Targeting lymphotoxin beta and paired box 5: a potential therapeutic strategy for soft tissue sarcoma metastasis[J/OL]. Cancer Cell Int, 2021, 21: 3. DOI: 10.1186/s12935-020-01632-x.
|
| [31] |
潘静, 连慧娟. 多种抗肿瘤免疫效应细胞联合治疗中晚期结直肠癌的效果分析[J]. 临床研究, 2021, 29: 25-27. |
| [32] |
徐佩, 关海霞. 分化型甲状腺癌组织中浸润免疫细胞的类型及其与临床特征的关系[J]. 现代肿瘤医学, 2021, 29: 397-402. DOI:10.3969/j.issn.1672-4992.2021.03.007 |
 2021, Vol. 42
2021, Vol. 42


