2. 上海交通大学医学院附属瑞金医院重症医学科, 上海 200025;
3. 海军军医大学(第二军医大学)基础医学院生物物理教研室, 上海 200433
2. Department of Critical Care Medicine, Ruijin Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200025, China;
3. Department of Biophysics, College of Basic Medical Sciences, Naval Medical University (Second Military Medical University), Shanghai 200433, China
脓毒症是针对感染的宿主反应失调进而导致危及生命的器官功能障碍综合征,根据最新的指南定义,对于感染或疑似感染的患者, 当脓毒症相关序贯器官衰竭评价[equential (sepsis-related) organ failure assessment,SOFA]评分较基线上升≥2分可诊断为脓毒症[1]。脓毒症发病率很高,是全球范围内主要的死亡原因之一[2]。但是,脓毒症的发病率仍可能被严重低估,并且随着人口的老龄化将继续增加[3]。2011年美国脓毒症患者的医疗支出超过200亿美元,占据了当年全美国医疗支出的5.2%[1]。
脓毒症的特征是宿主对感染的全身反应失调。当高度保守的微生物病原体相关分子模式(pathogen-associated molecular pattern,PAMP)被先天免疫细胞上的模式识别受体(包括Toll样受体)识别时,感染的免疫应答途径即被激活。在这一过程中释放的大量细胞因子(如TNF-α、IL-1、IL-2、IL-6、IL-8等)引起中性粒细胞-内皮细胞黏附,激活补体和凝血级联反应,可能导致微血栓形成[4]。
在脓毒症的病理生理过程中,过度的炎症因子反应被认为是关键因素[1],因此,本课题组设想通过阻断感染引起的炎症因子风暴预防和治疗脓毒症。高迁移率族蛋白1(high mobility group box-1,HMGB1)是一种典型的损伤相关分子模式(damage-associated molecular pattern,DAMP),研究报道其与许多炎症性疾病有关,可使用HMGB1抗体中和细胞外HMGB1,从而阻断HMGB1介导的脂多糖入胞及后续的炎症因子风暴[5]。Newman等[6]报道,向脓毒症小鼠腹腔多次注射HMGB1抗体可有效提高脓毒症小鼠的生存率,并降低血清TNF-α水平,不过这种治疗方法是通过多次腹腔注射给药的,并不能保证血清中抗体的有效治疗浓度。因此,本课题组设想利用腺相关病毒(adeno-associated virus,AAV)载体在体内持续表达HMGB1抗体,通过保持高水平的血清HMGB1抗体浓度而强化治疗效应,这或许是预防和治疗脓毒症的新方法。
1 材料和方法 1.1 实验动物与分组60只雌性C57小鼠(体重18~22 g)购自上海吉辉实验动物饲养有限公司[实验动物生产许可证号SCXK(沪)2017-0012]。将小鼠饲养在SPF级动物房,并无限制提供无菌水和标准小鼠食物[实验动物使用许可证号SYXK(沪)2017-0004]。所有实验方案均已得到海军军医大学(第二军医大学)动物实验伦理委员会批准,所有动物实验程序均按照海军军医大学(第二军医大学)动物护理和使用委员会《实验室动物的护理和使用指南》进行。将小鼠随机分为2批,每批30只,第1批用于观察生存情况并绘制生存曲线;第2批用于收集器官标本制作病理切片,并收集血清用于血清炎症因子检测。每批小鼠随机分为3组:AAV-HMGB1抗体组、AAV-对照-IgG组、生理盐水组,每组10只。
1.2 AAV9载体构建和病毒注射化学合成HMGB1抗体的开放阅读框,然后将DNA插入片段重新克隆到AAV载体中,得到AAV-HMGB1抗体质粒。将增强绿色荧光蛋白(enhanced green fluorescent protein,EGFP)基因融合到HMGB1抗体羧基末端,得到AAV-HMGB1抗体-EGFP载体。培养293T细胞,待细胞融合度达到80%~90%时进行转染。使用pAAV-RC、pHelper和穿梭质粒(携带HMGB1抗体基因的载体质粒)与293T细胞进行共转染,转染后72 h,通过反复冻融的方法破碎含有AAV颗粒的细胞,收集含有AAV颗粒的上清,然后进行核酸酶处理、过柱纯化、超滤纯化,通过qRT-PCR方法进行病毒滴度判定[7-10]。AAV-对照-IgG的构建方法同上。测得各病毒载体滴度如下:AAV-HMGB1抗体-L链滴度为3.5×1012 copy/mL,AAV-HMGB1抗体-H链滴度为3.0×1012 copy/mL,AAV-对照-IgG-L链滴度为3.2×1012 copy/mL,AAV-对照-IgG-H链滴度为3.8×1012 copy/mL。
取AAV-HMGB1抗体-L链和AAV-HMGB1抗体-H链病毒原液各600 μL,等比例混合成1 200 μL的混合液,对AAV-HMGB1抗体组小鼠进行左侧股直肌原位三点注射,每点20 μL,每只小鼠共注射病毒混合液60 μL。取AAV-对照-IgG-L链和AAV-对照-IgG-H链病毒原液各600 μL,等比例混合成1 200 μL的混合液,对AAV-对照-IgG组小鼠进行左侧股直肌原位三点注射,注射位置、剂量同AAV-HMGB1抗体组[11]。生理盐水组小鼠予左侧股直肌原位三点注射60 μL生理盐水。
1.3 脓毒症小鼠模型的建立腺病毒在肌内注射4~8周可达最高表达丰度,HMGB1抗体及对照-IgG水平达最大血清浓度[12]。故在小鼠肌内注射AAV-HMGB1抗体、AAV-对照-IgG、生理盐水4周后,进行盲肠结扎穿孔制造脓毒症小鼠模型。术前常规对小鼠进行麻醉、插管、接呼吸器、腹部备皮、消毒。在腹正中线逐层切开至腹膜,切口长约1.5 cm,充分暴露盲肠,于盲肠中点结扎盲肠,然后从肠系膜方向向对侧用细针对穿盲肠,挤出少量粪便(由同一人完成以确保粪便量相同),然后回纳盲肠,关闭腹腔,逐层缝合腹膜、肌肉及皮肤,于背部皮下注射生理盐水0.5 mL,拔管并将小鼠放回笼中[13]。
1.4 小鼠存活率在盲肠结扎穿孔造模后对3组小鼠(每组10只)进行生存研究。将小鼠放归SPF级动物房,不限制进食及饮水。连续14 d监测小鼠的存活情况,根据实际结果绘制生存曲线。
1.5 组织病理学观察在盲肠结扎穿孔造模后即开始关注小鼠情况,及时收集死亡小鼠注射部位的肌肉组织及心、肝、肺、肾、肠组织。将收集到的组织标本浸入4 ℃ 4%多聚甲醛溶液中,24 h后取出恢复至室温并放入脱水盒,然后放入Leica组织快速脱水机吊篮内依次梯度乙醇脱水。脱水结束后,取出组织脱水盒并石蜡包埋。先将组织包埋机内少量融化石蜡倒入金属包埋框,取出脱水盒中的组织放于包埋框底部,在冷冻台上停留1~2 s,使底部石蜡遇冷凝固,固定组织位置,然后将包埋框装满融化的石蜡,将脱水盒含标签的一面放置在脱水框上,最后静置于冷冻台直至石蜡完全凝固。将组织石蜡块固定于组织切片机进行切片,层厚5~6 μm。用镊子和毛笔协助将切好的组织蜡片平放于约40 ℃的恒温水面,待其平摊展开后用载玻片将石蜡切片从水中捞起,使其平贴于有标记的载玻片上,将载玻片斜放于62 ℃烤箱中1 h。使用荧光显微镜观察肌肉组织切片的绿色荧光。其他组织切片按常规流程进行H-E染色,流水冲洗后晾干切片。晾干后的切片滴上树胶,盖上盖玻片,自然风干后放置于显微镜下,观察各脏器组织的微观结构变化及炎症细胞浸润情况。
1.6 炎症因子检测死亡小鼠于死亡前、存活小鼠于盲肠结扎穿孔造模后第7天通过眼眶静脉取血的方式留取血清样本,采用ELISA方法进行炎症细胞因子测量。HMGB1、HMGB1抗体、IL-6、IL-1β、TNF-α的ELISA检测试剂盒均购自上海西塘生物有限公司,所有操作步骤均按照说明书进行。
1.7 统计学处理应用SPSS 20.0软件进行统计学分析。不符合正态分布的计量资料以中位数(下四分位数,上四分位数)表示,多组间比较采用Kruskal-Wallis H检验,两两比较采用Mann-Whitney U检验。生存曲线分析采用Kaplan-Meier法,组间比较采用log-rank检验。检验水准(α)为0.05。
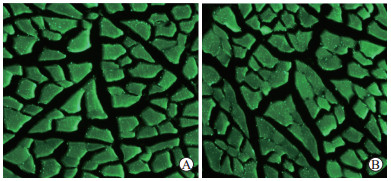
2 结果 2.1 各组小鼠血清中HMGB1和HMGB1抗体浓度如图 1所示,肌内注射AAV-HMGB1抗体及AAV-对照-IgG 4周后,肌肉组织可见明显的GFP表达,说明HMGB1抗体及对照-IgG已在肌肉细胞中大量表达。此时,检测小鼠血清中HMGB1抗体及HMGB1水平,结果(表 1)显示,AAV-HMGB1抗体组小鼠血清中HMGB1水平低于生理盐水组和AAV-对照-IgG组,差异均有统计学意义(P均<0.01);AAV-HMGB1抗体组小鼠血清中HMGB1抗体水平高于生理盐水组和AAV-对照-IgG组,差异均有统计学意义(P均<0.01),说明肌内注射AAV-HMGB1抗体病毒可提高小鼠血清HMGB1抗体浓度,相应地导致小鼠血清HMGB1浓度降低。
|
图 1 小鼠肌肉组织切片绿色荧光观察(200×) Fig 1 Green fluorescence observation of mouse muscle tissue sections (200×) A: AAV-HMGB1 antibody group; B: AAV-control-IgG group. AAV: Adeno-associated virus; HMGB1: High mobility group box-1; IgG: Immunoglobulin G. |
|
|
表 1 ELISA检测各组小鼠血清HMGB1、HMGB1抗体及炎症因子水平 Tab 1 Serum levels of HMGB1, HMGB1 antibody, and inflammatory cytokines of mice in each group detected by ELISA |
2.2 预先肌注AAV-HMGB1抗体病毒对脓毒症小鼠存活率的影响
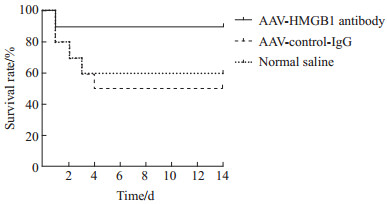
见图 2,生理盐水组有60%(6/10)的小鼠存活到造模后第14天,AAV-对照-IgG组有50%(5/10)的小鼠存活到造模后第14天,而AAV-HMGB1抗体组有90%(9/10)的小鼠存活到造模后第14天,但log-rank分析结果显示AAV-HMGB1抗体组、AAV-对照-IgG组、生理盐水组3组小鼠存活率差异无统计学意义(χ2=1.87,P=0.172)。
|
图 2 3组小鼠盲肠结扎穿孔造模后Kaplan-Meier生存曲线 Fig 2 Kaplan-Meier survival curves of mice after cecal ligation and perforation in 3 groups AAV: Adeno-associated virus; IgG: Immunoglobulin G; HMGB1: High mobility group box-1. |
2.3 高浓度HMGB1抗体的器官保护效应
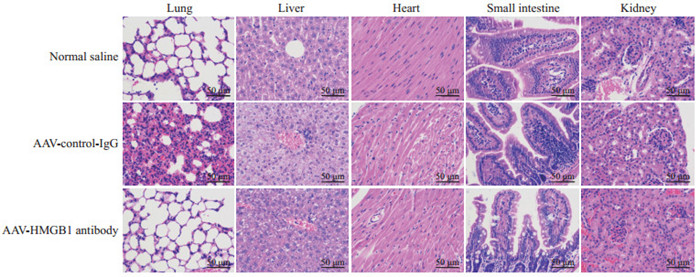
生理盐水组、AAV-对照-IgG组小鼠肺组织表现出明显的肺泡壁增厚、间质出血、慢性淋巴细胞浸润、肺上皮受炎症刺激及轻度不典型增生性改变;而AAV-HMGB1抗体组小鼠肺组织淋巴细胞浸润、间质出血等炎症改变较少(图 3)。
|
图 3 苏木精-伊红染色观察AAV-HMGB1抗体病毒肌内注射后脓毒症小鼠器官组织的病理学变化 Fig 3 Histology of the organs in septic mice after intramuscular injection of AAV-HMGB1 antibody virus detected by hematoxylin-eosin staining AAV: Adeno-associated virus; IgG: Immunoglobulin G; HMGB1: High mobility group box-1. |
AAV-对照-IgG组小鼠的肝脏组织可见脂肪变性、细胞排列紊乱、细胞轻度异型性改变,心肌细胞呈轻度退行性改变、间质散在少量淋巴细胞浸润;生理盐水组肝脏和心肌组织结构变化不明显,未见明显炎症细胞浸润及功能细胞的病理改变;AAV-HMGB1抗体组小鼠肝脏脂肪变性较AAV-对照-IgG组少,炎症细胞及淋巴细胞浸润程度与生理盐水组相似,心肌病理切片可见轻微淋巴细胞浸润(图 3)。
生理盐水组、AAV-对照-IgG组小肠组织较AAV-HMGB1抗体组表现出轻度增多的淋巴细胞浸润。生理盐水组肾脏组织可见部分肾小球细胞不典型改变,间质有少量淋巴细胞浸润;AAV-对照-IgG组和AAV-HMGB1抗体组肾小球结构完整,炎症细胞浸润较少(图 3)。由此可见,通过AAV-HMGB1抗体基因转导产生的HMGB1抗体对脓毒症小鼠的肺组织有明显保护作用,但对心、肝、肾、肠等脏器的保护作用不明显。
2.4 高浓度HMGB1抗体抑制炎症细胞因子的爆发见表 1,AAV-HMGB1抗体组小鼠血清中IL-6、IL-1β浓度低于生理盐水组和AAV-对照-IgG组,差异均有统计学意义(P均<0.01);AAV-HMGB1抗体组小鼠血清中TNF-α水平低于生理盐水组,差异有统计学意义(P<0.05)。
3 讨论尽管抗生素对控制感染有一定的作用,但无法中和血液中的内毒素及其他重要炎症因子,因此抗体疗法为治疗全身感染提供了一个新的思路[14-15]。有研究者尝试使用抗内毒素抗体进行脓毒症治疗,发现人的脂多糖核心抗体可以大大降低革兰阴性菌血症患者的死亡率[16]。但是该抗体治疗仅对革兰阴性菌有效,对其他感染引起的脓毒症无效。感染导致的炎症因子风暴是脓毒症组织损伤和死亡的重要病理生理基础[17]。因此脓毒症患者亟需一种可以有效阻断感染引起的炎症因子风暴的治疗方法。既往有采用针对IL-1、TNF-α等炎症因子的药物或抗体治疗脓毒症的研究[18],但以失败告终。这些炎症因子都处于炎症因子瀑布的下游,因此本研究设想早期针对炎症因子风暴进行干预可能会获得较好的治疗效果。研究报道HMGB1蛋白在脓毒症炎症因子风暴的上游扮演了重要角色[19],且抑制HMGB1可有效地抑制炎症因子的释放并保护器官功能[20-21]。因此本课题组提出使用病毒载体搭载HMGB1抗体编码序列预防和治疗脓毒症的全新脓毒症抗体疗法,相较于针对炎症因子风暴下游单一因子的治疗,该方案可持续产生高浓度的HMGB1抗体而有针对地阻断HMGB1的信号转导和后续的炎症因子风暴,有更高的特异性和靶向性,可以有效地治疗脓毒症。
本研究通过肌内注射搭载HMGB1抗体编码序列的AAV载体,使小鼠体内HMGB1抗体浓度逐渐升高,4周后HMGB1抗体浓度达高峰时采用盲肠结扎穿孔制造脓毒症模型,评估HMGB1抗体治疗脓毒症的效果。结果显示持续抑制HMGB1可以显著降低脓毒症小鼠的高死亡率,并对脓毒症小鼠的肺组织有明显保护作用,这进一步证实小鼠体内的HMGB1可能在脓毒症感染中发挥重要作用。在脓毒症小鼠中观察到IL-1β、IL-6、TNF-α的爆发[22],本研究发现阻断HMGB1抑制了这些炎症因子的过度产生,这与HMGB1抗体治疗的小鼠后脏器损伤减轻和死亡率相对较低一致。NF-κB信号通路是感染过程中炎症细胞因子分泌和炎症细胞募集的关键因素,有研究在炎症细胞模型中观察到NF-κB信号通路和Toll样受体的显著激活[23]。HMGB1抗体治疗脓毒症是否与抑制NF-κB信号通路相关尚不清楚,且HMGB1抗体治疗脓毒症的具体机制尚需进一步研究,使用AAV感染产生抗体可以在血液中维持高浓度HMGB1抗体的周期还不清楚,这些问题将在未来的工作中进行探讨。
总之,使用HMGB1抗体阻断HMGB1可抑制脓毒症小鼠的炎症性病理改变、降低死亡率,这些作用可能归因于细胞因子风暴的抑制、炎症细胞浸润的减少,因此,将肌内注射AAV-HMGB1抗体与抗生素策略结合使用可能是一种有效对抗脓毒症的方法。本研究是病毒载体搭载HMGB1抗体编码序列治疗脓毒症的首次尝试,更多细节有待进一步阐明,如HMGB1抗体对传统的脂多糖与HMGB1结合入胞激活TLR4信号通路系统的作用[17]、HMGB1抗体对细胞焦亡[24]和炎症小体产生及释放的影响等问题。
| [1] |
SINGER M, DEUTSCHMAN C S, SEYMOUR C W, SHANKAR-HARI M, ANNANE D, BAUER M, et al. The third international consensus definitions for sepsis and septic shock (sepsis-3)[J]. JAMA, 2016, 315: 801-810. DOI:10.1001/jama.2016.0287 |
| [2] |
FLEISCHMANN C, SCHERAG A, ADHIKARI N K, HARTOG C S, TSAGANOS T, SCHLATTMANN P, et al. Assessment of global incidence and mortality of hospital-treated sepsis. Current estimates and limitations[J]. Am J Respir Crit Care Med, 2016, 193: 259-272. DOI:10.1164/rccm.201504-0781OC |
| [3] |
CECCONI M, EVANS L, LEVY M, RHODES A. Sepsis and septic shock[J]. Lancet, 2018, 392: 75-87. DOI:10.1016/S0140-6736(18)30696-2 |
| [4] |
GOTTS J E, MATTHAY M A. Sepsis: pathophysiology and clinical management[J/OL]. BMJ, 2016, 353: i1585. DOI: 10.1136/bmj.i1585.
|
| [5] |
ANDERSSON U, YANG H, HARRIS H. Extracellular HMGB1 as a therapeutic target in inflammatory diseases[J]. Expert Opin Ther Targets, 2018, 22: 263-277. DOI:10.1080/14728222.2018.1439924 |
| [6] |
NEWMAN W, QIN S, O'KEEFE T, OBAR R. Monoclonal antibodies against HMGB1: US 2009/0148453 A1[P]. 2009-06-11.
|
| [7] |
HAUSWIRTH W W, LEWIN A S, ZOLOTUKHIN S, MUZYCZKA N. Production and purification of recombinant adeno-associated virus[J]. Methods Enzymol, 2000, 316: 743-761. |
| [8] |
VELDWIJK M R, TOPALY J, LAUFS S, HENGGE U R, WENZ F, ZELLER W J, et al. Development and optimization of a real-time quantitative PCR-based method for the titration of AAV-2 vector stocks[J]. Mol Ther, 2002, 6: 272-278. DOI:10.1006/mthe.2002.0659 |
| [9] |
HU S, DAI H, LI T, TANG Y, FU W, YUAN Q, et al. Broad RTK-targeted therapy overcomes molecular heterogeneity-driven resistance to cetuximab via vectored immunoprophylaxis in colorectal cancer[J]. Cancer Lett, 2016, 382: 32-43. DOI:10.1016/j.canlet.2016.08.022 |
| [10] |
GOEHRINGER C, RUTSCHOW D, BAUER R, SCHINKEL S, WEICHENHAN D, BEKEREDJIAN R, et al. Prevention of cardiomyopathy in delta-sarcoglycan knockout mice after systemic transfer of targeted adeno-associated viral vectors[J]. Cardiovasc Res, 2009, 82: 404-410. DOI:10.1093/cvr/cvp061 |
| [11] |
WEI Y, CHEN Y, QIU Y, ZHAO H, LIU G, ZHANG Y, et al. Prevention of muscle wasting by CRISPR/Cas9-mediated disruption of myostatin in vivo[J]. Mol Ther, 2016, 24: 1889-1891. DOI:10.1038/mt.2016.192 |
| [12] |
CHALLIS R C, RAVINDRA KUMAR S, CHAN K Y, CHALLIS C, BEADLE K, JANG M J, et al. Systemic AAV vectors for widespread and targeted gene delivery in rodents[J]. Nat Protoc, 2019, 14: 379-414. DOI:10.1038/s41596-018-0097-3 |
| [13] |
RITTIRSCH D, HUBER-LANG M S, FLIERL M A, WARD P A. Immunodesign of experimental sepsis by cecal ligation and puncture[J]. Nat Protoc, 2009, 4: 31-36. DOI:10.1038/nprot.2008.214 |
| [14] |
BRAUDE A I, DOUGLAS H. Passive immunization against the local Shwartzman reaction[J]. J Immunol, 1972, 108: 505-512. |
| [15] |
SHAW WARREN H, AMATO S F, FITTING C, BLACK K M, LOISELLE P M, PASTERNACK M S, et al. Assessment of ability of murine and human anti-lipid a monoclonal antibodies to bind and neutralize lipopolysaccharide[J]. J Exp Med, 1993, 177: 89-97. DOI:10.1084/jem.177.1.89 |
| [16] |
ZIEGLER E J, MCCUTCHAN J A, FIERER J, GLAUSER M P, SADOFF J C, DOUGLAS H, et al. Treatment of Gram-negative bacteremia and shock with human antiserum to a mutant Escherichia coli[J]. N Engl J Med, 1982, 307: 1225-1230. DOI:10.1056/NEJM198211113072001 |
| [17] |
XIU G, SUN J, LI X, JIN H, ZHU Y, ZHOU X, et al. The role of HMGB1 in BMSC transplantation for treating MODS in rats[J]. Cell Tissue Res, 2018, 373: 395-406. DOI:10.1007/s00441-018-2823-0 |
| [18] |
FINK M P, WARREN H S. Strategies to improve drug development for sepsis[J]. Nat Rev Drug Discov, 2014, 13: 741-758. DOI:10.1038/nrd4368 |
| [19] |
WANG H, WARD M F, SAMA A E. Targeting HMGB1 in the treatment of sepsis[J]. Expert Opin Ther Targets, 2014, 18: 257-268. DOI:10.1517/14728222.2014.863876 |
| [20] |
ZHAO F, FANG Y, DENG S, LI X, ZHOU Y, GONG Y, et al. Glycyrrhizin protects rats from sepsis by blocking HMGB1 signaling[J/OL]. Biomed Res Int, 2017, 2017: 9719647. DOI: 10.1155/2017/9719647.
|
| [21] |
HUNG Y L, FANG S H, WANG S C, CHENG W C, LIU P L, SU C C, et al. Corylin protects LPS-induced sepsis and attenuates LPS-induced inflammatory response[J/OL]. Sci Rep, 2017, 7: 46299. DOI: 10.1038/srep46299.
|
| [22] |
JI Z R, XUE W L, ZHANG L. Schisandrin B attenuates inflammation in LPS-induced sepsis through miR-17-5p downregulating TLR4[J]. Inflammation, 2019, 42: 731-739. DOI:10.1007/s10753-018-0931-3 |
| [23] |
LI L, CHEN J, LIN L, PAN G, ZHANG S, CHEN H, et al. Quzhou Fructus aurantii extract suppresses inflammation via regulation of MAPK, NF-κB, and AMPK signaling pathway[J/OL]. Sci Rep, 2020, 10: 1593. DOI: 10.1038/s41598-020-58566-7.
|
| [24] |
GAO Y L, ZHAI J H, CHAI Y F. Recent advances in the molecular mechanisms underlying pyroptosis in sepsis[J/OL]. Mediators Inflamm, 2018, 2018: 5823823. DOI: 10.1155/2018/5823823.
|
 2021, Vol. 42
2021, Vol. 42


