2. 海军军医大学基础医学院学员一大队, 上海 200433;
3. 海军军医大学基础医学院学员二大队, 上海 200433
2. The First Student Team, College of Basic Medical Sciences, Naval Medical University (Second Military Medical University), Shanghai 200433, China;
3. The Second Student Team, College of Basic Medical Sciences, Naval Medical University (Second Military Medical University), Shanghai 200433, China
脑血管创伤是头颈部创伤的并发症之一,发生率约为1%[1],其可导致脑血管动静脉畸形、动脉瘤和血管狭窄、闭塞甚至离断,约10%的患者最终会进展为脑卒中[2]。脑血管创伤多为钝性创伤,这种创伤往往不会导致血管全层断裂,而是通过引起血管内皮损伤或强度下降促使创伤后血管狭窄和动脉瘤等形成[2]。为了防止脑血管创伤进展及改善患者预后,有必要明确病变过程中的病理变化与分子机制,找到延缓甚至逆转其进展的治疗靶点。既往较常用的血管创伤动物模型(如球囊损伤、导丝损伤等)均不能较好地模拟真实环境中的血管创伤[3-4]。本研究尝试建立一种新的血管创伤小鼠模型,初步探索急性期血管创伤的分子机制,为今后的研究提供工具支持。
1 材料和方法 1.1 实验动物与分组健康雄性C57BL/6J小鼠64只,体重为20~25 g,购自北京维通利华实验动物技术有限公司[实验动物生产许可证号SCXK(京)2016-0006],饲养于海军军医大学(第二军医大学)长海医院中心实验室动物房[实验动物使用许可证号SYXK(沪)2015-0017]。小鼠随机分为4组:假手术组和颈总动脉钳夹致颈总动脉钝性创伤建模后1、3、7 d组(术后1、3、7 d组),每组16只。
1.2 颈总动脉钳夹致颈总动脉钝性创伤小鼠模型的建立小鼠全程予2%~2.5%异氟烷吸入麻醉,待翻正反射及痛觉刺激反应消失后仰卧位固定于手术台。做颈正中切口,显微镜下暴露并分离左侧颈总动脉,向上分离至颈总动脉分叉部,向下分离至胸锁乳突肌上缘。整段颈总动脉至少分离出5 mm以便放置血管夹。沿颈内动脉分叉部下方连续紧贴钳夹2个有齿动脉夹(钳夹力为1 N,宽度为2 mm),钳夹30 min后松开血管夹。逐层缝合小鼠皮下组织及皮肤。分别于术后1、3、7 d对小鼠进行神经功能评价和取材。假手术组小鼠仅予颈正中切口并做简单组织分离探查后缝合,不行钳夹等操作,于术后1 d取材。
1.3 小鼠神经功能缺失评分(neurological deficit score,NDS)使用NDS对建模小鼠进行评分,评判模型安全性:小鼠无明显神经功能缺损计0分,健侧前爪不能完全伸展计1分,行走时向健侧转圈计2分,行走时向健侧倾倒计3分,发生意识障碍或不能自发性行走计4分,死亡计5分。
1.4 颈总动脉石蜡切片制备每组取10只小鼠予5%水合氯醛(0.01 mL/g)腹腔注射麻醉,再次行颈正中切口,尽量分离粘连组织,暴露颈总动脉分叉部。在颈外动脉起始部与颈总动脉钳夹部以下各挂1根线标定损伤部位。暴露小鼠心脏,从心尖注入生理盐水10 mL冲出血液,再注入4%多聚甲醛溶液10 mL进行灌注固定。分别结扎2根标定线,在颈外动脉标定线以上、颈总动脉标定线以下剪断动脉,并剪断颈内动脉,取出目标血管。对血管进行脱水、透明、包埋,制作石蜡切片(厚约5 μm),然后进行H-E染色与免疫组织化学染色。
1.5 H-E染色将颈总动脉石蜡切片脱蜡至水,依次用苏木精染液与伊红染液进行浸染,然后脱水封片。在显微镜下观察血管组织结构、形态及细胞成分变化。
1.6 免疫组织化学染色对颈总动脉石蜡切片脱蜡至水后进行组织抗原修复,阻断过氧化物酶后用血清封闭切片。分别加入血管细胞黏附分子1(vascular cell adhesion molecule 1,VCAM-1)抗体(货号32653,美国CST公司,稀释比例为1∶1 000)、内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)抗体(ab76198,英国Abcam公司,1∶500)、内皮素1抗体(ab2786,英国Abcam公司,1∶500)和髓过氧化物酶(myeloperoxidase,MPO)抗体(GB11224,武汉赛维尔生物科技有限公司,1∶200)标记。冲洗后加入二抗,用DAB法显色。最后用苏木精复染细胞核,脱水封片。利用ImageJ软件,采用改良的免疫组织化学半定量评估方法VCAM-1、eNOS和内皮素1染色结果进行分析:首先进行染色评分,无染色计0分,淡黄色计1分,棕黄色计2分;然后测量各染色分值血管内皮所占总内皮周长的百分比,再乘以相应的染色分值,最后相加得到染色总分。例如,某无染色血管内皮占总内皮周长的20%,淡黄色占50%,棕黄色占30%,则总分为0×20%+1×50%+2×30%=1.1分。MPO染色结果以视野内染色阳性细胞所占比例表示。
1.7 蛋白质印迹法检测蛋白表达每组取6只小鼠麻醉、暴露颈总动脉分叉部,取出目标血管标本后进行匀浆处理。4 ℃ 13 800×g离心10 min,提取总蛋白。用BCA蛋白浓度测定试剂盒(货号P0012,上海碧云天生物技术有限公司)测蛋白浓度。将蛋白提取物按1∶4与上样缓冲液混合后加热至100 ℃变性。每孔加入约50 μg蛋白进行SDS-PAGE,待蛋白分离后转膜。然后用5%脱脂奶粉TBST溶液封闭,分别加入B淋巴细胞瘤2相关X蛋白(B-cell lymphoma-related X protein,Bax)抗体(货号14796,美国CST公司,稀释比例为1∶1 000)、活化caspase 1抗体(24232,美国CST公司,1∶1 000)、环氧化酶2(cyclooxygenase 2,COX-2)抗体(12282,美国CST公司,1∶1 000)、基质金属蛋白酶(matrix metalloproteinase,MMP)-2抗体(87809,美国CST公司,1∶1 000)、MMP-9抗体(ab38898,英国Abcam公司,1∶1 000)、VCAM-1抗体(32653,美国CST公司,1∶1 000)、eNOS抗体(ab76198,英国Abcam公司,1∶1 000)、内皮素1抗体(ab2786,英国Abcam公司,1∶1 000)和GAPDH抗体(GB11002,武汉赛维尔生物科技有限公司,1∶1 000)溶液孵育过夜。之后用二抗孵育,最后曝光并采集图像。采用ImageJ软件对蛋白条带进行分析,计算目的蛋白相对表达量:目的蛋白相对表达量=目的蛋白条带灰度值/GAPDH条带灰度值。以假手术组各目的蛋白相对表达量的平均值为基准,对各实验组数据进行标准化。
1.8 统计学处理应用SPSS 23.0软件进行统计学分析,GraphPad Prism 7.0软件绘图。数据以x±s表示,多组比较采用单因素方差分析,多重比较采用Tukey检验。检验水准(α)为0.05。
2 结果 2.1 模型安全性评估NDS评估显示建模后1、3、7 d组小鼠均未出现明显神经功能损伤,取材前均存活。
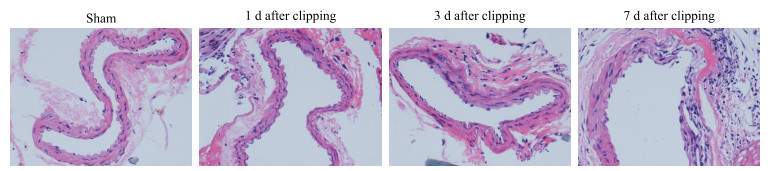
2.2 H-E染色结果假手术组小鼠颈总动脉内膜完整、平滑,中膜基质均匀,纤维连续,无明显细胞浸润。术后1 d组小鼠颈总动脉内膜欠光滑,中膜基质均匀性较差,存在轻度细胞浸润,考虑为炎症细胞。术后3 d组小鼠颈总动脉内膜欠光滑,中膜基质不均匀,纤维中断,有明显细胞浸润。术后7 d组小鼠颈总动脉内膜欠光滑,部分存在全层断裂,形成假性动脉瘤,有明显细胞浸润。见图 1。
|
图 1 各组小鼠颈总动脉苏木精-伊红(H-E)染色(40×) Fig 1 Hematoxylin-eosin (H-E) staining of common carotid arteries of mice in each group (40×) |
2.3 免疫组织化学染色结果
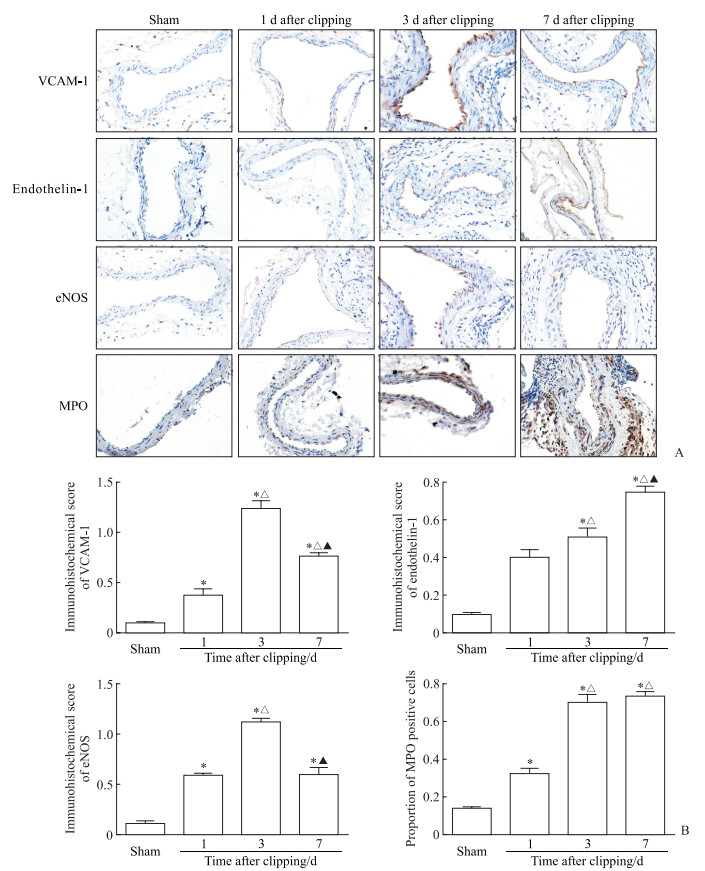
术后1、3、7 d组小鼠颈总动脉内膜VCAM-1、内皮素1和eNOS免疫组织化学染色评分均高于假手术组(P均<0.05)。其中VCAM-1免疫组织化学染色评分在术后3 d最高,术后7 d有所下降,但仍高于术后1 d;而内皮素1免疫组织化学染色评分在术后1~7 d呈递增趋势;eNOS免疫组织化学染色评分也在术后3 d最高,但在术后7 d回落至与术后1 d无明显差异。MPO免疫组织化学染色结果证实,术后1、3、7 d组小鼠颈总动脉及血管壁内浸润的细胞为髓系炎症细胞。在血管壁及其周围,术后1、3、7 d组MPO阳性细胞占比均高于假手术组(P均<0.05),其中术后3、7 d升高更为显著。见图 2。
|
图 2 各组小鼠颈总动脉免疫组织化学染色结果 Fig 2 Immunohistochemical staining results of common carotid arteries of mice in each group A: Representative immunohistochemical staining pictures (40×); B: Statistical analysis results. *P < 0.05 vs sham group; △P < 0.05 vs 1 d after clipping group; ▲P < 0.05 vs 3 d after clipping group. n=10, x±s. VCAM-1: Vascular cell adhesion molecule 1; eNOS: Endothelial nitric oxide synthase; MPO: Myeloperoxidase. |
2.4 蛋白质印迹法检测小鼠颈总动脉组织蛋白表达结果
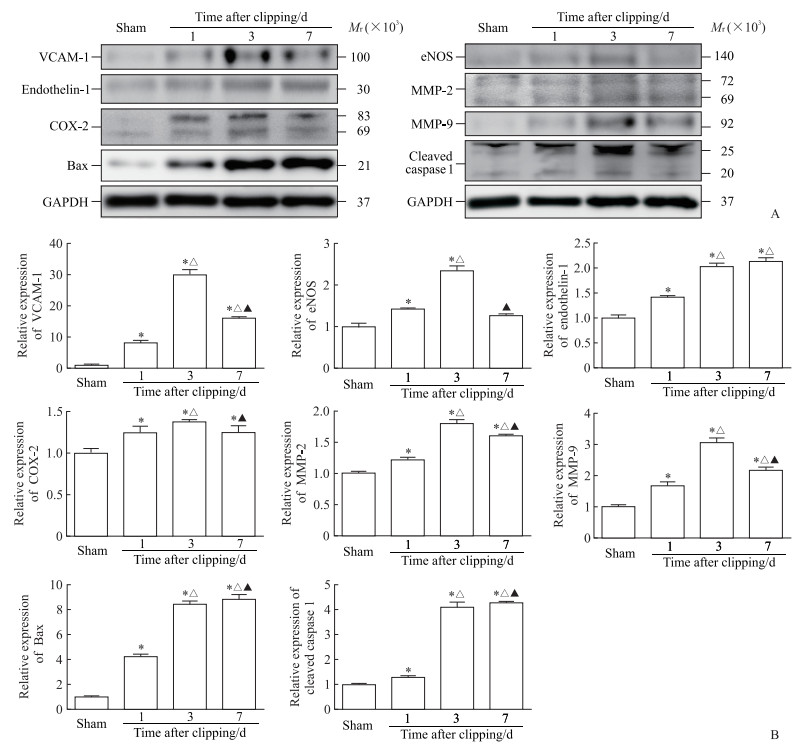
术后1、3 d组小鼠颈总动脉组织中血管功能相关标志物VCAM-1、eNOS和内皮素1蛋白表达均上调,与假手术组相比差异均有统计学意义(P均<0.05)。VCAM-1与eNOS蛋白表达上调均在术后3 d最明显,在术后7 d均有所降低,但术后7 d组VCAM-1蛋白表达水平仍高于假手术组(P<0.05),而eNOS蛋白表达在术后7 d降至与假手术组无明显差异。内皮素1蛋白表达在术后1~7 d呈上升趋势。术后1~7 d,炎症相关蛋白COX-2、MMP-2、MMP-9及凋亡相关蛋白Bax、活化caspase 1表达均上调,与假手术组相比差异均有统计学意义(P均<0.05)。其中COX-2、MMP-2与MMP-9表达水平均在术后3 d达到高峰,于术后7 d出现回落,但仍高于假手术组(P均<0.05);Bax、活化caspase 1的表达水平在术后1~7 d逐步上升。见图 3。
|
图 3 蛋白质印迹法检测小鼠颈总动脉组织血管功能、炎症、凋亡相关蛋白表达 Fig 3 Expression of vascular function, inflammation, and apoptosis related proteins in common carotid artery tissues of mice detected by Western blotting A: Representative Western blotting pictures; B: Statistical analysis results. *P < 0.05 vs sham group; △P < 0.05 vs 1 d after clipping group; ▲P < 0.05 vs 3 d after clipping group. n=6, x±s. VCAM-1: Vascular cell adhesion molecule 1; eNOS: Endothelial nitric oxide synthase; MMP: Matrix metalloproteinase; COX-2: Cyclooxygenase 2; Bax: B-cell lymphoma-related X protein; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase. |
3 讨论
本研究初步探索了颈总动脉钳夹致颈总动脉钝性创伤动物模型的建立方法,并对建模安全性和效果进行评估,结果显示建模后1~7 d小鼠未出现明显神经功能损伤、均存活,颈总动脉钳夹可导致血管组织损伤、血管损伤标志蛋白表达上调、血管壁炎症反应和细胞凋亡。说明本研究建立的颈总动脉钳夹致颈总动脉钝性创伤小鼠模型安全、可行。
既往常用的球囊损伤和导丝损伤模型无法准确地模拟常见血管创伤的致伤机制,阻碍了血管创伤的研究进展。1993年,Tsukahara等[5]使用10枚Yasargil脑动脉瘤夹(夹宽1 mm)在1 cm范围内钳夹大鼠颈总动脉30 min,分析大鼠颈总动脉内皮损伤及创伤后再生情况。本研究根据实验动物的特点与建模需要,对此模型进行了改进,选用较宽的有齿动脉夹模拟钝性血管损伤,降低了钳夹的局部压强,保证了损伤血管的相对长度,更好地模拟了血管钝性创伤的致伤机制。小鼠具有功能良好的大脑动脉环,因此单侧颈总动脉结扎30 min不会造成明显的神经功能损伤,也不会导致小鼠发生缺血性脑卒中[5]。
H-E染色显示,颈总动脉钳夹造成了明确的组织损伤,包括内膜损伤、中膜纤维断裂等。这些损伤由两方面因素导致:一是颈总动脉钳夹本身造成的原发性损伤,二是急性损伤后由血管壁组织表型改变、炎症反应及细胞凋亡导致的继发性损伤。内皮素是已知最强的致血管收缩物质,它也可以促进血管平滑肌细胞释放炎症因子,趋化炎症细胞,导致血管氧化应激损伤[6]。VCAM-1是一种黏附分子,参与了白细胞黏附和穿壁运动,同样促进了炎症反应[7]。而eNOS可以催化一氧化氮合成而导致血管扩张,同时也可以抑制血小板与白细胞黏附[8]。总体而言,内皮素1与VCAM-1属于血管损伤性标志物,而eNOS属于保护性标志物。根据免疫组织化学染色与蛋白质印迹法检测结果,VCAM-1等损伤性标志物在钳夹术后血管组织中表达上调幅度较大且作用较持久,与之相符,术后3~7 d炎症与凋亡相关蛋白(MPO、MMP-2、活化caspase 1、Bax等)的表达也持续在较高水平。而eNOS作为保护性标志物,术后1 d在血管组织中表达上调,但于术后3 d达峰后回落。
血管的机械性损伤可直接导致胶原纤维暴露、组织因子释放、局部血液涡流及创伤后高凝状态,这些均是促进血栓形成的因素[2, 9]。血管钝性创伤导致的局部炎症反应又可以加剧促炎细胞(如中性粒细胞和M1型巨噬细胞)的趋化与分化,使CD40、IL-6、TNF-α等促血栓形成细胞因子释放增加,最终导致创伤部位血栓形成[10]。在血管创伤的慢性期,这些被趋化的炎症细胞又会沉积于血管壁,吞噬脂质成分,参与粥样硬化斑块的形成[11]。此外,血管损伤还会导致血管壁强度下降,加之炎症反应与细胞凋亡能进一步引起血管损伤及MMP-2与MMP-9释放促使血管重构,均为创伤性动脉瘤的形成提供了条件[12]。由此可以推断血管钝性创伤引起的炎症反应与细胞凋亡或许是引起血管狭窄或动脉瘤形成的重要因素。本实验建立的颈总动脉钳夹致颈总动脉钝性创伤模型较好地模拟了血管创伤引起的组织损伤、炎症反应与细胞凋亡,有利于后续创伤后血管病理变化的研究。
本模型也存在局限,它虽然能较好地模拟外源性血管创伤,但不能模拟造成血管损伤时的冲击过程,这需要通过设计新型血管创伤建模器械解决。此外,本次建模仅观察了急性期血管创伤情况,未描述血管创伤所致的慢性病变。
| [1] |
EASTHAM S. Blunt cerebrovascular injuries in trauma[J]. Int J Surg, 2016, 33(Pt B): 251-253. DOI:10.1016/j.ijsu.2015.09.075 |
| [2] |
HARRIGAN M R. Ischemic stroke due to blunt traumatic cerebrovascular injury[J]. Stroke, 2020, 51: 353-360. DOI:10.1161/STROKEAHA.119.026810 |
| [3] |
郭延松, 吴宗贵, 杨军柯, 林皓平. 氯沙坦对大鼠动脉粥样硬化的影响[J]. 第二军医大学学报, 2011, 32: 1286-1291. GUO Y S, WU Z G, YANG J K, LIN H P. Effect of lorsartan on rat model of atherosclerosis[J]. Acad J Sec Mil Med Univ, 2011, 32: 1286-1291. |
| [4] |
朱丽华, 王朗, 陈静, 田松, 杨妲, 江洪. 小鼠颈动脉导丝损伤模型建立与特点分析研究[J]. 岭南心血管病杂志, 2012, 18: 431-435, 437. DOI:10.3969/j.issn.1007-9688.2012.04.030 |
| [5] |
TSUKAHARA T, YONEKAWA Y, YAMAMOTO M, KAKU Y, OGATA N, TANIGUCHI T. Regeneration of the rat carotid artery after clipping injury. Part Ⅰ. A morphological study[J]. Neurosurgery, 1993, 32: 66-72. DOI:10.1227/00006123-199301000-00010 |
| [6] |
DAVENPORT A P, HYNDMAN K A, DHAUN N, SOUTHAN C, KOHAN D E, POLLOCK J S, et al. Endothelin[J]. Pharmacol Rev, 2016, 68: 357-418. DOI:10.1124/pr.115.011833 |
| [7] |
MALEKMOHAMMAD K, SEWELL R D E, RAFIEIANKOPAEI M. Antioxidants and atherosclerosis: mechanistic aspects[J/OL]. Biomolecules, 2019, 9: 301. DOI: 10.3390/biom9080301.
|
| [8] |
刘丹, 王蓓蕾, 张黎明. eNOS/NO信号通路与心血管疾病关系的研究进展[J]. 心脏杂志, 2015, 27: 95-98. |
| [9] |
PARK M S, MARTINI W Z, DUBICK M A, SALINAS J, BUTENAS S, KHEIRABADI B S, et al. Thromboelastography as a better indicator of hypercoagulable state after injury than prothrombin time or activated partial thromboplastin time[J]. J Trauma, 2009, 67: 266-276. |
| [10] |
GUO Y, LIP G Y, APOSTOLAKIS S. Inflammation in atrial fibrillation[J]. J Am Coll Cardiol, 2012, 60: 2263-2270. DOI:10.1016/j.jacc.2012.04.063 |
| [11] |
XU H, JIANG J, CHEN W, LI W, CHEN Z. Vascular macrophages in atherosclerosis[J/OL]. J Immunol Res, 2019, 2019: 4354786. DOI: 10.1155/2019/4354786.
|
| [12] |
TEXAKALIDIS P, SWEID A, MOUCHTOURIS N, PETERSON E C, SIOKA C, RANGEL-CASTILLA L, et al. Aneurysm formation, growth, and rupture: the biology and physics of cerebral aneurysms[J]. World Neurosurg, 2019, 130: 277-284. |
 2021, Vol. 42
2021, Vol. 42


