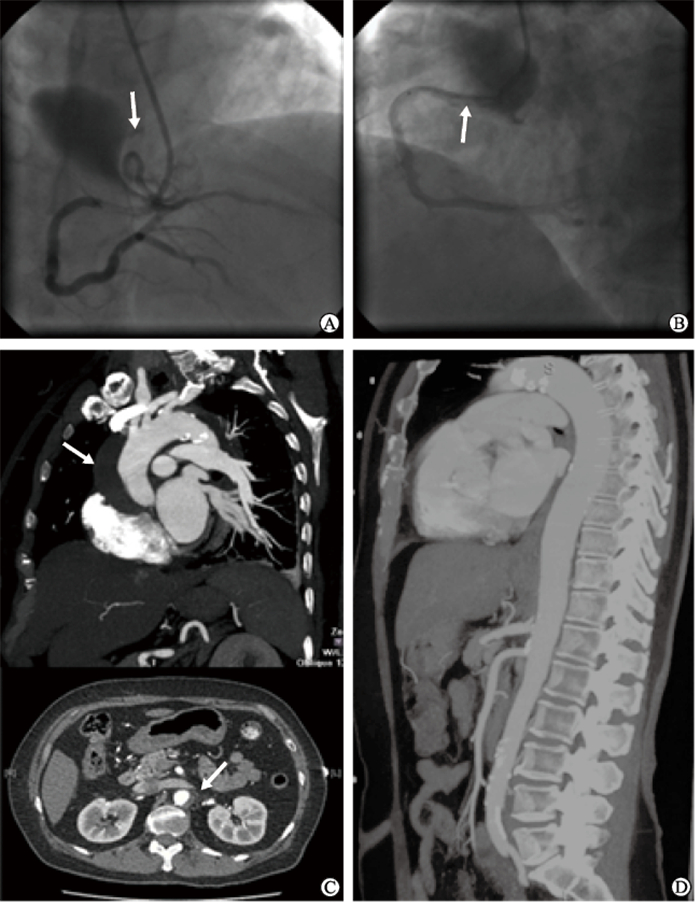
患者女,59岁,因“反复胸闷1个月余”于2013年10月8日入院。既往有高血压病史12年,目前血压控制良好;高脂血症病史20年。入院体格检查:血压130/80 mmHg(1 mmHg=0.133 kPa),双上眼睑黄色瘤,心肺检查未见异常。辅助检查:心电图未见异常;超声心动图示左心室射血分数为65%,左心房前后径为3.8 cm。实验室检查:血常规、肾功能均未见异常;肌钙蛋白未见异常;低密度脂蛋白胆固醇(low-density lipoprotein-cholesterol,LDL-C)为3.8 mmol/L(正常参考值为<3.37 mmol/L)。完善术前各项检查、做好术前准备后于2013年10月9日经桡动脉行冠状动脉造影术。造影提示左主干和前降支、回旋支均未见明显狭窄,右冠状动脉远端分出左室后支处局限性狭窄90%,故对左室后支行球囊扩张和冠状动脉支架植入术。将造影导管更换为6 Fr Judkins Right 4导引导管(Launcher,美国Medtronic公司)后,沿导丝送入2.0 mm×15 mm球囊至狭窄处进行扩张,退出球囊后经导引导管造影发现右冠状动脉开口夹层并沿主动脉壁向上撕裂(图 1A)。同时,患者主诉胸痛并放射至后背,术中诊断为右冠状动脉开口夹层合并升主动脉夹层,立刻给予盐酸吗啡注射液5 mg静脉注射镇静、镇痛,并予硝酸甘油20 μg/min持续滴注控制血压。随后立即沿导丝经导引导管送入3.5 mm×30 mm Firebird2支架至右冠状动脉开口处,并以12 atm(1 atm=101.325 kPa)释放支架(图 1B)。在手术室继续观察半小时后,从主动脉根部轻推造影剂未见右冠状动脉开口至升主动脉夹层的范围扩大,遂结束手术。将患者送至心血管病ICU,并予降压、镇痛、镇静治疗。术后第2天患者诉疼痛减轻,行全主动脉计算机断层扫描血管造影(computed tomography angiography,CTA)检查示升主动脉夹层撕裂至双侧肾动脉上方水平(图 1C)。由心外科会诊后,考虑患者症状缓解,建议暂缓外科手术。继续保守观察20 d后患者无不适主诉,于2013年10月29日出院,出院诊断为冠心病、医源性右冠状动脉开口夹层合并全主动脉夹层、高血压病、高脂血症。术后半年复查全主动脉CTA示主动脉夹层愈合,各分支动脉未受影响(图 1D)。目前继续予降压、抗血小板、调脂等治疗,患者病情平稳。
|
图 1 右冠状动脉开口夹层合并全主动脉夹层患者的影像学资料 A:经桡动脉冠状动脉造影术中发现右冠状动脉开口夹层,同时沿主动脉壁向上撕裂(箭头所示);B:术中明确诊断后立即在右冠状动脉开口植入支架(箭头所示);C:术后第2天CTA检查示夹层撕裂至肾动脉水平(箭头所示);D:术后半年随访行CTA检查见主动脉夹层愈合.CTA:计算机断层扫描血管造影. |
2 讨论
累及升主动脉根部的Stanford A型主动脉夹层多见于高血压或大动脉畸形患者,此类疾病多数需急诊行外科手术且有很高的病死率。因血管内介入治疗或心血管外科手术造成的医源性主动脉夹层(iatrogenic aortic dissection,IAD)相对少见,但随着心血管介入诊疗技术尤其是经皮冠状动脉介入(percutaneous coronary intervention,PCI)的发展,PCI相关IAD这一严重并发症逐渐引起临床医师的重视。临床上IAD发生率较低,但一旦发生则威胁患者生命,加之目前尚无统一治疗方案,死亡率较高。本文通过报告1例右冠状动脉介入治疗术中导引导管引起的升主动脉夹层,并分析相关文献,归纳此类并发症的临床特征、治疗和预后以指导临床诊治。
文献报道IAD的发生率为0.008%~0.20%[1-2]。但复杂PCI如冠状动脉旋磨、冠状动脉慢性完全性闭塞病变(chronic total occlusion,CTO)介入治疗等病例逐年增多,IAD的发生率可能上升。Boukhris等[3]对956例冠状动脉CTO介入治疗病例资料进行回顾发现,有8例患者发生了IAD,发生率为0.84%。
IAD的发病机制较为复杂,目前大多数观点认为其发生与术者操作有关,如术中暴力旋转造影导管或导引导管、导丝或球囊前进速度较快、导引导管或导丝反复弹出血管及其他不规范的介入操作。患者自身因素也可能与术中发生IAD有关,IRAD研究结果显示,A型IAD患者多数既往有冠状动脉旁路移植手术史,B型IAD则多数与导管操作相关[4]。与自发性主动脉夹层患者相比,IAD患者年龄偏大,且多合并糖尿病、高血压病等[5]。此外,IAD多发生在右冠状动脉介入治疗时,可能原因是右冠状动脉平滑肌细胞和Ⅰ型胶原纤维少,导管易对其造成损伤[6]。回顾本例患者的资料和PCI治疗过程,我们认为造成夹层的主要原因是导引导管与右冠状动脉开口未能同轴,且术中进行球囊扩张时导引导管反复弹出右冠状动脉开口而多次调整导管;另外,此例患者合并高血压病,这或许也促进了夹层的形成。
从临床表现来看,IAD与自发性主动脉夹层的不同之处在于患者胸痛发生率较低[5]。目前临床上对如何处理IAD并未达成共识。Dunning等[7]曾将医源性冠状动脉开口夹层至升主动脉夹层分为3类:1型为夹层至累及单侧主动脉窦;2型为夹层从主动脉窦撕裂至升主动脉,但撕裂长度<40 mm;3型为升主动脉撕裂长度>40 mm。他们建议1型和2型可选择保守治疗,3型积极外科手术。浙江邵逸夫医院曾报道1例50岁患者,右冠状动脉PCI术中发生升主动脉夹层,立即行瓣膜成形+右冠状动脉开口修复+升主动脉置换术,患者术后20 d出院,无手术并发症发生[8]。但目前临床上多数IAD选择保守治疗,而非积极外科手术。本例患者虽然术后第2天CTA检查提示夹层撕裂范围至肾动脉上方水平,但因血流动力学稳定,仍采取了保守治疗,最终获得成功。这提示我们应根据IAD患者的生命体征制订个体化治疗策略,并及时行CTA检查以观察有无血流进入假腔;同时在术中应沉着冷静,尽可能确保送入冠状动脉的导丝不会脱出冠状动脉开口,减少反复操作,并尽早选择合适的冠状动脉支架植入在冠状动脉开口部位,封住破口,避免撕裂范围进一步扩大。但对于夹层延伸至升主动脉且长度>40 mm或出现急性主动脉瓣损伤反流、心包积血、导丝不能进入冠状动脉真腔等情况时,仍需多学科会诊,必要时立即行外科手术。
| [1] |
PÉREZ-CASTELLANO N, GARCÍA-FERNÁNDEZ M A, GARCÍA E J, DELCÁN J L. Dissection of the aortic sinus of Valsalva complicating coronary catheterization: cause, mechanism, evolution, and management[J]. Cathet Cardiovasc Diagn, 1998, 43: 273-279. DOI:10.1002/(SICI)1097-0304(199803)43:3<273::AID-CCD7>3.0.CO;2-6 |
| [2] |
NÚÑEZ-GIL I J, BAUTISTA D, CERRATO E, SALINAS P, VARBELLA F, OMEDÈ P, et al; Registry on Aortic Iatrogenic Dissection (RAID) Investigators. Incidence, management, and immediateand longterm outcomes after iatrogenic aortic dissection during diagnostic or interventional coronary procedures[J]. Circulation, 2015, 131: 2114-2119.
|
| [3] |
BOUKHRIS M, TOMASELLO S D, MARZÀ F, AZZARELLI S, GALASSI A R. Iatrogenic aortic dissection complicating percutaneous coronary intervention for chronic total occlusion[J]. Can J Cardiol, 2015, 31: 320-327. DOI:10.1016/j.cjca.2014.11.030 |
| [4] |
TSAI T T, TRIMARCHI S, NIENABER C A. Acute aortic dissection: perspectives from the International Registry of Acute Aortic Dissection (IRAD)[J]. Eur J Vasc Endovasc Surg, 2009, 37: 149-159. DOI:10.1016/j.ejvs.2008.11.032 |
| [5] |
RAWAT R S, MEHTA Y, SAXENA P, BHAN A. Iatrogenic aortic dissection[J/OL]. J Cardiothorac Vasc Anesth, 2011, 25: e23. DOI: 10.1053/j.jvca.2011.02.003.
|
| [6] |
PARK I W, MIN P K, CHO D K, BYUN K H. Successful endovascular treatment of iatrogenic coronary artery dissection extending into the entire ascending aorta[J]. Can J Cardiol, 2008, 24: 857-859. DOI:10.1016/S0828-282X(08)70196-X |
| [7] |
DUNNING D W, KAHN J K, HAWKINS ET, O'NEILL W W. Iatrogenic coronary artery dissections extending into and involving the aortic root[J]. Catheter Cardiovasc Interv, 2000, 51: 387-393. DOI:10.1002/1522-726X(200012)51:4<387::AID-CCD3>3.0.CO;2-B |
| [8] |
YU C, HE F, CHEN H, HONG J, QIAN X. Iatrogenic dissection of the right coronary artery and the ascending aorta secondary to percutaneous coronary intervention: a case report[J/OL]. Heart Surg Forum, 2020, 23: E366-E369. DOI: 10.1532/hsf.2983.
|
 2021, Vol. 42
2021, Vol. 42


