2. 中国科学院深圳先进技术研究院合成生物学研究所, 深圳 440305;
3. 北京润美康医药有限公司, 北京 101312
2. Institute of Synthetic Biology, Shenzhen Institute of Advanced Technology, Chinese Academy of Sciences, Shenzhen 440305, Guangdong, China;
3. Beijing Runmeikang Medical Co., Ltd, Beijing 101312, China
心肌肥厚被认为是心力衰竭必经的一个病理过程,是心脏对压力超负荷的一种代偿性反应[1-2]。心肌肥厚以心肌细胞增大、胎儿基因如心房钠尿肽(atrial natriuretic peptide,ANP)和脑钠肽(brain natriuretic peptide,BNP)等的激活为特征,常伴纤维化、心肌重构、细胞容积增加[3-4]。研究显示,异丙肾上腺素(isoprenaline,ISO)等儿茶酚胺类物质可通过激活肾上腺素能受体促进ANP和BNP表达,从而导致心肌肥厚,增加心血管疾病的风险[5-7],但其具体机制尚不清楚。
氯离子通道蛋白3(chloride channel protein 3,ClC-3)是电压门控氯离子通道基因家族成员之一[8]。研究表明ClC-3在心脏心房和心室细胞、血管平滑肌细胞和内皮细胞等细胞中含量十分丰富[9]。Liang等[10]研究认为,ClC-3是心肌细胞和血管平滑肌细胞容积调节性氯离子通道的关键组成部分,参与了细胞增殖、分化、迁移、凋亡、容积调节等生命活动。Clemo等[11]研究发现,心肌肥厚能诱导大鼠心室外向整流的氯电流,充血性心力衰竭刺激犬心脏肿胀也能诱发氯电流。Xiong等[12]发现,特异性敲除小鼠心脏ClC-3基因会诱导心肌肥厚和心力衰竭的发生、发展。
我们前期研究发现,在ISO诱导的大鼠原代肥大心肌细胞、H9c2肥大心肌细胞和野生型C57BL/6小鼠肥厚心肌组织中ClC-3的表达水平降低[13-14]。本研究通过腺相关病毒9(adeno-associated virus 9,AAV9)载体构建ClC-3过表达小鼠模型及ClC-3过表达原代心肌细胞模型,探讨ClC-3过表达对ISO诱导的小鼠心肌肥厚的影响。
1 材料和方法 1.1 实验动物48只6~8周龄健康雄性C57BL/6小鼠(体重为18~22 g)和8只乳鼠购于广东省医学实验动物中心[实验动物生产许可证号:SCXK(粤)2018-0002],在广东药科大学实验动物中心SPF级环境中饲养[实验动物使用许可证号:SYXK(粤)2017-0125]。本实验符合广东药科大学实验动物伦理委员会制定的伦理学标准。
1.2 主要试剂与仪器ISO购于美国Sigma公司;ClC-3兔一抗(稀释比例为1∶1 000)购于英国Abcam公司,GAPDH鼠一抗(稀释比例为1∶1 000)、羊抗兔二抗(稀释比例为1∶1 000)、羊抗鼠二抗(稀释比例为1∶1 000)均购于上海碧云天生物技术有限公司;携带ClC-3基因的AAV9(AAV9-ClC-3)和空白载体AAV9均购自上海汉恒生物科技有限公司;反转录试剂盒(QPS-201)、荧光定量PCR试剂盒均购于日本ToYoBo公司;蛋白酶抑制剂PMSF、CFXTM系列Real-Time PCR仪、蛋白电泳系统、蛋白转膜系统均购于美国Bio-Rad公司;ECL发光液、RIPA裂解液均购于美国ThermoFisher Scientific公司;引物由生工生物工程(广州)有限公司合成;Tanon-5200蛋白成像系统、凝胶成像系统均购于广州誉维生物科技仪器有限公司;VevoTM2100型小动物超声实时影像系统购于加拿大VisualSonics公司。
1.3 心肌细胞ClC-3过表达小鼠模型的建立及动物实验分组将AAV9-ClC-3或空白载体AAV9病毒颗粒通过尾静脉分别注入小鼠,注射病毒滴度为1.9×1011~1.9×1012 copy/mL,稀释成100~200 μL注射,诱导小鼠心肌细胞特异性过表达ClC-3。4周后取小鼠心脏组织,采用蛋白质印迹法和qRT-PCR确定ClC-3过表达小鼠模型是否建立成功。32只小鼠随机分为4组:对照组、ISO组、AAV9-bv+ISO组、AAV9-ClC-3+ISO组,每组8只。(1)对照组:小鼠连续7 d腹腔注射与ISO组等体积生理盐水;(2)ISO组:小鼠连续7 d腹腔注射ISO(7.5 mg•kg-1•d-1);(3)AAV9-bv+ISO组:使用空白载体AAV9病毒颗粒感染小鼠4周后连续7 d腹腔注射ISO(7.5 mg•kg-1•d-1);(4)AAV9-ClC-3+ISO组:用AAV9-ClC-3病毒颗粒感染小鼠4周后,连续7 d腹腔注射ISO(7.5 mg•kg-1•d-1)。各组小鼠饲养条件相同,给药完成后禁水、禁食1 d后进行心脏超声检查。
1.4 小鼠心脏超声检查小鼠吸入异氟烷麻醉后固定于37 ℃恒温加热板,剃除胸毛,于胸部涂少量耦合剂。用VevoTM2100型小动物超声实时影像系统测量舒张末期室间隔厚度(end-diastolic interventricular septum,IVSd)、收缩末期室间隔厚度(end-systolic interventricular septum,IVSs)、舒张期左室后壁厚度(diastolic left ventricular posterior wall,LVPWd)、收缩期左室后壁厚度(systolic left ventricular posterior wall,LVPWs)。所有指标均连续测量3个心动周期,取平均值。
1.5 小鼠心脏体重指数计算各组小鼠进行心脏超声检查后称体重,运用颈椎脱臼法处死小鼠,取出心脏称其质量,计算心脏体重指数,心脏体重指数(mg/g)=心脏质量(mg)/体重(g)。然后进行后续实验。
1.6 蛋白质印迹法检测蛋白表达取小鼠心脏组织冰上剪碎,用预冷的PBS清洗至上清液澄清,按50 g/L加入RIPA裂解液,冰上匀浆后4 ℃ 3 000×g离心15 min,取上清,BCA法进行蛋白定量。用10% SDS-PAGE分离蛋白后电转移至PVDF膜上,用脱脂奶粉溶液封闭2 h,加入ClC-3一抗4 ℃孵育过夜,加入二抗室温孵育1 h,ECL发光液浸泡1 min后用Tanon-5200蛋白成像系统采集图像。利用ImageJ软件进行灰度分析,以目的蛋白与内参照GAPDH条带灰度值的比值作为目的蛋白的相对表达量。
1.7 qRT-PCR检测mRNA表达用苯酚法提取小鼠心脏组织总RNA,微量紫外分光光度计测定RNA的D260/D280值,D260/D280值介于1.9~2.1表明纯度较好。按照反转录试剂盒说明书完成反转录,获得cDNA。以cDNA模板、GAPDH为内参照进行PCR扩增,反应条件:95 ℃ 30 s,95 ℃ 5 s、60 ℃ 30 s循环40次,95 ℃ 1 min,60 ℃ 1 min。引物序列:ClC-3上游引物5′-GGTCAGGATGGCTTGTTGTT-3′,下游引物5′-ACAATGCACTGAGGCAGATG-3′;ANP 上游引物5′-TAGGAGACAGTGACGGACAA-3′,下游引物5′-GAAGAAGCCCAGGGTGAT-3′;BNP 上游引物5′-CAGCTCTCAAAGGACCAAGG-3′,下游引物5′-CGATCCGGTCTATCTTCTGC-3′;GAPDH 上游引物5′-GGCATGGACTGTGGTCATGA-3′,下游引物5′-TTCACCACCATGGAGAAGGC-3′。每个样本的基因表达用内参照GAPDH均一化。以2-ΔΔCt法计算目的基因mRNA的相对表达水平。
1.8 H-E染色和苦味酸-天狼星红(picro-sirius red,PSR)染色取小鼠心脏组织用PBS冲洗后,4%多聚甲醛溶液固定、二甲苯透明、乙醇梯度脱水、浸蜡、石蜡包埋、制作切片。H-E染色:取小鼠心脏组织石蜡切片,依次进行脱蜡至水、苏木精染细胞核、伊红染细胞质、脱水封片,最后于显微镜下观察,采集图像并分析。
PSR染色:取小鼠心脏组织石蜡切片,脱蜡后蒸馏水浸洗2 min。加入适量苏木精染液染3~5 min,蒸馏水冲洗3次。加入PSR染液染15~30 min后进行无水乙醇直接分色与脱水、二甲苯透明。风干后采用中性树胶封片,于显微镜下观察。染色呈黄色为心脏组织纤维,红色为纤维沉积。从每个样本中随机取15~20个视野放大200倍拍摄图像。采用Image-Pro Plus 6.0软件分析纤维沉积区域,计算纤维沉积量(红色区域面积所占百分比)。
1.9 小鼠原代心肌细胞培养与分组处理取8只乳鼠剖开胸腔取出心脏,用PBS洗涤至无残留血污后混合所有心脏组织并切碎,加入含有胰酶和胶原酶的消化工作液,在37 ℃恒温水浴锅中消化5 min,收集消化后的上清液,剩余组织加入消化液继续消化并收集上清液,直至组织块被完全消化。将收集到的上清液以250×g离心5 min,留沉淀重悬于DMEM-F12完全培养液,再次以250×g离心5 min,弃上清液,剩余沉淀再次悬浮于DMEM-F12完全培养液,用250目过滤网过滤到培养皿中。按照每孔5×105个细胞的密度接种至6孔板(确保病毒感染时细胞融合度不低于50%),然后用AAV9-ClC-3病毒颗粒感染。病毒液体积=感染时细胞数(按接种细胞数的2倍计算)×感染复数(multiplicity of infection,MOI)/病毒滴度。先用含病毒颗粒(MOI=1×105)的培养液1 mL培养细胞4 h后,不换液,追加1 mL新鲜完全培养液继续培养48 h,运用蛋白质印迹法和qRT-PCR确定ClC-3过表达原代心肌细胞模型是否建立成功,实验重复3次。模型建立成功后分为4组。(1)对照组:运用完全培养液进行细胞培养;(2)ISO组:加入10 μL ISO干预48 h,ISO处理浓度为0.1 μmol/L;(3)ClC-3过表达(AAV9-ClC-3)组:加入AAV9-ClC-3病毒颗粒感染小鼠原代心肌细胞48 h;(4)ClC-3过表达+ISO干预(AAV9-ClC-3+ISO)组:先后加入AAV9-ClC-3病毒颗粒和10 μL ISO(浓度为0.1 μmol/L)共同干预48 h。
1.10 小鼠原代心肌细胞容积激活性氯电流(volume activating chlorine current,ICl, vol)检测使用芯片膜片钳技术检测小鼠原代心肌细胞膜氯电流的变化。取适量等渗液重悬细胞,将细胞悬浮液置于芯片上,设置ICl, vol记录程序,按照单通道膜片钳设备(nano-patch-clamp,NPC)系统中的PatchControl协议,由EPC10USB膜片钳放大器呈现于显示屏并自动记录电流信号,由数据分析程序自动生成电流-电压曲线。原始电流数据采用PatchMaster及Igor软件进行分析和测量,使用SigmaPlot软件对数据进行拟合并绘图。实验重复3次。
1.11 统计学处理应用GraphPad Prism 8软件进行统计学分析。计量资料以x±s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析(两两比较采用Tukey检验)。检验水准(α)为0.05。
2 结果 2.1 心脏ClC-3过表达小鼠模型的确定空白载体AAV9组与AAV9-ClC-3组小鼠心脏组织中ClC-3的mRNA表达水平分别为1.00±0.00、2.44±0.38,ClC-3蛋白表达水平分别为0.21±0.08、0.60±0.12(图 1),差异均有统计学意义(t=10.69、7.59,P均<0.05)。证明心脏ClC-3过表达小鼠模型成功建立。

|
图 1 蛋白质印迹法检测ClC-3 过表达小鼠模型心脏组织中ClC-3的表达 Fig 1 ClC-3 expression in cardiac tissues of ClC-3 overexpression mouse model detected by Western blotting AAV9-bv group: The mice were infected with adeno-associated virus 9 (AAV9) carrying blank vector; AAV9-ClC-3 group: The mice were infected with AAV9 carrying ClC-3 gene. ClC-3: Chloride channel protein 3; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase. |
2.2 ClC-3过表达抑制ISO诱导的小鼠心脏体重指数增加
ISO组和AAV9-bv+ISO组小鼠心脏体重指数分别为(4.91±0.27)mg/g、(4.72±0.18)mg/g,均高于对照组的(4.20±0.13)mg/g(t=6.55、6.71,P均<0.01);而AAV9-ClC-3+ISO组小鼠心脏体重指数为(4.26±0.14)mg/g,低于AAV9-bv+ISO组(t=5.86,P<0.05),说明ClC-3过表达抑制了ISO诱导的小鼠心脏体重指数增加。
2.3 ClC-3过表达缓解ISO诱导的小鼠心肌肥厚如图 2、表 1所示,ISO组和AAV9-bv+ISO组小鼠都出现了明显的心肌肥厚,表现为IVSs、IVSd、LVPWs、LVPWd均较对照组增加(t=6.17、4.01、5.03、2.60和t=5.59、5.03、4.10、3.60,P均<0.05);而AAV9-ClC-3+ISO组小鼠上述指标均下降,其中IVSs、LVPWs和LVPWd与AAV9-bv+ISO组相比差异均有统计学意义(t=2.87、3.78、3.65,P均<0.05),说明ClC-3过表达能够缓解ISO诱导的小鼠心肌肥厚。
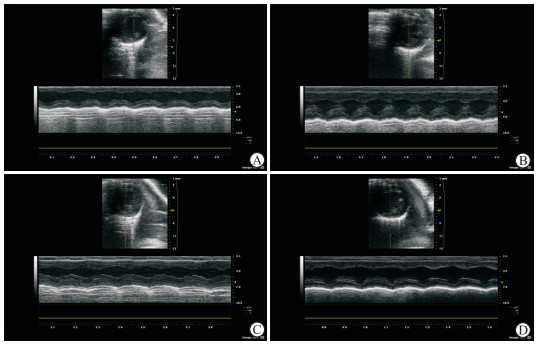
|
图 2 心脏超声检查示ClC-3 过表达缓解ISO诱导的小鼠心肌肥厚 Fig 2 Overexpression of ClC-3 alleviating ISO-induced cardiac hypertrophy in mice detected by echocardiography A: Control group (the mice were injected with normal saline); B: ISO group (the mice were injected with ISO); C: AAV9-bv+ ISO group (the mice infected by adeno-associated virus 9[AAV9]carrying blank vector were injected with ISO); D: AAV9-ClC-3+ISO group (the mice infected by AAV9 carrying ClC-3 gene were injected with ISO). ClC-3: Chloride channel protein 3; ISO: Isoprenaline. |
|
|
表 1 ClC-3过表达对小鼠心脏超声指标的影响 Tab 1 Effect of ClC-3 overexpression on mouse echocardiographic indexes |
2.4 ClC-3过表达改善ISO诱导的小鼠心脏组织形态学异常
H-E染色结果(图 3A)显示,对照组小鼠心肌纤维排列规则、无断裂,细胞核无异常增大;ISO组小鼠心肌纤维断裂,细胞核见少许异常增大,甚至出现细胞核聚集和核溶解,说明ISO干预后小鼠心脏组织发生明显异常重构;AAV9-bv+ISO组小鼠心脏组织形态学改变与ISO组相似;AAV9-ClC-3+ISO组小鼠心肌纤维排列规则、无断裂,细胞核也分布正常,没有出现异常增大和聚集的现象,与对照组小鼠心脏组织形态学相似。
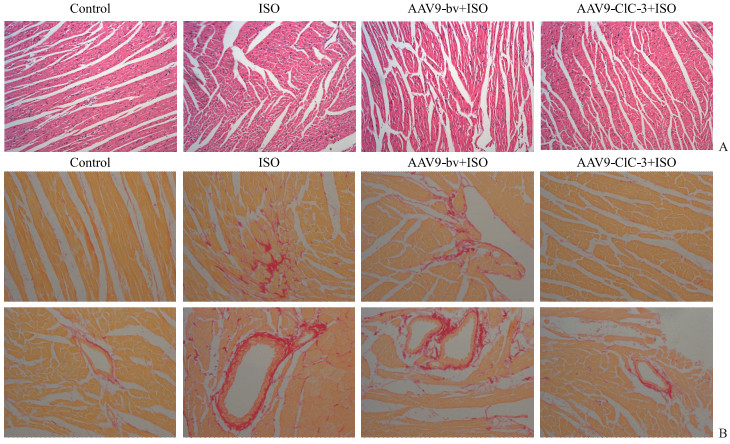
|
图 3 ClC-3 过表达改善ISO诱导的小鼠心脏组织形态学改变 Fig 3 Overexpression of ClC-3 improving morphological changes induced by ISO in mice A: Hematoxylin-eosin staining (200×); B: Picro-sirius red staining (200×). Control group: The mice were injected with normal saline; ISO group: The mice were injected with ISO; AAV9-bv+ISO group: The mice infected by adeno-associated virus 9 (AAV9) carrying blank vector were injected with ISO; AAV9-ClC-3+ISO group: The mice infected by AAV9 carrying ClC-3 gene were injected with ISO. ClC-3: Chloride channel protein 3; ISO: Isoprenaline. |
PSR染色结果(图 3B)显示,相比对照组,ISO组与AAV9-bv+ISO组小鼠心脏组织间质和血管周围纤维沉积均增多,心脏纤维化程度均加重[心肌纤维沉积量:(10.71±0.85)%、(8.53±0.80)% vs(2.11±0.35)%,t=26.49、20.67,P均<0.01];与AAV9-bv+ISO组比较,AAV9-ClC-3+ISO组小鼠的心脏组织间质和血管周围纤维沉积均减少,心脏纤维化程度降低[心肌纤维沉积量:(2.25±0.41)% vs(8.53±0.80)%,t=19.70,P<0.01]。
2.5 ClC-3过表达下调ISO诱导的小鼠心脏组织ANP、BNP的mRNA表达升高ISO组和AAV9-bv+ISO组小鼠心脏组织中ANP、BNP的mRNA表达水平均高于对照组(ANP mRNA:2.60±0.17、2.11±0.20 vs 1.00±0.00,t=27.13、15.37,P均<0.01;BNP mRNA:1.31±0.36、1.48±0.25 vs 1.00±0.00,t=2.42、5.40,P均<0.01);而AAV9-ClC-3+ISO组小鼠心脏组织中ANP、BNP的mRNA表达水平均较AAV9-bv+ISO组下降(ANP mRNA:0.84±0.38 vs 2.11±0.20,t=8.36,P<0.01;BNP mRNA:0.95±0.45 vs 1.48±0.25,t=2.90,P<0.01)。
2.6 ClC-3过表达小鼠原代心肌细胞模型的确定空白载体AAV9组与AAV9-ClC-3组小鼠原代心肌细胞中ClC-3的mRNA表达水平分别为0.24±0.02、1.38±0.09,ClC-3蛋白表达水平分别为1.46±0.18、2.71±0.30(图 4),差异均有统计学意义(t=21.57、6.22,P均<0.05)。证明ClC-3过表达小鼠原代心肌细胞模型成功建立。
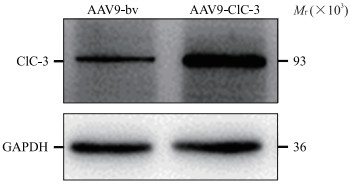
|
图 4 蛋白质印迹法检测ClC-3 过表达小鼠原代心肌细胞模型ClC-3的表达 Fig 4 ClC-3 expression in ClC-3 overexpression mouse primary cardiomyocyte model detected by Westerm blotting AAV9-bv group: The cardiomyocytes were infected by adenoassociated virus 9 (AAV9) carrying blank vector; AAV9-ClC-3 group: The cardiomyocytes were infected by AAV9 carrying ClC-3 gene. ClC-3: Chloride channel protein 3; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase. |
2.7 ClC-3过表达抑制ISO体外诱导的心肌细胞ICl, vol降低
由图 5可见,与对照组相比,ISO组心肌细胞ICl, vol降低[(3.44±0.03)nA vs(7.83±0.07)nA,t=15.72,P<0.01],AAV9-ClC-3组心肌细胞的ICl, vol[(7.92±0.76)nA]与对照组相近,而AAV9-ClC-3+ISO组心肌细胞的ICl, vol[(6.06±0.04)nA]较ISO组增加(t=6.94,P<0.05),说明ClC-3参与维持心肌细胞ICl, vol。
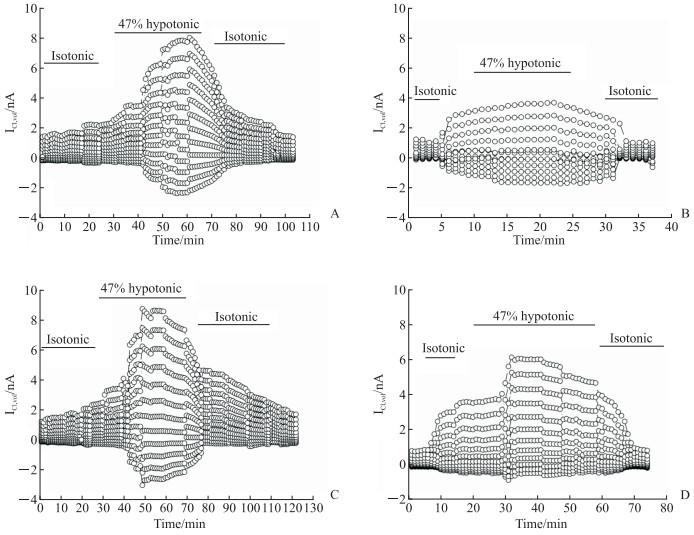
|
图 5 ClC-3 过表达抑制ISO体外诱导的心肌细胞ICl, vol 降低 Fig 5 ClC-3 overexpression inhibiting the decrease of cardiomyocyte ICl, vol induced by ISO in vitro A: Control group (the cardiomyocytes were treated without any intervention); B: ISO group (the cardiomyocytes were treated with ISO); C: AAV9-ClC-3 group (the cardiomyocytes were infected by adeno-associated virus 9[AAV9]carrying ClC-3 gene); D: AAV9-ClC-3+ISO group (the cardiomyocytes were infected by AAV9 carrying ClC-3 gene and treated with ISO). ClC-3: Chloride channel protein 3; ISO: Isoprenaline; ICl, vol: Volume activating chlorine current. |
3 讨论
目前心血管疾病已成为世界上三大致死疾病之一,心肌肥厚被认为是心血管事件的独立危险因素,其能导致患者心律失常,进而诱发心力衰竭,增加患者猝死概率[15]。研究表明,β-肾上腺素能受体激动剂如ISO对β-肾上腺素能受体的慢性刺激可诱发心肌肥厚[16]。本研究前期实验(结果未展示)发现,ISO(7.5 mg•kg-1•d-1)连续腹腔注射7 d能诱导C57BL/6小鼠发生心肌肥厚。
研究发现ClC-3在细胞容积的自我调节过程中发挥重要作用,而在心肌肥厚及扩张型心肌病中能检测到细胞容积稳定性的改变[17]。还有研究发现,敲除ClC-3基因会出现心房增大、左心室容积增加等心肌肥厚征象[18]。本实验结果显示,ClC-3过表达能减缓ISO诱导的心肌肥厚小鼠的心脏体重指数、IVSs、LVPWs和LVPWd的增加,缓解心肌重构,减少心肌纤维化、下调心肌肥厚标志因子ANP的mRNA表达,表明ClC-3可能在预防β-肾上腺素能受体诱发心肌肥厚的过程中起重要作用,或许是一个潜在的防治心肌肥厚的药物靶点。
ClC-3主要是作为容积激活性氯离子通道激活ICl, vol,在临床心肌肥厚患者的心肌细胞中可检测到ICl, vol的激活[19]。研究发现,在兔心力衰竭发生的同时会伴随心肌细胞ICl, vol的减少[20]。本实验结果显示,ClC-3过表达能抑制ISO体外诱导的小鼠心肌细胞ICl, vol降低,表明ClC-3可能通过激活ICl, vol改善β-肾上腺素能受体介导的心肌肥厚。
综上所述,ClC-3过表达能预防ISO诱导的小鼠心肌肥厚,其机制可能与ICl, vol激活有关。但本实验未深入分析ClC-3在心肌细胞和心脏成纤维细胞中过表达的比例,在心脏成纤维细胞用腺病毒特异过表达ClC-3是否对心肌肥厚有影响有待明确,并且过表达ClC-3对ISO诱导的小鼠心肌肥厚是否有治疗作用也有待进一步研究。
利益冲突 所有作者均声明不存在利益冲突。
| [1] |
马力, 刘杰, 初楠, 杨进刚, 史旭波, 王雅杰, 等. 心力衰竭模型大鼠心脏肥厚指标与心功能的关系研究[J]. 首都医科大学学报, 2010, 31: 596-599. DOI:10.3969/j.issn.1006-7795.2010.05.016 |
| [2] |
DENG K Q, WANG A, JI Y X, ZHANG X J, FANG J, ZHANG Y, et al. Suppressor of IKKε is an essential negative regulator of pathological cardiac hypertrophy[J/OL]. Nat Commun, 2016, 7: 11432. DOI: 10.1038/ncomms11432.
|
| [3] |
WANG P X, LI Z M, CAI S D, LI J Y, HE P, HUANG Y, et al. C33(S), a novel PDE9A inhibitor, protects against rat cardiac hypertrophy through upregulating cGMP signaling[J]. Acta Pharmacol Sin, 2017, 38: 1257-1268. DOI:10.1038/aps.2017.38 |
| [4] |
XUE R C, ZENG J Y, CHEN Y L, CHEN C, TAN W P, ZHAO J J, et al. Sestrin 1 ameliorates cardiac hypertrophy via autophagy activation[J]. J Cell Mol Med, 2017, 21: 1193-1205. DOI:10.1111/jcmm.13052 |
| [5] |
YILMAZ A, KAYA M G, MERDANOGLU U, ERGUN M A, CENGEL A, MENEVSE S, et al. Association of β-1 and β-2 adrenergic receptor gene polymorphisms with myocardial infarction[J]. J Clin Lab Ana, 2009, 23: 237-243. DOI:10.1002/jcla.20327 |
| [6] |
DONG Y, BAI Y, ZHANG S Y, XU W L, XU J H, ZHOU Y, et al. Cyclic peptide RD808 reduces myocardial injury induced by β-adrenoreceptor autoantibodies[J]. Heart Vessels, 2019, 34: 1040-1051. DOI:10.1007/s00380-018-1321-3 |
| [7] |
张梓桑, 张薪茹, 李光宇, 张劲松, 杜荣增. β3肾上腺素受体与心血管疾病相关性的研究进展[J]. 中国动脉硬化杂志, 2018, 26: 207-212. DOI:10.3969/j.issn.1007-3949.2018.02.018 |
| [8] |
ZENG J W, WANG X G, MA M M, LV X F, LIU J, ZHOU J G, et al. Integrin β3 mediates cerebrovascular remodelling through Src/ClC-3 volume-regulated Cl- channel signalling pathway[J]. Br J Pharmacol, 2014, 171: 3158-3170. DOI:10.1111/bph.12654 |
| [9] |
DUAN D D. The ClC-3 chloride channels in cardiovascular disease[J]. Acta Pharmacol Sin, 2011, 32: 675-684. DOI:10.1038/aps.2011.30 |
| [10] |
LIANG G Z, CHENG L M, CHEN X F, LI Y J, LI X L, GUAN Y Y, et al. ClC-3 promotes angiotensin Ⅱ-induced reactive oxygen species production in endothelial cells by facilitating Nox2 NADPH oxidase complex formation[J]. Acta Pharmacol Sin, 2018, 39: 1725-1734. DOI:10.1038/s41401-018-0072-0 |
| [11] |
CLEMO H F, STAMBLER B S, BAUMGARTEN C M. Swelling-activated chloride current is persistently activated in ventricular myocytes from dogs with tachycardia-induced congestive heart failure[J]. Circ Res, 1999, 84: 157-165. DOI:10.1161/01.RES.84.2.157 |
| [12] |
XIONG D, HEYMAN N S, AIREY J, ZHANG M, SINGER C A, RAWAT S, et al. Cardiac-specific, inducible ClC-3 gene deletion eliminates native volumesensitive chloride channels and produces myocardial hypertrophy in adult mice[J]. Mol Cell Cardiol, 2010, 48: 211-219. DOI:10.1016/j.yjmcc.2009.07.003 |
| [13] |
LI C, HUANG D, TANG J, CHEN M, LU Q, LI H, et al. ClC-3 chloride channel is involved in isoprenaline-induced cardiac hypertrophy[J]. Gene, 2018, 642: 335-342. DOI:10.1016/j.gene.2017.11.045 |
| [14] |
唐敬, 付强强, 陈梦青, 李春梅, 陆家政. 加入去甲肾上腺素培养的心肌细胞株H9c2体积变化[J]. 山东医药, 2018, 58: 32-35. |
| [15] |
OKA T, AKAZAWA H, NAITO AT, KOMURO I. Angiogenesis and cardiac hypertrophy: maintenance of cardiac function and causative roles in heart failure[J]. Circ Res, 2014, 114: 565-571. DOI:10.1161/CIRCRESAHA.114.300507 |
| [16] |
SEE H L, FOSTER S R, WENDT L, PATEL H H, HEADRICK J P, PEART J N, et al. Regulation of the β-adrenergic receptor signaling pathway in sustained ligand-activated preconditioning[J]. Pharmacol Exp Ther, 2019, 369: 37-46. DOI:10.1124/jpet.118.251660 |
| [17] |
薄冰. 心脏CIC-3容积感受性氯离子通道研究进展[J]. 科技资讯, 2014, 12: 223-224. |
| [18] |
LIU L L, YE L, MCGUCKIN C, HATTON W J, DUAN D. Disruption of Clcn3 gene in mice facilitates heart failure during pressure overload[J]. J Gen Physiol, 2003, 122: 33A. DOI:10.1085/jgp.200308825 |
| [19] |
PATEL D G, HIGGINS R S, BAUMGARTEN C M. Chronic activation of ICl, swell in diseased human atrial myocytes[J]. J Am Coll Cardiol, 2003, 41(6 Suppl 1): 112A-113A. |
| [20] |
MAO J W, CHEN L X, XU B, WANG L J, LI H Z, GUO J, et al. Suppression of ClC-3 channel expression reduces migration of nasopharyngeal carcinoma cells[J]. Biochem Pharmacol, 2008, 75: 1706-1716. DOI:10.1016/j.bcp.2008.01.008 |
 2021, Vol. 42
2021, Vol. 42


