2. 中国疾病预防控制中心营养与健康所中心实验室, 北京 100050
2. Central Laboratory, National Institute for Nutrition and Health, Chinese Center for Disease Control and Prevention, Beijing 100050, China
获得人体DNA的传统方法是抽取静脉血,但采集外周血样具有创伤性。近年来,口腔脱落黏膜上皮细胞成为分子流行病学研究中DNA样品的重要来源,脱落细胞虽然细胞核固缩,但仍具有完整的基因组DNA序列,并且取样简便、安全无创伤。目前从人体血液和口腔黏膜上皮细胞中提取DNA的方法主要有酚-氯仿法、盐析法、Chelex-100法等[1-5],但这些方法操作烦琐、提取效率不稳定,并且酚和氯仿均有挥发毒性,长期使用严重危害人体健康。本研究采用自动化核酸提取工作站和磁珠法DNA提取试剂盒,对实验室中现有的带有分离胶的血细胞、EDTA抗凝全血和单纯血细胞3种样本进行DNA提取流程探索,同时尝试利用长时间、大规模、跨地区收集的唾液样本探讨口腔脱落黏膜上皮细胞取代血液成为获得基因组DNA样品的可行性。本研究还对质量控制合格的DNA样品,采用高通量测序技术检测与人体必需微量营养素叶酸代谢有关的亚甲基四氢叶酸还原酶(methylenetetrahydrofolate reductase,MTHFR)C677T基因多态性位点分型,以指导实验室下一步相关项目的现场样本采集、运输和保存。
1 材料和方法 1.1 样本来源样本来源于国家财政项目——中国疾病预防控制中心营养与健康所"农村义务教育学生营养改善计划"营养健康评估和膳食指导项目。人群试验方案通过中国疾病预防控制中心营养与健康所人体试验伦理道德专家委员会审批(2016-019),调查对象的监护人均签署了研究知情同意书。由各省、区(县)疾病预防控制中心具有医学检验资质的人员现场采集调查对象的静脉血和唾液样本。将采集的静脉血样静置30 min,301×g离心15 min分离血清和血细胞,然后分别暂存于碎冰中。在采集口腔黏膜上皮细胞前先漱口,冲洗口腔中过多的老化细胞、食物残渣、牙膏、咖啡、烟等杂质,0.5 h内禁水、禁食、禁烟,然后用手指轻揉双颊以助于口腔黏膜上皮细胞脱落,舌头围绕口腔刮取黏膜上皮细胞数次,随后让唾液自然流存到唾液收集器,或用口腔棉拭子轻擦颊黏膜10次后放入临时备用的盛有冰块的保温箱中。待当日现场采集工作结束后,将所有样本转移至-80 ℃环境中冻存,全程冷链运送至中国疾病预防控制中心营养与健康所实验室,置于-80 ℃低温冰箱内储存备用,运输、储存期间避免反复冻融。
1.2 试剂与仪器血液和唾液样本中量全血基因组核酸提取试剂盒(磁珠法)、新型红细胞裂解液、20 mg/mL蛋白酶K、全自动核酸提取仪和带滤网离心管(北京百泰克生物技术有限公司);无水乙醇和异丙醇(分析纯,北京化工厂有限责任公司);低速自动平衡离心机(北京时代北利离心机有限公司);Avanti J-25Ⅰ型高速离心机(美国Beckman公司);紫外光密度检测仪、旋涡振荡器(美国ThermoFisher Scientific公司);恒温水浴锅(北京国华医疗器械厂);带分离胶的真空采血管(广州阳普医疗科技股份有限公司);EDTA抗凝的真空采血管(浏阳市三力医用科技发展有限公司);含有唾液保护液A的采集管(北京百泰克生物技术有限公司);含有唾液保护液B的采集管(江苏一米生物科技有限公司)。
1.3 各种样本的DNA提取与评估取带有分离胶的血细胞、EDTA抗凝全血、分离血清后的凝固血细胞、新鲜唾液、-20 ℃保存1个月的唾液、带有2种唾液保护液的唾液样本和棉拭子来源的口腔黏膜上皮细胞样本,按照核酸提取试剂盒的说明书操作步骤进行操作,自动化提取程序依据厂家提供的步骤进行设定,并略作改动。对样本前处理步骤1、前处理步骤2和上机操作步骤2暂停后的试剂种类和用量反复测试,以确定合适的操作方式,每份样本重复测试6次。以上样本在实验前均储存于-80 ℃冰箱备用,避免反复冻融。
带有分离胶的血细胞:从-80 ℃冰箱中取出样本,置于4 ℃冰箱过夜解冻,然后转移至带滤网离心管4 ℃ 351×g离心5 min。吸取900 μL离心溶液转移至另一离心管中,加7 mL红细胞裂解液裂解细胞,颠倒混匀后4 ℃ 1 003×g离心1 min,弃上清。然后加入250 μL超纯水和50 μL蛋白酶K,并将沉淀涡旋均匀,随后将200 μL涡旋后的溶液转移至试剂盒中,前处理结束后的样本在全自动核酸提取仪上进行操作。步骤2暂停后取下试剂盒,在孔1和孔7中加入375 μL无水乙醇后继续进行自动化DNA提取实验。
EDTA抗凝全血:取200 μL样本,加入20 μL蛋白酶K,上机,步骤2暂停后取下试剂盒,在孔1和孔7中加入375 μL无水乙醇后继续进行自动化DNA提取实验。
分离血清后的凝固血细胞:取200 μL样本,加入40 μL蛋白酶K和100 μL去离子水,上机,步骤2暂停后取下试剂盒,在孔1和孔7中加入300 μL异丙醇后继续进行自动化DNA提取实验。
新鲜唾液:取350 μL唾液样本,加入20 μL蛋白酶K、10 μL核酸助沉剂和220 μL异丙醇,随后进行自动化DNA提取实验。
-20 ℃保存1个月的唾液样本与新鲜唾液的处理方式相同。
带有唾液保护液的唾液样本:2种唾液保护液和新鲜唾液样本均按照厂家使用说明书进行1∶1混合,然后取350 μL混合样本,加入40 μL蛋白酶K、10 μL核酸助沉剂和220 μL异丙醇,转移至核酸提取试剂盒的加样孔中涡旋均匀,上机。
口腔黏膜上皮细胞:在核酸提取试剂盒的加样孔中加350 μL样本、20 μL蛋白酶K、10 μL核酸助沉剂和220 μL异丙醇,涡旋混匀,50 ℃摇床中速消化过夜,上机。
自动化提取程序结束后取出搅拌套和试剂盒,试剂盒第6列和第12列每孔中转移出的DNA洗脱液体积均为80 μL,将获取的DNA溶液分别转移至带有样本编号的离心管中并于-80 ℃保存备用。
1.4 DNA检测方法清洗检测探头:吸取2.0 μL超纯水,小心地加到检测器探头上,然后闭合探头,使探头和上方触点均能接触到超纯水。反复开合探头数次后,用纸擦拭水分,重复2次。标定空白:打开NanoDrop 1000软件,吸取1.0 μL去离子水小心地加到检测器探头上,然后闭合探头。点击软件界面中"检测空白"按钮绘制空白对照曲线,重复2次。检测样本:吸取1.0 μL样本的DNA洗脱液,小心地加到检测器探头上,然后闭合探头。点击NanoDrop 1000软件界面中"检测样本"按钮,检测样本DNA洗脱液的纯度和浓度。
1.5 DNA质量控制样本DNA洗脱液D260/D280为1.6~2.0、D260/D230为1.0~2.5、曲线平滑并且在260 nm波长处出现峰值、检测浓度≥25 ng/μL,即判定为合格样品。纯DNA的D260/D280约为1.8,比值偏小表明DNA样品中有蛋白质、苯酚或其他污染物。纯DNA的D260/D230为1.8~2.2,比值偏小表明DNA样品中有污染物。
1.6 高通量测序技术检测MTHFR C677T基因多态性位点分型随机选取1人的2份合格DNA样品作为模板,对包含MTHFR C677T基因多态性位点的目的片段进行PCR扩增。上游引物为5′-CTGTGCAAGTTCTGGACCTGAG-3′,下游引物为5′-CTGTTGGAAGGTGCAAGATCAG-3′,待扩增目的片段长度为462 bp。MTHFR C677T基因多态性位点大致位于目的片段的中间位置,采用高通量测序技术对MTHFR C677T基因多态性位点进行分型检测。
1.7 统计学处理应用SPSS 18.0软件进行统计学分析。数据以x±s表示,组间比较采用配对t检验。检验水准(α)为0.05。
2 结果 2.1 不同样本DNA提取结果 2.1.1 带有分离胶的血细胞对实验室中-80 ℃冻存近1年的带有分离胶的血细胞样本进行DNA提取和检测,结果显示分离胶对血细胞DNA的提取效果影响显著,大部分血细胞与分离胶融为一体,在枪头的外力作用下仍然无法除去分离胶。本研究采用红细胞裂解液和带滤网离心管对样本进行了前处理,观察到血细胞与分离胶仍无法分离。在提取DNA的实验过程中黏稠的分离胶黏附在分离柱上,影响磁珠的吸附效果。随后对3 000份带有分离胶的血细胞样本进行提取和检测,DNA样品合格率为37.7%(1 130/3 000)。表明血液样本中的血细胞若用于后续的分子生物学实验,建议在血样采集过程中避免采用分离胶对血清和血细胞进行分离。
2.1.2 EDTA抗凝全血对8份EDTA抗凝全血进行DNA提取和检测,结果(表 1)显示DNA的浓度和纯度均符合后续分子生物学实验的要求,浓度为(180.20±20.30)mg/L,D260/D280为1.90±0.10,表明EDTA抗凝全血是一种获取DNA的理想样本。
|
|
表 1 7种样本提取DNA的浓度和纯度检测结果 Tab 1 Concentration and purity of DNA extracted from 7 kinds of samples |
2.1.3 分离血清后的凝固血细胞
对8份在-80 ℃冰箱中储存1个月的分离血清后的凝固血细胞样本进行DNA提取和检测,结果(表 1)显示DNA的浓度和纯度均符合后续分子生物学实验的要求,但浓度偏低,为28.91~34.53 mg/L,平均(31.72±2.81)mg/L。表明尽管分离血清后的凝固血细胞在实验室中以-80 ℃冷冻方式进行了保存,但分离血清后的凝固血细胞样本中核酸降解较严重,提取获得的有效DNA较少。若条件允许,可在血样采集即刻对分离血清后的血细胞进行DNA提取,避免血细胞DNA因降解而无法应用于后续实验。
2.1.4 新鲜唾液样本和-20 ℃保存1个月的唾液样本对8人的新鲜唾液样本和-20 ℃保存1个月的唾液样本分别进行DNA提取和检测,获得的DNA浓度分别为220.56、180.59、148.39、80.61、287.91、80.51、198.21、62.33 mg/L和198.49、157.68、149.50、100.10、295.45、60.23、160.32、81.59 mg/L,2种样本比较差异无统计学意义(P>0.05)。新鲜唾液样本提取得到的DNA浓度变异系数为3%~16%,-20 ℃保存1个月的唾液样本提取得到的DNA浓度变异系数为5%~21%,说明唾液样本储存时间长短不会对DNA提取效果造成明显影响。本研究对实验室保存的所有新鲜唾液样本和-20 ℃保存1个月的唾液样本进行DNA提取和检测,分别获得了96份和8份合格DNA样品(表 1),DNA浓度分别为(150.02±50.97)mg/L和(120.31±30.97)mg/L,D260/D280分别为1.80±0.15和1.83±0.10。说明在相同的洗脱体积下,新鲜唾液样本提取的DNA浓度略高于-20 ℃保存1个月唾液样本获取的DNA浓度,建议实验室在获得唾液样本后尽快提取DNA。
2.1.5 带有不同唾液保护液的唾液样本随机取唾液保护液A、B作用下的唾液样本均8份,提取获得的DNA浓度分别为57.98、39.29、35.46、74.64、64.02、27.72、43.33、34.26 mg/L和41.54、41.02、32.62、54.55、56.41、52.81、30.94、34.05 mg/L,2种样本比较差异无统计学意义(P>0.05)。本研究共获得有合格DNA的带有唾液保护液A、B的唾液样本均为8份,DNA浓度分别为(56.16±10.97)mg/L和(50.46±10.97)mg/L(表 1)。
2.1.6 口腔黏膜上皮细胞样本提取的DNA浓度为(48.41±9.81)mg/L(表 1),低于唾液样本来源的DNA浓度。
2.2 合格DNA样品MTHFR C677T基因多态性位点分型检测随机抽取1人的2份质量控制合格的DNA样品进行高通量测序,结果(图 1)显示,按照质量控制标准筛选的合格DNA样品可以实现体外目的基因片段的扩增和MTHFR C677T基因多态性位点的分型检测。
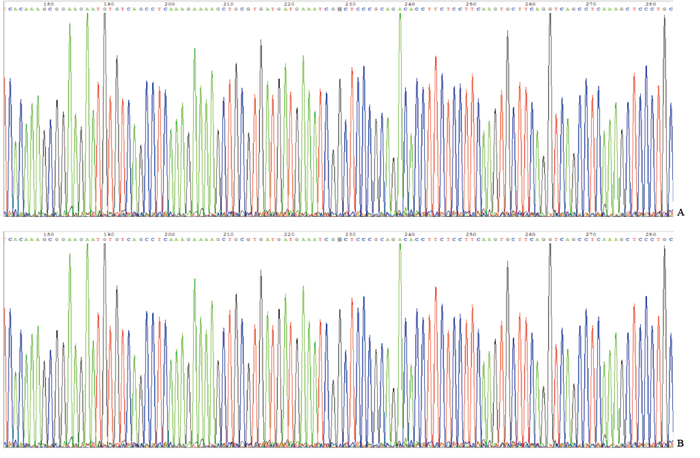
|
图 1 来自同一人的2个合格DNA样品的高通量测序结果 Fig 1 High-throughput sequencing of 2 qualifed DNA samples from one subject A: Fresh saliva; B: Coagulated blood cells after serum separation. |
3 讨论
本研究对带有分离胶的血细胞、EDTA抗凝全血和分离血清后的凝固血细胞分别进行了自动化DNA提取程序探索,其中带有分离胶的血细胞大部分与分离胶完全融为一体,在枪头等外力作用下仍然无法分离,并且检测得到DNA样品合格率仅为37.7%(1 130/3 000)。EDTA抗凝全血样本是一种获取DNA的理想样本。分离血清后的凝固血细胞样本提取DNA的浓度和纯度均符合后续分子生物学实验要求,但核酸降解较严重,提取得到的有效DNA较少,实际操作中应尽量避免以这种方式采集血液样本。
通过对新鲜唾液和-20 ℃保存1个月的唾液样本自动化DNA提取程序进行探索和DNA检测,结果显示2种样本经提取后得到的DNA浓度无明显差异,提示储存时间长短对唾液样本DNA的提取效果无明显影响。但在相同的洗脱体积下,前者提取得到的DNA浓度略高于后者,建议在获得唾液样本后尽快提取DNA。大范围收集样本时,唾液样本适合在多个收集点和实验室之间传送。通过唾液样本来获取人体的DNA可以最大限度地扩大取样范围,适用于大规模、跨地区和长时间研究项目。直接吐唾液的采样方式获取的DNA含量理想、DNA降解程度低、提取方法简单,应作为唾液标本采集的首选方式。陈嘉昌等[6]研究发现,利用棉拭子采集样本提取的DNA会出现严重降解,并且呈现明显的DNA拖尾凋亡条带。因为唾液中的脱落黏膜上皮细胞离开水相环境后凋亡速度加快,细胞膜和细胞核膜破裂使基因组DNA暴露在极易降解的环境中,所以若用棉拭子获取口腔黏膜上皮细胞应将取样的棉拭子放于保护液中湿法保存。本研究还对2种唾液保护液作用下的唾液样本进行了DNA检测,结果显示2种样本获得的DNA浓度无明显差异。
高通量测序结果显示,按照质量控制标准筛选的合格DNA样品可以实现体外目的基因片段的扩增和MTHFR C677T基因多态性位点的分型检测,表明血液和唾液均可以作为人体DNA的合适来源。目前,血液是传统上获取DNA的来源,但采集血液具有创伤性,给婴幼儿及老人带来痛苦,受试者易产生抗拒心理,增大了取样难度。唾液作为一种获取人体DNA的方式有如下优势:(1)采样具有非侵入性;(2)对采集耗材的要求简单;(3)无须对操作人员进行大量培训,简单讲解采集过程后受试者即可独立完成样本采集;(4)受试者无痛苦和创伤,可重复多次采样[7-8]。唾液经提取后获得的DNA样本中含有大量微生物DNA,高通量测序仍可以对目标片段进行成功测序,证实唾液中的微生物和食物残渣不会对基因多态性分析造成干扰,本研究结果与文献[9-10]报道类似。
综上所述,唾液样本易收集、储存方便、提取的DNA质量高,在流行病学研究中是血液的良好替代品,具有很高的研究和应用价值。
| [1] |
宋洁云, 刘芳宏, 马军, 陈远帆, 王海俊. 酚/氯仿法和盐析法提取人类外周血基因组DNA方法的比较[J]. 中国实验诊断学, 2013, 17: 802-805. DOI:10.3969/j.issn.1007-4287.2013.05.003 |
| [2] |
王韵, 徐冬冬. 改良酚/氯仿法提取人全血DNA的研究[J]. 现代医药卫生, 2013, 29: 161-162. DOI:10.3969/j.issn.1009-5519.2013.02.001 |
| [3] |
张玥, 徐国昌, 徐凯, 王友政, 任甫, 李红卫. 改良酚-氯仿法提取及不同试剂盒扩增检测陈旧性人骨DNA[J]. 重庆医科大学学报, 2015, 40: 1134-1137. |
| [4] |
姜海霞. 对苯酚氯仿法和盐析法提取DNA的归纳[J]. 中学生物学, 2014, 30: 53-54. |
| [5] |
朱伟锋, 罗达亚, 涂硕, 张霞丽, 揭克敏, 万福生. 盐析法快速提取口腔拭子DNA[J]. 第二军医大学学报, 2011, 32: 1370-1374. ZHU W F, LUO D Y, TU S, ZHANG X L, JIE K M, WAN F S. A rapid salting out method for DNA extraction from buccal swabs[J]. Acad J Sec Mil Med Univ, 2011, 32: 1370-1374. |
| [6] |
陈嘉昌, 张红宇, 彭瑾瑜, 付艳艳, 叶伟超, 常弘. 从唾液获取人体DNA的简易方法与应用[J]. 中山大学学报(医学科学版), 2006, 27: 171-173. |
| [7] |
HARTMAN M L, GOODSON J M, BARAKE R, ALSMADI O, AL-MUTAWA S, ARIGA J, et al. Salivary biomarkers in pediatric metabolic disease research[J]. Pediatr Endocrinol Rev, 2016, 13: 602-611. |
| [8] |
WONG D T W. Salivaomics[J]. J Am Dent Assoc, 2012, 143(10 Suppl): 19S-24S. |
| [9] |
张建伟, 戎志全, 乔文本, 张毅, 朱传福. 利用唾液标本进行HLA分型的可行性分析[J]. 山东医药, 2016, 56: 70-72. |
| [10] |
杨泽民, 林静, 陈龙辉, 张敏, 陈蔚文. 一种从唾液中快速提取基因组DNA的方法[J]. 第二军医大学学报, 2015, 36: 548-553. YANG Z M, LIN J, CHEN L H, ZHANG M, CHEN W W. A method for fast genomic DNA extraction from saliva and its application[J]. Acad J Sec Mil Med Univ, 2015, 36: 548-553. |
 2021, Vol. 42
2021, Vol. 42


