2. 安徽省第二人民医院眼科,合肥 230041
2. Department of Ophthalmology, the Second People's Hospital of Anhui Province, Hefei 230041, Anhui, China
皮脂腺的分泌物具有一定的杀菌作用,可阻止细菌生长;汗腺产生的IgA、黏蛋白1及溶酶体等则具有一定的免疫防御功能。当这些腺体部位因分泌物增厚、干燥受到阻塞时,眼的防御能力会受损,从而形成睑板腺慢性炎性肉芽肿[1]。睑板腺囊肿又称霰粒肿,是一种常发于儿童的眼科疾病。睑板腺囊肿病程缓慢,患者一般并无明显症状,但可因肿块压迫眼球而引起异物感或暂时性散光。严重者会导致眼睑外翻,眼部畸形,若有继发性感染会演变为睑腺炎[2]。睑板腺囊肿在儿童中有着较高的发病率,其治疗通常包括手术和非手术方式[3]。而手术常需在全身麻醉下进行,对患儿及家长会造成许多困扰。
有观点认为,肠道微生物是个体的新器官,其代谢活性仅次于肝脏[4]。肠道菌群被看作“第二基因组”“被遗忘的器官”或外挂“基因硬盘”。随着高通量测序技术出现,人类开始了肠道微生物组的探索,目前已经发现肠道微生物组的集体基因组包含超过300万个独特基因[5]。人们对肠道微生物组的了解正在迅速深入,并在探索微生物组与健康和疾病之间的关系。在眼科疾病中也已开展相关研究,如Ye等[6]报道的白塞病和肠道微生物群的研究。那么肠道菌群是否也可能在睑板腺囊肿中起作用呢?本研究拟对该问题进行探讨。
1 对象和方法 1.1 研究对象2019年1-12月在上海儿童医学中心招募21例睑板腺囊肿患儿(研究组)和26名健康体检儿童(健康对照组)。研究组纳入标准:(1)患儿临床确诊为睑板腺囊肿;(2)患儿过去2个月内未局部或系统使用过抗生素、糖皮质激素及免疫抑制剂;(3)无胃肠道疾病及其他系统性疾病。本研究通过上海儿童医学中心伦理委员会审批(SCMCIRB-K2020005-1)。在研究开始时,所有患儿家属均已签署研究知情同意书。所有试验程序均按照赫尔辛基宣言执行。
1.2 粪便样本采集和DNA提取收集受试者的新鲜粪便样本,并在2 h内用冰袋运送至上海儿童医学中心转化医学研究所实验室立即冷冻,保存在-80 ℃冰箱。取200 mg样品,按Qiagen粪便DNA快速提取试剂盒(德国Qiagen公司)说明书提取DNA。采用1.0%琼脂糖凝胶电泳法检测DNA的浓度和纯度。
1.3 16S rRNA的PCR扩增及MiSeq测序利用常用细菌引物515F(5'-GTGCCAGCMGCCGCG-GTAA-3')和926R(5'-CCGTCAATTCMTTTGAG-TTT-3')对16S rRNA进行PCR扩增。引物还包含用于两步扩增样本文库构建的Illumina 5'过剩适配器序列,遵循制造商关于过剩适配器序列的说明。在文库构建之前,使用DNA凝胶提取试剂盒(美国Axygen公司)进行纯化,并使用实时荧光定量PCR仪(FTC-3000,加拿大Funglyn Biotech公司)进行实时PCR扩增。在MiSeq测序平台(美国Illumina公司)上使用基因测序试剂盒v3(美国Illumina公司)对文库进行2×300 bp双端测序。
1.4 生物信息学分析原始fastQ文件是基于条形码进行多路复用的。所有样本的双末端读取通过Trimmomatic 0.35软件运行,以使用参数SLIDINGWINDOW:50∶ 20、MINLEN:50去除低质量的碱基序列。然后使用带有默认参数的Flash 1.2.11软件进一步合并修剪,基于筛选去除低质量重叠群。低质量重叠群过滤参数:最大N个数为0,最小长度为200,最大长度为580,最大碱基数为8。使用mothur 1.33.3、UPARSE usearch 8.1.1756(http://drive5.com/uparse/)和R 3.2.3软件分析16S rRNA序列。使用UPARSE管道将以97%的一致性序列归类为一个运算分类单位(operational taxonomic unit,OTU)。根据Silva 119数据库将OTU代表序列进行分类分配,通过分类使置信度得分≥0.8。OTU分类法(从门到种)是基于美国国家生物技术信息中心确定的。α多样性分析(Shannon和Chao1指数)采用mothur 1.33.3软件计算并使用R 4.1.0软件绘制。对于β多样性的度量,加权和非加权UniFrac(unweigted_UniFrac)距离矩阵由母矩阵计算,并采用主坐标分析(principal co-ordinates analysis,PCoA)和树矩阵R进行可视化。
1.5 统计学处理应用R 4.1.0软件进行统计学分析。计量资料若服从正态分布以x±s表示,两组间年龄、身高、BMI及Shannon、Chao1指数分布的比较采用独立样本t检验。计数资料以例数和百分数表示,两组间性别的比较采用χ2检验。差异菌种与睑板腺囊肿患儿临床病理因素的相关性分析采用corrplot分析。所有检验均为双侧检验,检验水准(α)为0.05。
2 结果 2.1 两组受试者一般资料共入选47例儿童,男20例、女27例,年龄为3~15(5.1±2.5)岁。两组受试者的性别、年龄、身高、体重、BMI差异均无统计学意义(P均>0.05)。见表 1。
|
|
表 1 两组受试者的一般情况 Tab 1 Basic characteristics of 2 groups |
2.2 样本特征及分组
47份样品共测出2 096 454条高质量的近全长16S rRNA序列,平均每份样品44 605条,其中睑板腺囊肿组共得到893 952条、健康对照组1 202 502条。47份样品中共聚类为411OTU,其中睑板腺囊肿组348 OUT、健康对照组390 OTU,327 OTU为两组共有。47份样品所有的物种分成9个门、117个属、137个种,两组的常见细菌门均是拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria),这3种菌门分别占肠道菌群的57.45%、35.80%和5.49%。稀疏曲线显示认为测序深度已基本覆盖样品中所有的物种,物种积累曲线显示认为抽样量足够充分(图 1)。

|
图 1 两组受试者肠道菌群的稀疏曲线(A)和物种积累曲线(B) Fig 1 Rarefaction curves (A) and species accumulation curves (B) of intestinal flora in 2 groups OTU: Operational taxonomic unit. |
2.3 α多样性分析
通过mothur软件计算所得的Shannon和Chao1指数分析α多样性,Shannon指数越大说明个体内的微生物群落多样性越高,Chao1指数越大说明物种总数越多。见图 2,健康对照组与睑板腺囊肿组间的Shannon指数分布(2.81±1.15 vs 2.59±0.84)、Chao1指数分布(160.72±108.45 vs 144.29±45.67)差异均无统计学意义(P=0.48、0.28)。

|
图 2 两组样品的Shannon (A)、Chao1 (B)指数箱式图 Fig 2 Shannon(A) and Chao1 (B) index box diagram of samples in 2 groups |
2.4 β多样性分析
基于非加权UniFrac距离的PCoA显示两组聚类效果均不佳,表明健康对照组和睑板腺囊肿组样品彼此间的距离差异无统计学意义(P>0.05),两组样品微生物的种类及丰度均相似(图 3A),多样性矩阵图反映的结果也类似(图 3B)。

|
图 3 两组样品的PCoA图(A)和多样性矩阵图(B) Fig 3 PCoA diagram (A) and diversity matrix diagram (B) of samples in 2 groups PCoA: Principal co-ordinates analysis; PC: Principal component. |
2.5 两组肠道菌群不同分类水平的相对丰度分析
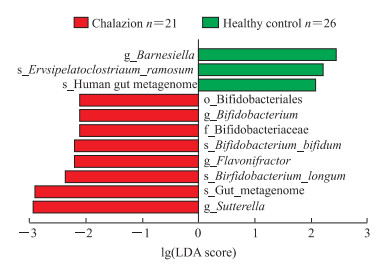
应用线性判别分析效应大小(linear discriminant analysis effect size,LEfSe)基于|lg(LDA得分)|>2[LDA为线性判别分析(linear discriminant analysis)]筛选健康对照组和睑板腺囊肿组间的所有水平差异物种。共获得11个差异物种,其中健康对照组有3个,分别为属水平的巴恩斯氏菌(Barnesiella)、种水平的多枝梭菌(Erysipelatoclostridium_ramosum)、种水平的human_gut_metagenome;睑板腺囊肿组有8个,分别为目水平的双歧杆菌(Bifidobacteriales)、属水平的双歧杆菌(Bifidobacterium)、科水平的双歧杆菌(Bifidobacteriaceae)、种水平的两歧双歧杆菌(Bifidobacterium_bifidum)、属水平的粪杆菌(Flavonifractor)、种水平的长双歧杆菌(Bifidobacterium_longum)、种水平的gut_metagenome、属水平的萨特氏菌(Sutterella)。见图 4。在LEfSe分析基础上基于物种绝对丰度利用R 4.1.0软件进行ANOSIM分析,在属水平上r=-0.013、P=0.615,表示组间和组内没有明显差异(图 5A);在种水平(图 5B)上r=0.055、P=0.048,表示组间和组内存在差异。采用t检验和metastas分析健康对照组和睑板腺囊肿组的所有水平差异物种,t检验结果显示门、纲、目、科水平均未见差异物种,属水平有3种差异物种(Barnesiella、Faecalitalea、Terrisporobacter)(图 5C),而种水平则有4种差异物种(Bacteroides_fragilis、gut_metagenome、human_gut_metagenome、Alistipes_sp._N15.MGS-157)(图 5D);metastats检验结果显示,在门水平发现1个差异物种(Tenericutes)、纲水平发现1个差异物种(Mollicutes),目水平发现2个差异物种(Micrococcales、Rickettsiales),科水平发现4个差异物种(Leptotrichiaceae、Cellulomonadaceae、Staphylococcaceae、Paenibacillaceae),属水平发现13个差异物种,种水平发现23个差异物种,见表 2。综合以上结果,最后筛选出的差异菌种为gut_metagenome和human_gut_metagenome,可能有进一步研究价值。
|
图 4 两组间物种差异的LEfSe分析 Fig 4 LEfSe analysis of species differences between 2 groups LEfSe: Linear discriminant analysis effect size; LDA: Linear discriminant analysis; g: Genus; s: Species; o: Order; f: Family. |

|
图 5 两组间差异物种的ANOSIM分析(A、B)和t检验(C、D)结果 Fig 5 ANOSIM analysis (A, B) and t-test (C, D)of differential species between 2 groups A, C: Genus; B, D: Species. *P < 0.05, **P < 0.01. x±s. |
|
|
表 2 两组受试者肠道菌群属水平及种水平差异物种(metastats分析) Tab 2 Differential species of intestinal flora on genus level and species level between 2 groups (metastats analysis) |
2.6 差异物种筛选
采用corrplot方法分析探讨gut_metagenome和human_gut_metagenome与睑板腺囊肿患儿临床病理因素的相关性,结果显示gut_metagenome与睑板腺囊肿个数、破溃及术后复发呈强相关性(r=0.70、0.76、0.85,P均<0.01;表 3)。
|
|
表 3 不同菌株与睑板腺囊肿患儿临床病理特征的相关性分析 Tab 3 Correlation analysis between different strains and clinicopathological characteristics in children with chalazion |
3 讨论
人类肠道系统大约有1 000多种细菌,粪便中微生物的密度为(1 013~1 014)/g[7]。肠道菌群在调节机体免疫平衡和维持肠道正常生理功能、免疫系统中具有重要作用,关于肠道菌群与人体疾病的相关研究不断涌现,肠道微生物备受关注。在儿童中,关于肠道菌群的研究众多,如儿童免疫、发育、肥胖及过敏等均已被证实和肠道菌群失调相关[8]。睑板腺慢性炎症是造成儿童睑板腺囊肿的原因,肠道菌群被认为参与炎症过程,但目前关于睑板腺囊肿儿童肠道菌群的结构特征尚未见报道。本研究希望验证健康儿童与睑板腺囊肿患儿的肠道菌群差异,以期探寻肠道菌群改变在睑板腺囊肿发生、发展中的可能作用。
本研究共得到了2 096 454条序列,聚类成411 OTU,分成9个门、117个属、137个种,两组常见的细菌门均是拟杆菌门、厚壁菌门、变形菌门,两组拟杆菌门和厚壁菌门之和占肠道菌群的90%以上,拟杆菌门的含量更高,与其他研究结果[9]一致。以往研究认为,当身体遭受严重感染、严重创伤和其他攻击时肠道菌群平衡会被破坏,益生菌双歧杆菌的繁殖受到限制,病原体大肠杆菌大量繁殖并转移到血液循环中,引起菌血症并促发全身性炎症[10]。既往在结直肠癌、炎症性肠病、肝硬化等疾病的研究中证实,肠道菌群的物种多样性在健康状态下明显高于疾病状态[11]。本研究中α多样性分析和β多样性分析结果提示健康对照组和睑板腺囊肿组的菌群组成较为相似,这提示与儿童睑板腺囊肿疾病状态相关的可能是特定的物种变化而非整体的菌群组成。
本研究通过从门、纲、目、科、属逐层分析发现,睑板腺囊肿组与健康对照组物种分布存在部分差异;进一步通过LEfSe分析和物种绝对丰度分析分别筛选到11个和44个差异物种,在这些差异物种中gut_metagenome和human_gut_metagenome为上述分析所得的种水平共有差异物种。与健康对照组相比,睑板腺囊肿组儿童的gut_metagenome菌种含量增加,而human_gut_metagenome菌种含量下降。gut_metagenome和human_gut_metagenome对应的菌属分别是萨特氏菌属(Sutterella)和蓝绿藻菌属(Lachnoclostridium)。萨特氏菌属与自闭症、唐氏综合征和炎症性肠病等多种人类疾病相关,其成员广泛存在于人类胃肠道中,具有促炎和免疫调节作用,对与微生物群失调和变形杆菌增加有关的上皮稳态破坏无明显相关性[12]。蓝绿藻菌属与自闭症、宫颈癌和食物过敏等多种人类疾病相关[13],且在小肠肿瘤、桥本甲状腺炎等多种疾病中蓝绿藻菌属均呈下降趋势[14]。本研究中gut_metagenome和human_gut_metagenome的变化趋势与以往研究结果一致。本研究进一步采用corrplot方法探讨gut_metagenome和human_gut_metagenome与睑板腺囊肿患儿临床病理因素的相关性,结果显示gut_metagenome与睑板腺囊肿的个数、破溃及术后复发呈强相关性。这提示萨特氏菌属的gut_metagenome菌种可能在儿童睑板腺囊肿的发生、发展中起到一定作用。
“肠-眼”轴的存在证明肠道菌群的变化和眼部疾病的发生与发展紧密相关。目前,越来越多的研究将肠道与眼睛联系到了一起,来自啮齿动物的研究表明肠道菌群失调可能在许多眼科疾病的发生和恶化中发挥作用,包括糖尿病性视网膜病变、老年性黄斑变性、脉络膜新生血管、葡萄膜炎和青光眼等[15-16]。许多研究显示,儿童睑板腺囊肿的危险因素主要包括便秘、偏食、胃炎、肠易激综合征、睑板腺功能障碍及家族史[17-18]。本研究中,睑板腺囊肿患儿肠道中萨特氏菌属的gut_metagenome菌种含量增加,而蓝绿藻菌属的human_gut_metagenome菌种含量下降,进一步提示儿童睑板腺囊肿的发病可能与饮食或胃肠道功能有关,睑板腺囊肿发病可能是由于饮食或肠道功能导致肠道内菌群结构发生变化,从而导致相关代谢产物经血液循环输送到眼部影响眼部功能,相关机制有待进一步研究。
本研究不足之处是为单中心、小样本研究。但根据既往及本次研究结果可认为,差异菌种gut_metagenome和human_gut_metagenome可能在儿童睑板腺囊肿发生、发展中发挥作用,尤其是菌种gut_metagenome与儿童睑板腺囊肿的个数、破溃及术后复发呈强相关性。这提示gut_metagenome可能是一个独立于临床病理因素的、与睑板腺囊肿病情相关的微生物指标,但其具体作用和机制有待进一步研究。
| [1] |
BUTOVICH I A. Lipidomics of human Meibomian gland secretions: chemistry, biophysics, and physiological role of Meibomian lipids[J]. Prog Lipid Res, 2011, 50: 278-301. DOI:10.1016/j.plipres.2011.03.003 |
| [2] |
OZER P A, GURKAN A, KURTUL B E, KABATAS E U, BEKEN S. Comparative clinical outcomes of pediatric patients presenting with eyelid nodules of idiopathic facial aseptic granuloma, hordeola, and chalazia[J]. J Pediatr Ophthalmol Strabismus, 2016, 53: 206-211. DOI:10.3928/01913913-20160511-03 |
| [3] |
ILHAN C, OZGUL YILMAZOGLU M, YILMAZBAS P. The effects of chalazion surgery on intraocular pressure and corneal topography[J]. Int Ophthalmol, 2019, 39: 1055-1059. DOI:10.1007/s10792-018-0912-4 |
| [4] |
O'HARA A M, SHANAHAN F. The gut flora as a forgotten organ[J]. EMBO Rep, 2006, 7: 688-693. DOI:10.1038/sj.embor.7400731 |
| [5] |
QIN J, LI R, RAES J, ARUMUGAM M, BURGDORF K S, MANICHANH C, et al. A human gut microbial gene catalogue established by metagenomic sequencing[J]. Nature, 2010, 464: 59-65. DOI:10.1038/nature08821 |
| [6] |
YE Z, ZHANG N, WU C, ZHANG X, WANG Q, HUANG X, et al. A metagenomic study of the gut microbiome in Behcet's disease[J/OL]. Microbiome, 2018, 6: 135. DOI: 10.1186/s40168-018-0520-6.
|
| [7] |
LEY R E, TURNBAUGH P J, KLEIN S, GORDON J I. Microbial ecology: human gut microbes associated with obesity[J]. Nature, 2006, 444: 1022-1023. DOI:10.1038/4441022a |
| [8] |
ZHUANG L, CHEN H, ZHANG S, ZHUANG J, LI Q, FENG Z. Intestinal microbiota in early life and its implications on childhood health[J]. Genomics Proteomics Bioinformatics, 2019, 17: 13-25. DOI:10.1016/j.gpb.2018.10.002 |
| [9] |
GU S, CHEN Y, ZHANG X, LU H, LV T, SHEN P, et al. Identification of key taxa that favor intestinal colonization of Clostridium difficile in an adult Chinese population[J]. Microbes Infect, 2016, 18: 30-38. DOI:10.1016/j.micinf.2015.09.008 |
| [10] |
SAMUELSON D R, CHARLES T P, DE LA RUA N M, TAYLOR C M, BLANCHARD E E, LUO M, et al. Analysis of the intestinal microbial community and inferred functional capacities during the host response to Pneumocystis pneumonia[J]. Exp Lung Res, 2016, 42: 425-439. DOI:10.1080/01902148.2016.1258442 |
| [11] |
KAU A L, AHERN P P, GRIFFIN N W, GOODMAN A L, GORDON J I. Human nutrition, the gut microbiome and the immune system[J]. Nature, 2011, 474: 327-336. DOI:10.1038/nature10213 |
| [12] |
HⅡPPALA K, KAINULAINEN V, KALLIOMÄKI M, ARKKILA P, SATOKARI R. Mucosal prevalence and interactions with the epithelium indicate commensalism of Sutterella spp[J/OL]. Front Microbiol, 2016, 7: 1706. DOI: 10.3389/fmicb.2016.01706.
|
| [13] |
WANG Z, WANG Q, ZHAO J, GONG L, ZHANG Y, WANG X, et al. Altered diversity and composition of the gut microbiome in patients with cervical cancer[J/OL]. AMB Express, 2019, 9: 40. DOI: 10.1186/s13568-019-0763-z.
|
| [14] |
YOUSSEF O, LAHTI L, KOKKOLA A, KARLA T, TIKKANEN M, EHSAN H, et al. Stool microbiota composition differs in patients with stomach, colon, and rectal neoplasms[J]. Dig Dis Sci, 2018, 63: 2950-2958. DOI:10.1007/s10620-018-5190-5 |
| [15] |
FERNANDES R, VIANA S D, NUNES S, REIS F. Diabetic gut microbiota dysbiosis as an inflammaging and immunosenescence condition that fosters progression of retinopathy and nephropathy[J]. Biochim Biophys Acta Mol Basis Dis, 2019, 1865: 1876-1897. DOI:10.1016/j.bbadis.2018.09.032 |
| [16] |
SHIVAJI S. Connect between gut microbiome and diseases of the human eye[J]. J Biosci, 2019, 44: 1-5. DOI:10.1007/s12038-018-9822-x |
| [17] |
林萍, 刘彦芳, 武志清. 儿童多发性睑板腺囊肿的相关危险因素分析[J]. 国际眼科杂志, 2018, 18: 751-753. DOI:10.3980/j.issn.1672-5123.2018.4.41 |
| [18] |
CHEN L, CHEN X, XIANG Q, ZHENG Y, PI L, LIU Q, et al. Prevalence of low serum vitamin a levels in young children with chalazia in southwest China[J/OL]. Am J Ophthalmol, 2014, 157: 1103-1108. e2. DOI: 10.1016/j.ajo.2014.02.020.
|
 2021, Vol. 42
2021, Vol. 42


