缺血性脑血管病既可继发于出血性脑血管病、脑肿瘤和脑外伤等脑部疾病,也可见于休克等全身性缺血性疾病后,其因高发病率、高致残率和高病死率已成为全球性公共卫生事件[1-2]。深入研究急性脑缺血发生、发展的原因和机制及探寻改善脑缺血患者预后的手段迫在眉睫。环状RNA是一类广泛存在于细胞质的非编码RNA,这些内源性RNA结构稳定、组织特异性表达高[3]。环状RNA-ZNF292(circular RNA-ZNF292,cZNF292)是一种新发现的内源性非编码RNA,研究发现其可介导缺血性疾病的发生、发展,但具体机制尚不清楚[4]。本研究拟探索cZNF292对于缺血后神经元细胞氧化应激和凋亡的影响,旨在为临床研发脑缺血损伤治疗药物提供实验基础。
1 材料和方法 1.1 原代神经元培养选取胎龄为18 d的SD胎鼠(由上海钰森生物技术有限公司提供)以75%乙醇浸泡1 min后,在无菌条件下用刀片切取鼠头并解剖出完整大脑。在预冷PBS中分离去除软脑膜及血块,取大脑皮质用PBS漂洗1~3次,然后利用眼科剪将大脑皮质剪成1 mm3的碎块。将皮质组织碎块转移至离心管,加入2 mL 0.25%胰酶,在恒温培养振荡器中(37 ℃、转速80 r/min)首次消化8 min后弃上清,再用PBS清洗3次。重新加入2 mL 0.25%胰酶,用吸管轻轻吹打,收集的悬液及时加入含10% FBS的DMEM完全培养基中和后放置在冰盒上,重复该步骤5~6次,直至组织块完全消化。后将终止消化的混合液经200目一次性筛网滤过,滤过液以1 000 r/min(离心半径为10 cm)离心6 min,用含10% FBS的培养基重悬细胞,细胞计数后转移至培养瓶中,置于37 ℃、5% CO2培养箱中差速贴壁培养1 h,将未贴壁细胞悬液转移至离心管,采用锥虫蓝染色法检测细胞成活率。再用含10% FBS的培养基将细胞密度调整为1×107/mL,以每孔100 μL接种于96孔培养板,于37 ℃、5% CO2培养箱中培养24 h直至细胞贴壁,更换培养基继续培养3 d。每天于倒置显微镜下观察神经元生长情况。
1.2 氧糖剥夺/复氧细胞模型建立取培养5 d的神经元分为4组,每组6个复孔。(1)空白对照组:单纯含10% FBS的DMEM完全培养基;(2)正常对照组:原代神经元+含10% FBS的DMEM完全培养基;(3)原代神经元+4 mmol/L Na2S2O4+含10% FBS的DMEM完全培养基;(4)原代神经元+10 mmol/L Na2S2O4+含10% FBS的DMEM完全培养基。氧糖剥夺时间分别设为1、2、3、4 h,干预结束后更换含10% FBS的DMEM完全培养基复氧培养,复氧培养时间分别设为0、5、15、30 h。
1.3 细胞骨架蛋白和β3-微管蛋白免疫荧光染色观察神经元的形态变化将培养5 d的原代神经元分为对照组和Na2S2O4组。对照组神经元正常培养,Na2S2O4组神经元分别用4 mmol/L和10 mmol/LNa2S2O4干预1、2、3和4 h。之后从96孔培养板中取出神经元细胞爬片,PBS轻轻洗涤3次,洗去未贴壁的细胞,每次持续3 min。吸弃PBS,加入预冷的4%甲醇固定10 min,再用PBS轻轻洗涤3次提高细胞骨架的稳定性,每次持续3 min,吸弃PBS。滴加10%牛血清白蛋白(bovine serum albumin,BSA)封闭液,将细胞爬片放入湿盒,室温下封闭10 min,用PBS洗去细胞爬片上的封闭液。滴加抗肌动蛋白一抗(稀释比例为1∶1 000),湿盒中孵育1 h,再用PBS轻轻洗涤3次,每次持续3 min。在细胞爬片上滴加二抗稀释液(稀释比例为1∶100),室温下于湿盒中避光孵育40 min,吸弃二抗液体,用PBS轻轻洗涤3次,每次持续3 min。加入DAPI(稀释比例为1∶20 000)静置10 min,再用PBS轻轻洗涤3次,每次持续3 min,干燥细胞爬片。滴加5 μL封片剂于载玻片上,将细胞爬片细胞面向下盖于封片剂上,避免产生气泡。用荧光显微镜在100倍油镜下观察。绿色或红色荧光所在区域即为肌动蛋白的存在部位,微管蛋白呈绿色或红色丝状分布于细胞质中。β3-微管蛋白免疫荧光染色实验则是用抗β3-微管蛋白一抗和二抗分别替换抗肌动蛋白一抗和二抗,其他实验步骤同上。
1.4 FITC标记鬼笔环肽(phalloidin)染色观察不同浓度Na2S2O4对神经元存活率的影响取培养5 d的原代神经元,吸弃培养基,用PBS清洗2次,后用溶于PBS的4%多聚甲醛室温固定10 min,再用PBS室温清洗3次,每次30 s。用破膜缓冲液室温透化细胞5 min,再用PBS清洗细胞3次。取200 μL FITC标记鬼笔环肽染色工作液孵育细胞30 min,用PBS清洗3次。直接将盖玻片倒置在含DAPI的抗荧光淬灭封片剂(Cat#MM1402,上海懋康生物科技有限公司)上,然后吸掉多余抗荧光淬灭封片剂并用指甲油密封。选择FITC激发/发射滤片和DAPI激发/发射滤片,荧光显微镜下观察。培养的原代神经元经兔抗大鼠肌钙蛋白Ⅰ多克隆抗体与FITC标记山羊抗兔IgG抗体染色后,于倒置荧光显微镜下可观察到F肌动蛋白为绿色荧光,而DAPI染色的细胞核呈蓝色荧光。
1.5 cZNF292敲减细胞模型构建将神经元接种到24孔板,每孔5 000个细胞、0.1 mL培养基,在37 ℃、5% CO2培养箱中培养过夜。在1 mL靶细胞维持培养基中加入终浓度为5 μg/mL的聚凝胶1 mL混匀,待细胞融合度达到60%后,弃上清并加入慢病毒原液(HG-LPKC100,长沙艾碧维生物科技有限公司)100 μL,目标序列为5'-CAGAACACACACTATAGAG-3'(T为干扰碱基位点),病毒滴度为4×108 TU/mL[TU为转导单位(transduction unit)],同时建立空白对照(加入慢病毒原液)组。转染20 h更换为正常培养基,培养3 d后利用倒置荧光显微镜观察绿色荧光蛋白。然后采用终浓度为1 μg/mL的嘌呤霉素筛选稳转细胞株,持续4周。再对cZNF292敲减组和正常对照组细胞进行PCR以验证cZNF292转录水平。
1.6 PCR检测cZNF292表达水平取冻存已裂解的原代神经元,每1 mL经TRIzol试剂裂解的样品中加入0.2 mL氯仿,盖紧管盖后于4 ℃以12 000 r/min(离心半径为10 cm)离心15 min;将水相上层转移到无RNA酶离心管中,加等体积异丙醇混合后孵育10 min,再次于4 ℃以12 000 r/min(离心半径10 cm)离心10 min;移去上清液加入75%乙醇混匀,于4 ℃以7 000 r/min(离心半径为10 cm)离心5 min,加入无RNA酶水40 μL吹打均匀,获得细胞总RNA。采用反转录PCR试剂盒(SuperScript Ⅳ,美国ThermoFisher Scientific公司),将测定过浓度及纯度的样品总RNA稀释至250 ng/μL,然后加入缓冲液体系(5×基因组DNA去除缓冲液2 μL、基因组DNA去除液1 μL、总RNA 4 μL、无RNA酶污染的双蒸水3 μL)去除基因组DNA,缓冲液应先配制好,每个样品1个复孔,多配2孔,即配制n+2份体系,待需要时加入。之后放在涡旋振荡器上剧烈震荡10 s,4 ℃ 12 000 r/min(离心半径为10 cm)离心1 min,使混合液留在管底;打开普通PCR仪,进行反转录反应获得模板DNA。缓冲液应先配好n+2份,待需要时加入(均在冰上进行),体系如下:5×PrimeScript缓冲液4 μL、PrimeScript缓冲液转录混合酶Ⅰ 1 μL、转录体系复合物1 μL、上述去除基因组DNA缓冲液体系10 μL、无RNA酶污染的双蒸水4 μL;然后在普通PCR仪上进行PCR扩增(反应体系:10×缓冲液2 μL,脱氧核糖核苷三磷酸1.6 μL,上游引物0.6 μL,下游引物0.6 μL,热聚合酶1 μL,双蒸水12.2 μL,模板DNA 2 μL)。cZNF292上游引物序列为5'-GCTCAAGAGACTGGGGTGTG-3',下游引物序列为5'-AGTGTGTGTTCTGGGGCAAG-3';内参照基因β肌动蛋白上游引物序列为5'-CCTC-GCCTTTGCCGATCC-3',下游引物序列为5'-GG-ATCTTCATGAGGTAGTCAGTC-3'。取目的基因PCR扩增产物8 μL和上样缓冲液2 μL混合,以β肌动蛋白扩增产物为内参照,加入溴乙锭染色后进行电泳分离,采用凝胶成像系统采集图像并分析结果。
1.7 ELISA检测活性氧(reactive oxygen species,ROS)、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)和乳酸脱氢酶(lactate dehydrogenase,LDH)水平收集正常对照组、氧糖剥夺组、氧糖剥夺+空转慢病毒组和氧糖剥夺+敲减cZNF292组培养基和细胞,采用ELISA检测培养基中MDA、ROS、SOD和LDH水平。实验步骤完全按照试剂盒说明书进行,各组结果以正常对照组作为参照。MDA、ROS、SOD、LDH的ELISA检测试剂盒分别购自美国MyBioSource公司、美国Biovision公司、美国MyBioSource公司、美国开曼公司,货号分别为MBS284629、E5004-100、MBS262339、601170-96。
1.8 蛋白质印迹法检测caspase 3及细胞周期蛋白G1(cyclin G1,CCNG1)表达水平提取细胞总蛋白,蛋白定量后取20 μg进行SDS-PAGE,然后湿转至PVDF膜上。将膜用5%脱脂牛奶封闭1 h后,分别加入一抗caspase 3兔抗鼠单克隆抗体(货号9664T,美国CST公司,稀释比例1∶200)、CCNG1胎鼠抗大鼠单克隆抗体(货号sc-320,美国Santa Cruz公司,稀释比例1∶200),内参照为β肌动蛋白(β肌动蛋白单克隆抗体购自北京博奥森生物技术有限公司,货号bsm-33139M),4 ℃孵育过夜。加入HRP标记的二抗山羊抗兔抗体(货号7074S,美国CST公司,稀释比例1∶1 000)、多克隆抗胎鼠抗体(货号sc-525409,美国Santa Cruz公司,稀释比例1∶1 000),室温孵育2 h,TBST洗膜3次。滴加发光液后通过凝胶成像系统采集图像。
1.9 统计学处理应用SPSS 20.0软件进行统计学分析。实验重复3次。计量资料以x±s表示,多组间比较采用单因素方差分析,任意两组间比较采用t检验。检验水准(α)为0.05。
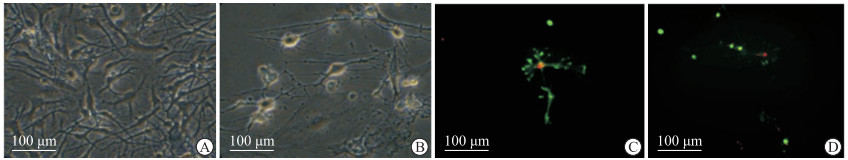
2 结果 2.1 缺氧培养后神经元的形态变化白光镜下可见正常神经元形态饱满,折光性强,细胞核明显,突起清晰(图 1A);在缺氧环境下神经元发生细胞皱缩,折光性差,细胞质不清,突起不清晰(图 1B)。细胞骨架染色荧光显微镜下可见,正常神经元骨架完整,形态正常(图 1C);而在缺氧环境下神经元骨架分离,形态变形(图 1D)。
|
图 1 原代神经元形态及细胞骨架染色结果 Fig 1 Morphology of primary neurons and staining of cytoskeleton A, B: Cellular morphology of primary neurons in normal culture (A) and oxygen deprivation culture (B); C, D: Cytoskeleton staining of primary neurons in normal culture (C) and oxygen deprivation culture (D). |
2.2 不同缺氧时间原代神经元的形态变化
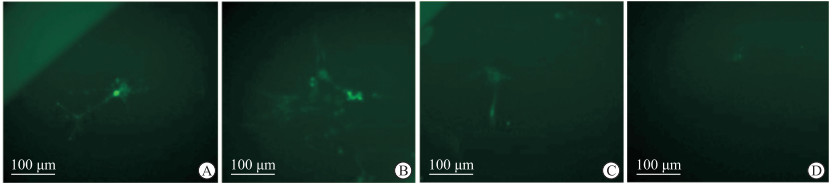
β3-微管蛋白染色荧光显微镜下观察可见,加入Na2S2O4诱发缺氧1 h时神经元呈树形,可清晰辨别结构;缺氧2 h时神经元变成圆形,细胞逐渐展开,变为多边形、不规则形等形态;缺氧3 h时结构逐渐分散,神经元开始变得模糊;缺氧4 h时神经元已经变得模糊不清,分辨不出胞体和轴突(图 2)。因而本实验采用缺氧4 h的细胞进行后续实验。
|
图 2 β3-微管蛋白免疫荧光染色观察不同缺氧时间原代神经元的形态变化 Fig 2 Morphology changes of primary neurons at different oxygen deprivation time-points observed by β3-tubulin immunofluorescence staining A: 1 h; B: 2 h; C: 3 h; D: 4 h. |
2.3 不同浓度Na2S2O4对原代神经元存活率的影响
在含10% FBS的DMEM完全培养基中神经元F肌动蛋白及细胞核分布密集,加入4 mmol/L的Na2S2O4后F肌动蛋白及细胞核则变得相对稀少,而加入10 mmol/L的Na2S2O4后F肌动蛋白及细胞核的数量明显减少,提示原代神经元的生长被明显抑制(图 3)。因而本实验选择加入10 mmol/L的Na2S2O4建立氧糖剥夺细胞模型。

|
图 3 异硫氰酸荧光素标记鬼笔环肽染色观察原代神经元的立体结构 Fig 3 Stereostructure of primary neurons observed by fluorescein isothiocyanate-phalloidin staining A: Control; B: 4 mmol/L Na2S2O4; C: 10 mmol/L Na2S2O4. |
2.4 不同复氧时间对原代神经元cZNF292表达的影响
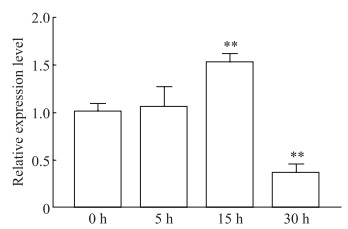
利用10 mmol/L Na2S2O4对原代神经元进行氧剥夺培养4 h后开始复氧,并通过PCR检测cZNF292在不同复氧时间的表达水平,结果显示复氧培养3个时间点(5、15和30 h)中,复氧培养15 h时cZNF292表达水平最高。见图 4。故选择缺氧培养4 h后复氧培养15 h进行后续实验。
|
图 4 PCR检测不同时间复氧对原代神经元cZNF292表达的影响 Fig 4 Effect of reoxygenation at different time-points on cZNF292 expression in primary neurons detected by PCR **P < 0.01 vs 0 h group. n=3, x±s. PCR: Polymerase chain reaction; cZNF292: Circular RNA-ZNF292. |
2.5 氧糖剥夺对原代神经元MDA、ROS、SOD和LDH水平的影响
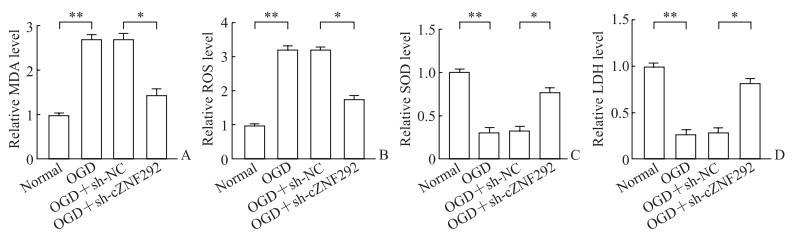
ELISA检测结果显示,相比正常细胞,氧糖剥夺细胞模型培养基中ROS和MDA水平均上升[(1 330.67±31.46)U/mL vs(418.45±18.68)U/mL、(18.03±1.86)nmol/mL vs(7.36±1.28)nmol/mL],SOD和LDH水平均下降[(39.71±5.71)nmol/mL vs(101.84±14.13)nmol/mL、(48.43±5.36)U/L vs(186±16.28)U/L],差异均有统计学意义(P均 < 0.05)。
2.6 敲减cZNF292对原代神经元MDA、ROS、SOD和LDH水平的影响PCR检测结果显示,与不敲减cZNF292组相比,敲减cZNF292组细胞中cZNF292表达水平下降(0.23±0.03 vs 1.09±0.21,P < 0.01)。ELISA检测结果(图 5)显示,原代神经元敲减cZNF292后,培养基中MDA和ROS水平均下降,SOD和LDH水平均上升(P均 < 0.05)。
|
图 5 ELISA法检测敲减cZNF292对原代神经元MDA、ROS、SOD和LDH表达的影响 Fig 5 Effect of knockdown of cZNF292 on expression of MDA, ROS, SOD and LDH in primary neurons detected by ELISA *P < 0.05, **P < 0.01. n=3, x±s. ELISA: Enzyme-linked immunosorbent assay; cZNF292: Circular RNA-ZNF292; MDA: Malondialdehyde; ROS: Reactive oxygen species; SOD: Superoxide dismutase; LDH: Lactate dehydrogenase; OGD: Oxygen and glucose deprivation; sh: Short hairpin RNA; NC: Normal control. |
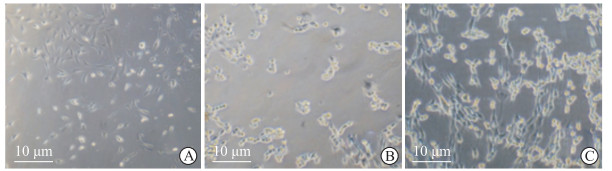
2.7 氧糖剥夺和敲减cZNF292后原代神经元的形态变化
40倍光镜下观察可见,原代神经元在氧糖剥夺后胞体变圆并聚集成簇,而在敲减cZNF292后神经元密度增加、形态恢复(图 6),提示cZNF292表达可能参与缺氧缺血环境下的神经元损伤恢复。
|
图 6 光镜下观察OGD和敲减cZNF292后原代神经元的形态变化 Fig 6 Morphological changes of primary neurons after OGD and knockdown of cZNF292 observed under light microscope A: Normal; B: OGD+sh-NC; C: OGD+sh-cZNF292. OGD: Oxygen glucose deprivation; cZNF292: Circular RNA-ZNF292; sh: Short hairpin RNA; NC: Normal control. |
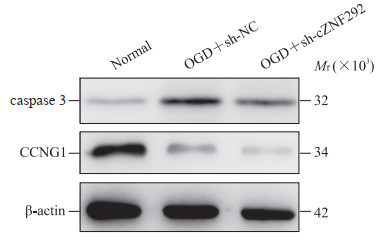
2.8 氧糖剥夺和敲减cZNF292对原代神经元caspase 3及CCNG1表达的影响
蛋白质印迹法检测结果显示,氧糖剥夺+未敲减cZNF292组原代神经元中caspase 3的表达水平(0.96±0.21)较正常培养组(0.31±0.07)升高(P < 0.05),而氧糖剥夺+敲减cZNF292组caspase 3的表达水平(0.42±0.08)较氧糖剥夺+未敲减cZNF292组下降(P < 0.05),提示敲减cZNF292可抑制缺氧/复氧条件下神经元的凋亡。氧糖剥夺+未敲减cZNF292组原代神经元中CCNG1的表达水平(0.39±0.07)较正常培养组(1.08±0.24)下降(P < 0.05),而氧糖剥夺+敲减cZNF292组CCNG1表达水平(0.26±0.05)较氧糖剥夺+未敲减cZNF292组下降(P < 0.05),提示敲减cZNF292可使神经元细胞在缺氧/复氧条件下细胞周期G1/S期转换受阻。见图 7。
|
图 7 蛋白质印迹法检测OGD和敲减cZNF292对原代神经元caspase 3和CCNG1表达的影响 Fig 7 Effect of OGD and knockdown of cZNF292 on expression of caspase 3 and CCNG1 in primary neurons detected by Western blotting OGD: Oxygen and glucose deprivation; cZNF292: Circular RNA-ZNF292; CCNG1: Cyclin G1; sh: Short hairpin RNA; NC: Normal control. |
3 讨论
最初研究认为cZNF292是促癌因子,Yang等[5]发现其在肿瘤缺氧微环境中被缺氧诱导因子激活,敲减cZNF292可以增加性别决定区Y框9的核转录,减少Wnt/β-联蛋白(β-catenin)通路表达,从而抑制胶质瘤细胞增殖。目前关于cZNF292参与中枢神经系统缺氧缺血损伤的报道较少。Cao等[6]通过海马神经干细胞氧糖剥夺模型验证了cZNF292通过上调miRNA-22激活Wnt/β-catenin和蛋白激酶C(protein kinase C,PKC)/ERK通路发挥对海马神经干细胞的损伤作用,该研究中并没有探讨cZNF292是否参与了神经元氧化应激及凋亡。
目前常用氧糖剥夺模型主要有2种,一种是Na2S2O4建立氧糖剥夺模型,Na2S2O4是最常用的氧耗剂,易吸收溶液中的氧而被氧化,迅速清除融入培养基中的氧,诱导细胞缺氧,而不损伤细胞膜,缺氧后移除含有Na2S2O4的培养基加入新鲜培养基即可复氧。另一种是通过三气培养箱控制氧或氮气的输入量,该装置可通过传感器精确控制氧含量,但价格昂贵、操作复杂、气体平衡时间较长,国内未普及[7]。采用Na2S2O4建立氧糖剥夺模型目前应用广泛,Wang等[8]利用小胶质细胞建立氧糖剥夺模型发现,环状RNA PTK2(circular RNA PTK2,circPTK2)通过结合miRNA-29b上调细胞因子信号传送阻抑物1(suppressor of cytokine signaling 1,SOCS-1)表达、抑制JAK激酶2(Januskinase 2,JAK2)/信号转导及转录激活因子3(signal transducer and activator of transcription 3,STAT3)通路、下调IL-1β表达,从而减少小胶质细胞激活导致的神经元坏死。Lin等[9]利用海马神经元细胞HT22建立氧糖剥夺细胞模型,高通量测序得到3个上调的circRNA,并用PCR验证了环状RNA 015947,然后通过生物信息学分析找到了其下游的5种可能miRNA。Chen等[10]通过氧糖剥夺模型验证环状RNA SHOC2通过与miRNA-7670-3p结合影响下游分子分拣蛋白1(sortilin 1,SORT1),SORT1可以在缺氧环境下调控基因转录和细胞代谢,从而影响神经元功能。因而本实验选择了Na2S2O4建立氧糖剥夺细胞模型。
通过分析文献,Na2S2O4的剂量多采用1~10 mmol/L,本研究在预实验中分别采用1、2、3、4、5、6、7、8、9、10 mmol/L Na2S2O4建立了氧糖剥夺细胞模型,最终选择了4和10 mmol/L进一步实验以明确剂量,最终确定10 mmol/L为最佳剂量。同时,本实验也根据文献报道常用的时间点对氧糖剥夺时间和复氧时间进行筛选,最终确定缺氧4 h和复氧15 h作为氧糖剥夺模型的最佳时间点。此外,本实验未采用传统的在体动物实验或PC12细胞,而是通过原代培养胎鼠神经元进行研究,胎鼠原代神经元刚刚离开生物体,能最大限度地保留生物性状从而反映体内状态[11]。
氧化应激是脑缺血/灌注损伤发生的重要诱因。缺氧后复氧可使神经元中ROS堆积,引起细胞膜脂质过氧化,导致细胞内LDH流出到细胞外。脑缺血后细胞通透性升高,脑组织LDH活性下降,Ca2+内流造成胞内钙超负荷,从而激活一系列酶促反应,最终导致细胞不断发生过氧化损伤。因此,检测细胞内ROS和LDH含量可反映细胞活性功能。缺氧后复氧也可造成细胞中MDA堆积,而MDA是氧自由基堆积破坏生物膜发生脂质过氧化反应生成的终末产物,可通过交联蛋白质和磷脂的氨基改变膜通透性,从而使细胞变形,其含量高低可反映细胞损伤程度[12]。细胞内抗氧化酶活性降低可导致ROS堆积,而SOD是细胞内广泛存在的抗氧化酶,其可通过歧化作用清除氧自由基,阻断细胞色素c依赖的线粒体凋亡途径,还可以通过诱导谷胱甘肽过氧化物酶表达保护神经细胞耐受缺氧/复氧损伤[13]。本研究结果显示,氧糖剥夺使细胞培养基中ROS和MDA水平上升、SOD和LDH水平下降,而敲减cZNF292后细胞培养基中ROS和MDA水平下降、SOD和LDH水平上升。这一结果提示敲减cZNF292可以改善缺氧/复氧造成的原代神经元损伤。本实验进一步对比了敲减和未敲减cZNF292细胞中caspase 3及CCNG1的表达水平,发现敲减cZNF292可以抑制缺氧/复氧环境下神经元凋亡并阻滞细胞G1/S期转换,结合光镜下敲除cZNF292后神经元会在缺氧条件下恢复增殖的结果,可以得出敲减cZNF292可以保护神经元免受缺血缺氧损伤。
综上所述,本研究结果表明,脑缺血可以诱导原代神经元cZNF292表达增加,而敲减cZNF292可以缓解原代神经元在缺血缺氧环境下发生的氧化损伤、抑制细胞凋亡。cZNF292如何通过下游机制影响缺血性脑损伤的氧化和凋亡是之后要思考的问题。我们已经通过生物信息学分析(miRanda网站http://miranda.org.uk/,CLIP DATA: strict stringency > =5)筛选出miRNA-181A-5p可能参与调控cZNF292在脑缺血中的作用,还通过生物信息学分析(PITA:https://genie.weizmann.ac.il/pubs/mir07/和Targetscan:http://targetscan.org/vert_72/)筛选出脑缺血时神经元中存在差异表达mRNA SORT1。因此在之后的实验将通过建立胎鼠线栓缺血模型,检测胎鼠神经元中cZNF292、miRNA-181A-5p和SORT1表达,从而在动物层面展开研究。另外还将检测脑缺血患者血浆中cZNF292及相关分子的表达,以进一步验证cZNF292-miRNA-181A-5p-SORT1轴在缺血性脑损伤中的作用机制。
| [1] |
YANG G, WANG Y, ZENG Y, GAO G F, LIANG X, ZHOU M, et al. Rapid health transition in China, 1990—2010: findings from the Global Burden of Disease Study 2010[J]. Lancet, 2013, 381: 1987-2015. DOI:10.1016/S0140-6736(13)61097-1 |
| [2] |
BENJAMIN E J, MUNTNER P, ALONSO A, BITTENCOURT M S, CALLAWAY C W, CARSON A P, et al; American Heart Association Council on Epidemiology and Prevention Statistics Committee and Stroke Statistics Subcommittee. Heart disease and stroke statistics-2019 update: a report from the American Heart Association[J/OL]. Circulation, 2019, 139: e56-e528. DOI: 10.1161/CIR.0000000000000659.
|
| [3] |
DUAN X, LI L, GAN J, PENG C, WANG X, CHEN W, et al. Identification and functional analysis of circular RNAs induced in rats by middle cerebral artery occlusion[J]. Gene, 2019, 701: 139-145. |
| [4] |
YANG W, LIU Y, GAO R, XIU Z, SUN T. Knockdown of cZNF292 suppressed hypoxic human hepatoma SMMC7721 cell proliferation, vasculogenic mimicry, and radioresistance[J]. Cell Signal, 2019, 60: 122-135. DOI:10.1016/j.cellsig.2019.04.011 |
| [5] |
YANG P, QIU Z J, JIANG Y, DONG L, YANG W S, GU C, et al. Silencing of cZNF292 circular RNA suppresses human glioma tube formation via the Wnt/β-catenin signaling pathway[J]. Oncotarget, 2016, 7: 63449-63455. DOI:10.18632/oncotarget.11523 |
| [6] |
CAO Y, LIU H, ZHANG J, DONG Y. Circular RNA cZNF292 silence alleviates OGD/R-induced injury through up-regulation of miR-22 in rat neural stem cells (NSCs)[J]. Artif Cells Nanomed Biotechnol, 2020, 48: 594-601. DOI:10.1080/21691401.2020.1725536 |
| [7] |
ZAGREAN A M, GRIGORAS I F, IESANU M I, IONESCU R B, CHITIMUS D M, HARET R M, et al. Neuronal transmembrane chloride transport has a time-dependent influence on survival of hippocampal cultures to oxygen-glucose deprivation[J/OL]. Brain Sci, 2019, 9: 360. DOI: 10.3390/brainsci9120360.
|
| [8] |
WANG H, LI Z, GAO J, LIAO Q. Circular RNA circPTK2 regulates oxygen-glucose deprivation-activated microglia-induced hippocampal neuronal apoptosis via miR-29b-SOCS-1-JAK2/STAT3-IL-1β signaling[J]. Int J Biol Macromol, 2019, 129: 488-496. DOI:10.1016/j.ijbiomac.2019.02.041 |
| [9] |
LIN S P, YE S, LONG Y, FAN Y, MAO H F, CHEN M T, et al. Circular RNA expression alterations are involved in OGD/R-induced neuron injury[J]. Biochem Biophys Res Commun, 2016, 471: 52-56. DOI:10.1016/j.bbrc.2016.01.183 |
| [10] |
CHEN W, WANG H, ZHU Z, FENG J, CHEN L. Exosome-shuttled circSHOC2 from IPASs regulates neuronal autophagy and ameliorates ischemic brain injury via the miR-7670-3p/SIRT1 axis[J]. Mol Ther Nucleic Acids, 2020, 22: 657-672. DOI:10.1016/j.omtn.2020.09.027 |
| [11] |
WU F, HAN B, WU S, YANG L, LENG S, LI M, et al. Circular RNA TLK1 aggravates neuronal injury and neurological deficits after ischemic stroke via miR-335-3p/TIPARP[J]. J Neurosci, 2019, 39: 7369-7393. DOI:10.1523/JNEUROSCI.0299-19.2019 |
| [12] |
TONG F, ZHANG H. Pulmonary exposure to particulate matter (PM2.5) affects the sensitivity to myocardial ischemia/reperfusion injury through farnesoid-X-receptor-induced autophagy[J]. Cell Physiol Biochem, 2018, 46: 1493-1507. DOI:10.1159/000489192 |
| [13] |
GOC Z, SZAROMA W, KAPUSTA E, DZIUBEK K. Protective effects of melatonin on the activity of SOD, CAT, GSH-Px and GSH content in organs of mice after administration of SNP[J]. Chin J Physiol, 2017, 60: 1-10. DOI:10.4077/CJP.2017.BAF435 |
 2021, Vol. 42
2021, Vol. 42


