2. 上海交通大学医学院附属第九人民医院药剂科,上海 200011
2. Department of Pharmacy, Shanghai Ninth People's Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200011, China
根据WHO国际癌症研究机构(International Agency for Research on Cancer, IARC)2020年最新数据,乳腺癌已成为全球发病率最高的癌症。据统计,约有70%的乳腺癌患者对化疗耐药或很快出现化疗耐药[1]。无论是初始的耐药还是获得性的耐药都会降低乳腺癌患者的无病生存时间和总生存时间。乳腺癌作为一种实体瘤,肿瘤中心因混乱的血管结构导致一些区域无法通过血液循环供给氧气,而且肿瘤细胞旺盛的代谢进一步加剧了缺氧的程度[2-3]。肿瘤组织的缺氧会加速刺激缺氧诱导因子1α(hypoxia-inducible factor 1α,HIF-1α),并使血管内皮生长因子(vascular endothelial growth factor,VEGF)表达上调,刺激新生血管形成,促进肿瘤侵袭和转移,同样也通过多种机制对肿瘤治疗产生抵抗作用[4-5]。因此,缓解肿瘤部位缺氧状况以提高治疗效果为乳腺癌治疗提供了一种新思路。
研究表明,二氧化锰纳米结构通过与肿瘤微环境(tumor microenvironment,TME)内的H+或谷胱甘肽(glutathione,GSH)反应并分解产生Mn2+,能增强T1磁共振成像信号从而实现肿瘤特异性成像和检测[6-7]。同时,二氧化锰纳米结构能够催化TME内的H2O2分解为水和氧气,从而缓解肿瘤缺氧[8-9],并在体内代谢为无害的、水溶性的Mn2+经肾脏迅速排出体外。中空介孔二氧化锰(hollow mesoporous manganese dioxide,H-MnO2)的中空介孔结构使其具有很大的比表面积,载药率较高。纳米载药系统可以通过被动或主动靶向递送药物至肿瘤部位,发挥抗肿瘤效应,减少药物的不良反应。
纳米药物在实际运用中仍然面临着诸多挑战,例如纳米药物多数是通过静脉给药,血浆中多种蛋白成分迅速吸附至纳米药物表面,加速巨噬细胞的识别与吞噬,使得大部分的药物还未到达肿瘤部位就被网状内皮系统清除。针对上述难点,可对纳米递送载体进行修饰,制备具有主动趋向性、低免疫原性、可穿过生理屏障等特点的仿生膜伪装纳米粒。该粒子同时具有细胞膜的天然生物特性和合成纳米粒子可改装的物理特性,可用于递送治疗药物在肿瘤部位富集,提高治疗效果[10-13]。
本研究以H-MnO2为载体递送多柔比星(doxorubicin,Dox),以pH敏感脂质体和巨噬细胞膜融合膜(pH-sensitive fusion membrane,MP)包覆在H-MnO2上,构建了仿生纳米体系MP@H-MnO2-Dox纳米粒(图 1)。该纳米粒能够靶向肿瘤部位并在肿瘤酸性微环境下裂解暴露H-MnO2,分解TME中的H2O2产生氧以缓解缺氧,同时Dox被肿瘤细胞吞噬发挥抗肿瘤作用。
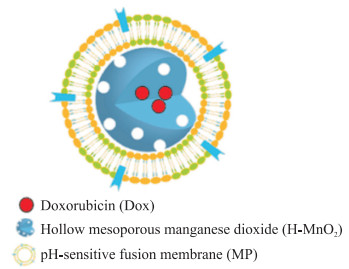
|
图 1 MP@H-MnO2-Dox纳米粒示意图 Fig 1 Sketch of MP@H-MnO2-Dox nanoparticle |
1 材料和方法 1.1 细胞、仪器和试剂
巨噬细胞RAW264.7和小鼠乳腺癌细胞4T1由中国科学院生命科学研究院细胞库提供。水浴锅(河南予华仪器有限公司);高速冷冻离心机(美国Eppendorf AG公司);旋转蒸发仪(常州英峪予华仪器有限公司);ZS90粒度电位分析仪(英国Malvern公司);JEM-2010型透射电镜(日本JEOL公司);激光扫描共聚焦显微镜(德国Leica公司);紫外-可见分光光度计(上海奥谱勒仪器有限公司);自动吸附仪器(美国Quantachrome公司);X射线光电子能谱(X-ray photoelectron spectroscopy,XPS)分析仪(美国ThermoFisher Scientific公司)。正硅酸乙酯、氨水、无水乙醇、无水碳酸钠(上海阿拉丁生化科技股份有限公司);高锰酸钾(国药集团化学试剂有限公司);胆固醇、二硬脂酰基磷脂酰乙醇胺-聚(2-乙基-2-唑啉)[1, 2-distearoyl-sn-glycero-3-phosphoethanolamine-poly(2-ethyl-2-oxazoline),DSPE-PEOZ]、卵磷脂(西安瑞禧生物科技有限公司);FBS、DMEM培养基、RPMI 1640培养基(美国Gibco公司);苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)、细胞膜蛋白与细胞质蛋白抽提试剂盒(上海碧云天生物技术有限公司);BCA蛋白定量试剂盒(上海翊圣生物科技有限公司);三(4, 7-联苯-1, 10-邻菲啰啉)二氯化钌[tris(4, 7-diphenyl-1, 10-phenanthroline)ruthenium(Ⅱ) dichloride,RDPP]购于上海阿拉丁生化科技股份有限公司;其他试剂均为分析纯。
1.2 细胞培养巨噬细胞RAW264.7用含有10% FBS的DMEM培养基在5% CO2、37 ℃条件下培养,每2 d传代1次,约80%细胞融合时进行实验。小鼠乳腺癌细胞4T1用含有10% FBS的RPMI 1640培养基在5% CO2、37℃条件下培养,每天传代1次,约80%细胞融合时进行实验。
1.3 H-MnO2的合成与鉴定采用碱刻蚀法[14]制备H-MnO2。量取14 mL无水乙醇、2 mL去离子水和500 μL浓NH3•H2O(28%)置于50 mL的锥形瓶中,待溶液混匀后,缓慢滴加100 μL正硅酸乙酯和4 mL无水乙醇的混合溶液,置于45 ℃水浴锅里反应至溶液呈现微弱的蓝色乳光,收集、离心、洗涤得固体实心二氧化硅(solid silica,sSiO2)备用。取上述制备的sSiO2 40 mg分散在10 mL水中,在超声条件下将10 mL高锰酸钾(300 mg)水溶液用微量注射泵逐滴滴加到sSiO2溶液中,滴加完毕后置于磁力搅拌器上搅拌整夜,溶液经冷冻高速离心机离心,获得沉淀SiO2@MnO2。将SiO2@MnO2溶解在2 mol/L碳酸钠水溶液中,在60 ℃下刻蚀12 h,离心获得沉淀,用水洗涤3次,即得H-MnO2。使用XPS分析仪判断其组成及结构,用氮气吸脱附实验验证其介孔大小及比表面积,用粒径分析仪测定其粒径及电位。
1.4 H-MnO2对Dox的装载实验精密称取10 mg Dox,置于100 mL容量瓶中,加去离子水溶解并定容,混匀,即得质量浓度为100 μg/mL的Dox标准储备液。用上述储备液配制质量浓度分别为1、2、5、10、20、30、40、50 μg/mL的Dox溶液。以PBS为空白对照,用紫外-可见分光光度计测定480 nm波长处的光密度(D)值。以D对Dox质量浓度(C)进行线性回归,绘制标准曲线。
H-MnO2与Dox分别以1∶1、1∶2、1∶3、1∶4、1∶5、1∶6、1∶7的质量比混合,避光搅拌孵育整夜,溶液经高速离心收集上清和沉淀,沉淀用等量去离子水洗涤3次,离心收集上清未负载的Dox,所得上清液合并用紫外-可见分光光度计测定D480,根据标准曲线计算游离Dox的质量浓度,并按公式计算载药率和包封率:载药率(%)=(Dox投入总质量-游离Dox质量)/载药纳米粒的质量×100%,包封率(%)=(Dox投入总质量-游离Dox质量)/体系中药物的总质量×100%。
1.5 MP的制备离心收集巨噬细胞,加入一定量含PMSF的膜蛋白抽提试剂A,冰浴反应10~15 min。将上述溶液置于液氮里反复冻融3次破碎细胞,然后于4 ℃ 700×g离心10 min,收集上清以去除细胞核和未破碎的细胞。上清于4 ℃ 14 000×g离心30 min,收集沉淀即得细胞膜,用BCA法测定蛋白含量。
将卵磷脂、胆固醇、DSPE-PEOz以摩尔比2∶1∶0.4分散在二氯甲烷与甲醇体积比为2∶1的混合液中,置于50 mL圆底烧瓶中旋转蒸发1 h,取下圆底烧瓶加入等质量的巨噬细胞膜溶液进行水化、超声形成MP的透明悬浮液。
1.6 MP的包覆及表征将MP与H-MnO2分别按质量比1∶5、1∶4、1∶3、1∶2、1∶1、2∶1、3∶1、4∶1、5∶1进行超声融合,离心纯化除去未成功负载的细胞膜,用BCA法测定MP@H-MnO2-Dox上膜蛋白的含量,根据膜蛋白含量和投入比的相关性筛选包覆效率最高的膜-核质量比。使用上述方法分别制备H-MnO2-Dox、MP@H-MnO2-Dox纳米粒进行实验,并考察粒径、电位,在透射电镜下观察纳米粒。
1.7 仿生纳米体系的考察 1.7.1 体外药物释放采用透析法考察H-MnO2-Dox纳米粒、MP@H-MnO2-Dox纳米粒的体外释放情况,选截留分子量为8 000~12 000的透析袋,透析介质为pH=6.5和pH=7.4的PBS溶液。将2 mLH-MnO2-Dox纳米粒、MP@H-MnO2-Dox纳米粒溶液移入透析袋中,放置于含有50 mL释放介质中,于100 r/min、37 ℃进行透析。分别于0.5、1、2、4、6、8、10、12、24 h取1 mL外液,同时补足释放介质。利用紫外分光光度法测定其浓度,并绘制体外释放曲线。
1.7.2 产氧能力将50 µL 0.01 mol/L RDPP乙醇溶液加入1 mL的待测样品中,含H-MnO2浓度为20 µg/mL,用pH=6.5的PBS重悬。将上述混合物转移到试管中,加入250 μL H2O2(0.1 mmol/L)后,每2 min记录1次RDPP的荧光强度(λex=455 nm/λem=615 nm)。
1.7.3 胞内摄取评价采用激光扫描共聚焦显微镜考察仿生纳米粒的胞内摄取。将圆形玻璃片在75%乙醇中浸泡30 min后取出,在酒精灯上烤干后放入24孔板中,将4T1细胞以1×105个细胞每孔的密度接种到24孔板,在5% CO2、37 ℃培养箱中培养,24 h后更换含有Dox、H-MnO2-Dox、MP@H-MnO2-Dox(pH=6.5)、MP@H-MnO2-Dox(pH=7.4)的新鲜培养基,共孵育4 h。吸去旧的培养基,用PBS洗涤1次,再用预冷的多聚甲醛固定30 min,PBS洗涤3次。吸取8 μL含有DAPI的封片液滴于载玻片上,将圆形盖玻片取出,使含有细胞的一面贴于含有DAPI液的载玻片上。在激光扫描共聚焦显微镜下观察并记录Dox在4T1细胞内的荧光分布情况。
1.8 统计学处理用SPSS 22.0软件进行统计学分析。正态分布数据以x±s表示。
2 结果 2.1 H-MnO2纳米粒的结构鉴定XPS分析结果如图 2A,在纳米粒中约653、641 eV处发现了2个明显峰,分别归属于二氧化锰Mn2p1/2和Mn2p3/2,表明二氧化锰颗粒具有+4的氧化态。氮气吸脱附实验结果如图 2B所示,氮气等温吸脱附曲线为Ⅳ型,且滞后环为H1型,表明材料为介孔型且介孔均匀。经氮气吸脱附实验测试法计算比表面积为335.475 m2/g,孔容对孔径分布见图 2C,平均孔径为4.5 nm。结果表明H-MnO2成功合成,且孔径大小适合装载小分子药物。
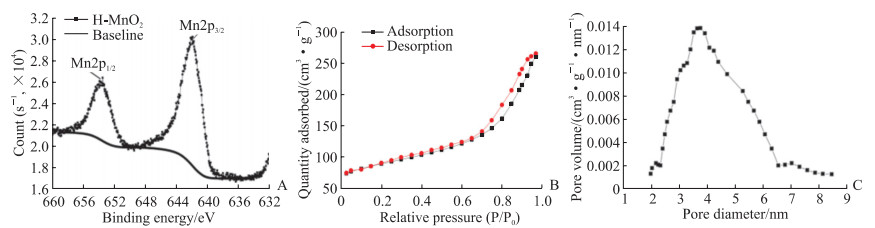
|
图 2 H-MnO2纳米粒的结构鉴定结果 Fig 2 Characterization results of H-MnO2 nanoparticles A: X-ray photoelectron spectroscopy analysis; B: Nitrogen adsorption/desorption isotherms test; C: Pore-size distribution curve. H-MnO2: Hollow mesoporous manganese dioxide. |
2.2 Dox的载药率与包封率
Dox测定的标准曲线为:D=0.021 1C+0.011 9(R2=0.999 1,n=3),线性范围为1~50 μg/mL。H-MnO2在480 nm处没有紫外吸收,不影响Dox的测定。如图 3所示,随着Dox占比的增加,载药率逐渐升高、包封率降低;当Dox与H-MnO2的质量比为5∶1时,H-MnO2纳米粒载药率和包封率达到相对稳定的较高值,分别为(79.0±8.7)%和(75.1±7.5)%,选用此比例进行后续实验。

|
图 3 H-MnO2纳米粒对Dox的载药率及包封率 Fig 3 Drug-loading capacity and encapsulation efficiency of Dox in H-MnO2 nanoparticles n=3, x±s. H-MnO2: Hollow mesoporous manganese dioxide; Dox: Doxorubicin. |
2.3 MP的包覆及表征
测定MP包覆H-MnO2-Dox的仿生纳米粒表面膜蛋白的含量,结果如图 4A,在MP与H-MnO2的质量比为1∶1以下时,仿生纳米粒的表面膜蛋白含量与质量比具有一定的相关性;大于1∶1时,仿生纳米粒的表面膜蛋白含量开始趋近饱和。结果表明质量比为1∶1时MP足以将H-MnO2包裹,后续以此比例进行实验。

|
图 4 MP的包覆及表征结果 Fig 4 Coating and characterization results of MP A: Optimizing the ratio mass of MP to H-MnO2 nanoparticles by bicinchoninic acid assay (n=3, x±s); B: Particle size of MP@H-MnO2-Dox nanoparticles and H-MnO2-Dox nanoparticles; C: Transmisssion electron microscopic image of H-MnO2-Dox nanoparticles and MP@H-MnO2-Dox nanoparticles. MP: pH-sensitive fusion membrane; H-MnO2: Hollow mesoporous manganese dioxide; Dox: Doxorubicin. |
激光粒径分析仪测定结果如图 4B,H-MnO2-Dox的粒径为(169.0±6.5)nm,聚合物分散性指数(polymer dispersity index,PDI)为0.141±0.024,MP@H-MnO2-Dox的粒径为(178.0±9.5)nm,PDI为0.206±0.008;H-MnO2-Dox电位为(-34.0±4.2)mV,MP@H-MnO2-Dox电位为(-40.0±5.5)mV,与MP的电位(-39.0±3.4)mV相近,可初步表明MP的成功包覆。透射电镜结果如图 4C,H-MnO2-Dox为规则介孔样球形,粒径约为182 nm,这与水合粒径相符;电镜图可以明显看到MP@H-MnO2-Dox外有一层膜包衣,呈现“核壳”结构,进一步证明了MP的成功包覆。
2.4 仿生纳米体系体外药物释放考察体外药物释放结果如图 5,24 h时MP@H-MnO2-Dox(pH=7.4)、MP@H-MnO2-Dox(pH=6.5)、H-MnO2-Dox(pH=7.4)、H-MnO2-Dox(pH=6.5)的Dox累计释放量分别为(15.0±4.5)%、(42.0±5.1)%、(38.0±2.1)%、(60.0±3.7)%。结果表明MP发挥了pH响应的作用,二氧化锰在酸性条件下分解为Mn2+,促进了药物的释放;同一pH条件下MP可以延缓Dox的释放,表明MP包覆具有一定的缓释作用。
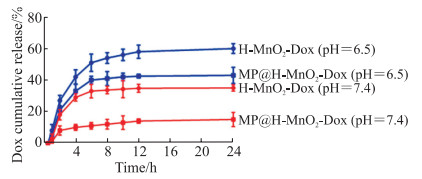
|
图 5 MP@H-MnO2-Dox和H-MnO2-Dox纳米粒在不同pH条件下的释放曲线 Fig 5 Release curve of MP@H-MnO2-Dox nanoparticles and H-MnO2-Dox nanoparticles at different pH values n=3, x±s. MP: pH-sensitive fusion membrane; H-MnO2: Hollow mesoporous manganese dioxide; Dox: Doxorubicin. |
2.5 仿生纳米粒的产氧能力考察
结果如图 6,向MP@H-MnO2-Dox纳米粒悬浮液(溶剂为pH=6.5的磷酸盐缓冲液)中加入H2O2后,RDPP的荧光强度在6 min内淬灭,并在随后的4 min内维持在较低水平,表明溶液中氧浓度升高;而MP-Dox+H2O2组和MP@H-MnO2-Dox组荧光强度没有降低,进一步证实氧的产生是由二氧化锰氧化H2O2引起的。H-MnO2-Dox+H2O2组RDPP的荧光强度也在6 min内淬灭,且随后保持在较低水平,说明二氧化锰具有高效的产氧能力,且随时间的增加2种纳米粒在10 min时达到相近的产氧效果。
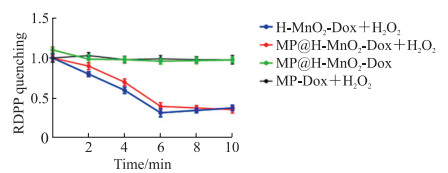
|
图 6 不同纳米粒的产氧能力考察结果 Fig 6 Oxygen production capacity of different nanoparticles n=3, x±s. H-MnO2: Hollow mesoporous manganese dioxide; Dox: Doxorubicin; MP: pH-sensitive fusion membrane; RDPP: Tris(4, 7-diphenyl-1, 10-phenanthroline)ruthenium(Ⅱ) dichloride. |
2.6 仿生纳米粒的胞内摄取评价
激光共聚焦显微镜下Dox在4T1细胞内荧光分布如图 7,其中红色荧光代表Dox,蓝色荧光代表DAPI。游离Dox组有较弱的荧光,H-MnO2-Dox组则显示出稍强的荧光,MP@H-MnO2-Dox(pH=6.5)组则具有最强的荧光,表明MP的包覆能够有效促进纳米粒递送药物进入胞内。
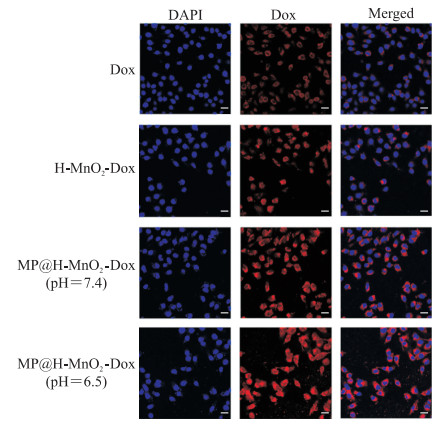
|
图 7 激光扫描共聚焦显微镜观察4T1细胞内Dox的摄取分布情况 Fig 7 Cellular uptake and distribution of Dox in 4T1 cells by confocal laser scanning microscopy Scale bar=25 μm. Dox: Doxorubicin; H-MnO2: Hollow esoporous manganese dioxide; MP: pH-sensitive fusion membrane; DAPI: 4', 6-diamidino-2-phenylindole. |
3 讨论
肿瘤缺氧微环境不仅诱导肿瘤血管的生成和转移,还导致许多癌症的治疗效果不佳[15]。诸多研究提出了向肿瘤区域输送氧气的方法,其中纳米递送系统备受青睐,但大多都以二氧化锰颗粒或H2O2酶作为一种治疗剂设计在纳米递送系统中,增添了纳米系统的复杂性[16-17]。本研究提出以H-MnO2本身作为纳米递送的载体,同时它又可以发挥产生氧气的作用。人工制备的纳米载体在生物相容性和安全性等方面很难与一些天然物质相比,研究者们创造性地将纳米递送系统与细胞或细胞膜结合[18-19],构成细胞-纳米药物递送系统。该递送系统保留了一些关键的膜蛋白和细胞的原始功能,这有助于逃避宿主免疫反应、延长循环时间,并具有将治疗剂输送到特定部位的靶向性。
本研究构建的MP包覆载Dox的H-MnO2仿生纳米递送体系具有均一、稳定的粒径,仿生膜的包覆可有效增加纳米粒在血液中的稳定性并且防止药物泄露,还同时靶向肿瘤部位并在肿瘤酸性微环境中释放药物,发挥精准的药物治疗作用。H-MnO2的载药率与包封率分别达(79.0±8.7)%、(75.1±7.5)%,这与H-MnO2具有较大的比表面积及均一、较小的孔径有关,而较高的载药率和包封率可以保证在较低剂量的载体递送下达到治疗效果。MP本质上属磷脂双分子层,实验表明其能够有效将H-MnO2包覆,为Dox递送提供了非常安全且高效的平台。MP在肿瘤部位响应酸性微环境,裂解释放载药H-MnO2,因此本研究在pH=6.5和pH=7.4下考察药物释放,体外释放结果表明MP具有酸性条件敏感行为,为抗肿瘤药物在TME中释放提供了条件。在酸性的H2O2条件下,MnO2被还原成Mn2+和氧,即2H2O2+4H++MnO2=4H2O+O2+Mn2+。可以用氧气探针RDPP探究MP@H-MnO2-Dox对酸性H2O2的响应,有氧时RDPP的荧光会被淬灭。考察H-MnO2的体外产氧能力结果表明,二氧化锰在模拟TME的H2O2浓度条件下具有高效的产氧能力,对缓解肿瘤部位缺氧具有很大意义。胞内摄取结果证明MP@H-MnO2-Dox纳米粒有优异的递送能力,也证实了该仿生纳米体系递送药物的可行性。
综上所述,本实验成功构建了MP@H-MnO2-Dox纳米粒并进行了载药比例、膜包覆条件及相关体外特性的考察,该仿生纳米体系具有成为安全、高效的体内靶向给药递送系统的潜力。后期我们将开展体外细胞学评价及体内的靶向性、药效学评价,并进一步探索其抗肿瘤作用的机制。
| [1] |
NUNNERY S E, MAYER I A. Targeting the PI3K/AKT/mTOR pathway in hormone-positive breast cancer[J]. Drugs, 2020, 80: 1685-1697. DOI:10.1007/s40265-020-01394-w |
| [2] |
VAUPEL P, THEWS O, HOECKEL M. Treatment resistance of solid tumors: role of hypoxia and Anemia[J]. Med Oncol, 2001, 18: 243-259. DOI:10.1385/MO:18:4:243 |
| [3] |
HÖCKEL M, VAUPEL P. Tumor hypoxia: definitions and current clinical, biologic, and molecular aspects[J]. J Natl Cancer Inst, 2001, 93: 266-276. DOI:10.1093/jnci/93.4.266 |
| [4] |
RANKIN E B, GIACCIA A J. Hypoxic control of metastasis[J]. Science, 2016, 352: 175-180. DOI:10.1126/science.aaf4405 |
| [5] |
MCEVOY L M, O'TOOLE S A, SPILLANE C D, MARTIN C M, GALLAGHER M F, STORDAL B, et al. Identifying novel hypoxia-associated markers of chemoresistance in ovarian cancer[J/OL]. BMC Cancer, 2015, 15: 547. DOI: 10.1186/s12885-015-1539-8.
|
| [6] |
HUANG J, HUANG Y, XUE Z, ZENG S. Tumor microenvironment responsive hollow mesoporous Co9S8@MnO2-ICG/DOX intelligent nanoplatform for synergistically enhanced tumor multimodal therapy[J/OL]. Biomaterials, 2020, 262: 120346. DOI: 10.1016/j.biomaterials.2020.120346.
|
| [7] |
ZHU J, XIAO T, ZHANG J, CHE H, SHI Y, SHI X, et al. Surface-charge-switchable nanoclusters for magnetic resonance imaging-guided and glutathione depletion-enhanced photodynamic therapy[J]. ACS Nano, 2020, 14: 11225-11237. DOI:10.1021/acsnano.0c03080 |
| [8] |
LIN T, ZHAO X, ZHAO S, YU H, CAO W, CHEN W, et al. O2-generating MnO2 nanoparticles for enhanced photodynamic therapy of bladder cancer by ameliorating hypoxia[J]. Theranostics, 2018, 8: 990-1004. DOI:10.7150/thno.22465 |
| [9] |
CHANG C C, DINH T K, LEE Y A, WANG F N, SUNG Y C, YU P L, et al. Nanoparticle delivery of MnO2 and antiangiogenic therapy to overcome hypoxia-driven tumor escape and suppress hepatocellular carcinoma[J]. ACS Appl Mater Interfaces, 2020, 12: 44407-44419. DOI:10.1021/acsami.0c08473 |
| [10] |
PANG L, ZHANG C, QIN J, HAN L, LI R, HONG C, et al. A novel strategy to achieve effective drug delivery: exploit cells as carrier combined with nanoparticles[J]. Drug Deliv, 2017, 24: 83-91. DOI:10.1080/10717544.2016.1230903 |
| [11] |
KRATZ F, WARNECKE A. Finding the optimal balance: challenges of improving conventional cancer chemotherapy using suitable combinations with nano-sized drug delivery systems[J]. J Control Release, 2012, 164: 221-235. DOI:10.1016/j.jconrel.2012.05.045 |
| [12] |
CHAUHAN V P, STYLIANOPOULOS T, BOUCHER Y, JAIN R K. Delivery of molecular and nanoscale medicine to tumors: transport barriers and strategies[J]. Annu Rev Chem Biomol Eng, 2011, 2: 281-298. DOI:10.1146/annurev-chembioeng-061010-114300 |
| [13] |
ZHANG Y H, CAO J, YUAN Z. Strategies and challenges to improve the performance of tumor-associated active targeting[J]. J Mater Chem B, 2020, 8: 3959-3971. DOI:10.1039/D0TB00289E |
| [14] |
YANG G, XU L, CHAO Y, XU J, SUN X, WU Y, et al. Hollow MnO2 as a tumor-microenvironment-responsive biodegradable nano-platform for combination therapy favoring antitumor immune responses[J/OL]. Nat Commun, 2017, 8: 902. DOI: 10.1038/s41467-017-01050-0.
|
| [15] |
YOUSEFI H, VATANMAKANIAN M, MAHDIANNASSER M, MASHOURI L, ALAHARI N V, MONJEZI M R, et al. Understanding the role of integrins in breast cancer invasion, metastasis, angiogenesis, and drug resistance[J]. Oncogene, 2021, 40: 1043-1063. |
| [16] |
ZHU X F, LIU Y N, YUAN G L, GUO X, CEN J Q, GONG Y C, et al. In situ fabrication of MS@MnO2 hybrid as nanozymes for enhancing ROS-mediated breast cancer therapy[J]. Nanoscale, 2020, 12: 22317-22329. DOI:10.1039/D0NR03931D |
| [17] |
CHENG X, HE L, XU J, FANG Q, YANG L, XUE Y, et al. Oxygen-producing catalase-based prodrug nanoparticles overcoming resistance in hypoxia-mediated chemo-photodynamic therapy[J]. Acta Biomater, 2020, 112: 234-249. DOI:10.1016/j.actbio.2020.05.035 |
| [18] |
FANG R H, KROLL A V, GAO W, ZHANG L. Cell membrane coating nanotechnology[J/OL]. Adv Mater, 2018, 30: e1706759. DOI: 10.1002/adma.201706759.
|
| [19] |
YOO J W, IRVINE D J, DISCHER D E, MITRAGOTRI S. Bio-inspired, bioengineered and biomimetic drug delivery carriers[J]. Nat Rev Drug Discov, 2011, 10: 521-535. |
 2021, Vol. 42
2021, Vol. 42


