2. 海军军医大学(第二军医大学)转化医学研究中心, 上海 200433;
3. 江西省肿瘤医院病理科, 南昌 330006;
4. 九江市第一人民医院影像中心, 九江 332000
2. Center of Translational Medicine, Naval Medical University (Second Military Medical University), Shanghai 200433, China;
3. Department of Pathology, Jiangxi Cancer Hospital, Nanchang 330006, Jiangxi, China;
4. Center of Imaging, Jiu Jiang No. 1 People's Hospital, Jiujiang 332000, Jiangxi, China
孤立性纤维性肿瘤/血管周细胞瘤(solitary fibrous tumor/hemangiopericytoma,SFT/HPC)是一种起源于脑膜未分化间叶细胞或毛细血管外皮细胞的软组织肿瘤,仅占中枢神经系统原发性肿瘤的0.4%[1]。颅内SFT/HPC的临床症状及影像学表现不典型,易与颅内其他原发性肿瘤特别是脑膜瘤及间叶来源肿瘤相混淆,但其生物学行为更具有侵袭性,具有高复发及远处转移的特点,预后较差[2]。本研究收集7例原发性颅内SFT/HPC病例资料,分析其临床病理特征、诊断、鉴别诊断及预后,以期提高对该病的认识。
1 资料和方法 1.1 标本和资料收集九江市第一人民医院和江西省肿瘤医院2015年6月至2020年12月确诊的颅内SFT/HPC手术切除标本7例,并收集相关患者的临床、影像学及病理资料。
1.2 试剂与方法所有标本均采用中性甲醛溶液充分固定,常规取材、脱水、石蜡包埋、4 μm厚切片,H-E染色后在光镜下进行形态学观察。免疫组织化学染色采用EnVision法,所用波形蛋白(vimentin)抗体、广谱细胞角蛋白(pancytokeratin,CKpan)抗体、上皮膜抗原(epithelial membrane antigen,EMA)抗体、CD34抗体、CD31抗体、表皮生长因子受体(epidermal growth factor receptor,EGFR)抗体、P53抗体、信号转导与转录激活因子6(signal transducer and activator of transcription 6,STAT6)抗体、Bcl-2抗体、S100抗体、胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体、孕激素受体(progesterone receptor,PR)抗体、CD99抗体、平滑肌肌动蛋白(smooth muscle actin,SMA)抗体、因子Ⅷ抗体、Ki-67抗体和EnVision试剂盒(即用型)均购自福州迈新生物技术开发有限公司。免疫组织化学染色由1名经验丰富的主管技师按试剂盒说明书进行操作,所有获得的玻片均经2位组织病理学副主任医师复诊阅片。
1.3 随访对7例颅内SFT/HPC患者进行电话随访,随访内容包括患者肿瘤有无复发、转移和因肿瘤导致的死亡。随访以术后时间为起始,以患者死亡时间为终止,随访截止日期为2020年12月28日。患者出现颅内相关症状并得到影像学确诊即认为肿瘤复发。
2 结果 2.1 临床特征7例颅内SFT/HPC患者中男5例、女2例;年龄为23~60岁,平均46.1岁;临床症状主要表现为头晕、头痛、呕吐等神经受压和颅内压增高症状,同时可伴有患侧肢体无力和癫痫。MRI检查示颅内结节状占位性病变,边界尚清,伴动脉期强化(图 1)。肿瘤发病部位有额叶、颞叶、枕叶、颅底及海绵窦。7例患者均行开颅肿瘤完整切除术。2例术后给予伽马刀放射治疗,5例给予分次外放射治疗,其中1例患者同时辅以化学治疗。见表 1。

|
图 1 增强磁共振成像检查示颅内强化性结节状占位 |
|
|
表 1 7例颅内孤立性纤维性肿瘤/血管周细胞瘤患者的临床资料 |
2.2 病理学特征
大体观:送检物均为破碎的瘤体组织,大小为3.5 cm×3 cm×2 cm~7 cm×6 cm×4.5 cm,部分瘤体表面呈结节状,似有包膜;切面灰白、灰红实性,质地中等或稍韧,与脑组织分界尚清,灶性区域可见出血及囊腔形成。显微镜下观察结果:5例WHO Ⅱ级SFT/HPC肿瘤细胞呈卵圆形、短梭形,大小一致,形态温和,呈弥漫、杂乱分布,胞质少、核圆形,染色质淡染,核仁不可见,间质纤维组织增生伴胶原化(图 2A);肿瘤组织间见大量增生的小血管呈裂隙状排列,其间可见部分血管呈“鹿角样”血管外皮瘤结构(图 2B)。2例WHO Ⅲ级SFT/HPC肿瘤细胞明显丰富,围绕幼稚血管生长,肿瘤细胞呈圆形、多边形、可见瘤巨细胞,部分胞质空泡状,核有异型,核质比增高,染色质粗,可见核仁及散在的核分裂(≥4个/10个高倍镜视野)(图 2C)。
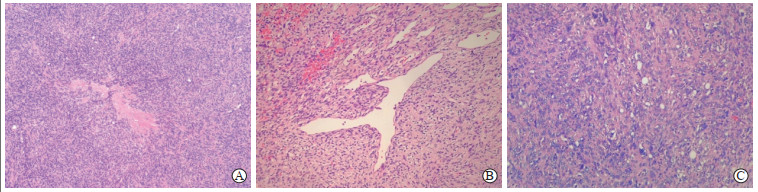
|
图 2 颅内孤立性纤维性肿瘤/血管周细胞瘤镜下形态学变化 A:短梭形肿瘤细胞呈弥漫分布,伴间质胶原化(100×);B:血管呈“鹿角样”血管外皮瘤结构(200×);C:多角形瘤细胞密集分布,可见核分裂(200×). |
2.3 免疫表型
7例患者肿瘤细胞均弥漫表达波形蛋白、CD34(图 3A)和STAT6(图 3B),不同程度表达Bcl-2(3/7)、P53(3/7)、CD99(2/5);血管部分表达CD31(3/7)、因子Ⅷ(3/5)、SMA(2/4);Ki-67增殖指数为5%~20%,平均9.7%;余检测抗体均呈阴性。

|
图 3 颅内孤立性纤维性肿瘤/血管周细胞瘤免疫组织化学染色(200×) A:肿瘤细胞胞质CD34阳性;B:肿瘤细胞胞核信号转导与转录激活因子6阳性. |
2.4 随访结果
除1例患者转院后失访外,其余6例随访5~67个月,平均随访32个月,患者均存活。1例患者于术后33个月复发,行二次手术后未见复发和转移。见表 1。
3 讨论颅内SFT和HPC分别由Carneiro等[3]及Begg和Garret[4]于1996及1954年首次报道。2016年WHO中枢神经系统肿瘤分类根据两者具有相同的免疫表型和基因突变位点特征,正式将其定义为具有成纤维细胞型的间叶组织肿瘤SFT/HPC[5]。朱培培等[6]报道20例SFT/HPC患者中男女比例为3∶2,无明显性别差异。本组7例颅内SFT/HPC患者男女发病比例达5∶2,与此差别较大。本组病例发病年龄为23~60岁,平均46.1岁,与Melone等[7]报道的发病年龄相似。发病部位以大脑凸面、矢状窦、颅中窝、大脑镰和小脑幕等与硬脑膜相连的位置多见,极少见于脑实质。临床表现与肿瘤的发生部位有关,主要是颅内压增高和神经受压所引起的头晕、头痛、呕吐、肢体无力和癫痫等症状。MRI检查示颅内SFT/HPC呈类圆形、结节状或多囊性占位伴强化期明显,血管流空信号、窄基底附着和不形成脑膜尾征等特点在鉴别诊断中具有一定的意义[8]。
大体上颅内SFT/HPC多表现为单发实性占位性病变,瘤体直径通常 > 4 cm,本组肿瘤最大径为3.5~7 cm,平均约5 cm,肿瘤通常无明显包膜或有假包膜,但与脑组织界限尚清,切面可呈灰白、灰褐色,通常质地稍韧,可见出血,当肿瘤分级较高时切面呈鱼肉样或豆渣状,可见坏死。显微镜下肿瘤由圆形、卵圆形或短梭形细胞构成,大小较一致,呈疏松或密集分布,胞质少,核染色质较粗,核仁通常不可见,间质可有纤维组织增生伴胶原化。瘤组织间见丰富的厚薄不一的血管伴具有特征性的“鹿角样”血管外皮瘤结构。当肿瘤分级高时,肿瘤细胞存在明显的多形性和异型性,可见核分裂及凝固性坏死。2016版WHO中枢神经系统肿瘤分类依据组织病理学特点和临床预后特点将颅内SFT/HPC分为3级:Ⅰ级,肿瘤细胞呈明显梭形,密度低而间质胶原纤维显著;Ⅱ级,肿瘤细胞呈卵圆形,密度较高且间质胶原纤维少,可见“鹿角样”血管;Ⅲ级,肿瘤细胞呈多角形,细胞密度高伴异型,核分裂通常≥4个/10个高倍镜视野,可见坏死[5]。绝大部分颅内SFT/HPC为WHO Ⅱ或Ⅲ级,本组病例WHO Ⅱ级5例、Ⅲ级2例。
SFT/HPC还需要与颅内其他梭形细胞肿瘤鉴别。(1)脑膜瘤:病史相对较长,临床进展缓慢,显微镜下细胞形态温和,不见“鹿角样”血管,可见核假包涵体和砂砾体,免疫组织化学标志物EMA、PR表达阳性,STAT6阴性。(2)间叶软骨肉瘤:可发生于脑膜且常常形成血管外皮瘤样结构,但间叶细胞较幼稚且可见灶性分化良好的透明软骨,免疫组织化学标志物S-100表达阳性。(3)神经鞘瘤:多见于桥小脑角,具有疏松及致密区双相结构,血管壁透明样变性和间质黏液样,免疫组织化学标志物EMA、S-100表达阳性。(4)单向型滑膜肉瘤:具有双向分化特征,组织形态多样,肿瘤细胞密集分布且异型明显,免疫组织化学标志物细胞角蛋白和EMA表达阳性,CD34表达阴性。(5)其他转移性梭形细胞肿瘤:如间质瘤或平滑肌肉瘤,往往存在原发部位和既往史,相应的免疫组织化学标志物可以与之鉴别。
SFT/HPC免疫组织化学染色结果显示,肿瘤细胞通常片状表达波形蛋白、CD34、STAT6,灶性表达Bcl-2、P53、CD99,其中STAT6、Bcl-2和CD99被认为特异性较高,联合标记有助于提高SFT/HPC的确诊率。曹钟等[9]发现配对框基因8(paired box gene 8,Pax8)蛋白在SFT/HPC中的核阳性率达57.7%,在诊断中同样具有较高的灵敏性。文献报道Ki-67增殖指数与颅内SFT/HPC的WHO分级和预后有关[10],本组7例Ki-67增殖指数为5%~20%,2例Ⅲ级病例Ki-67增殖指数均 > 10%,其中1例出现复发。近年分子遗传学分析发现SFT/HPC的发生与STAT6基因有密切联系,当12q13染色体发生倒位突变后,导致STAT6基因过度激活并与NGFI-A结合蛋白2(NGFI-A binding protein 2,NAB2)转录基因形成NAB2-STAT6融合基因,该融合基因的高表达与肿瘤复发、转移明显相关[11]。另外也有学者报道在颅内SFT/HPC中存在周期蛋白依赖激酶抑制因子2A(cyclin-dependent kinase inhibitor 2A,CDKN2A)基因缺失、Rb通路失活和β-actin-GLI家族锌指蛋白1(GLI family zinc finger 1,GLI1)基因融合,这些分子遗传学改变均可能促使SFT/HPC的发生[12-13]。
在治疗方面,颅内SFT/HPC首选肿瘤完整切除术,术后辅以足够剂量放射治疗被认为能有效抑制肿瘤生长和减少复发。有研究报道化学治疗能够延长患者的存活时间,但有待进一步论证[14]。相对软组织来源的SFT/HPC,发生于中枢神经系统的SFT/HPC预后较差且与WHO分级相关。WHO Ⅰ级为生物学良性肿瘤,手术切除后预后良好;Ⅱ级和Ⅲ级具有侵袭性生物学行为,术后远期复发率较高,平均复发时间为7年,术后15年复发率高达90%[15]。远处转移多见于肝、肺和骨,发生转移后平均生存期仅为2年。本组7例病例中5例为WHO Ⅱ级、2例为Ⅲ级,均行手术切除并辅以伽马刀或分次外放射治疗,除1例失访外,其余6例平均随访32个月,仅1例WHO Ⅲ级病例出现肿瘤复发,二次手术后预后尚可,这可能与本组病例较少且随访时间较短有关。总之,颅内SFT/HPC具有侵袭性生物学行为和易复发、转移的特点,早期发现、诊断和寻求手术切除并放射治疗是治疗该病的关键,建立长久的随访策略和及时的临床干预能有效提高生存率。
| [1] |
ALÉN J F, LOBATO R D, GÓMEZ P A, BOTO G R, LAGARES A, RAMOS A, et al. Intracranial hemangiopericytoma: study of 12 cases[J]. Acta Neurochir (Wien), 2001, 143: 575-586. DOI:10.1007/s007010170062 |
| [2] |
YIP C M, HSU S S, LIAO W C, LIU S H, LIN Y S, HSU Y H, et al. Intracranial solitary fibrous tumor/hemangiopericytoma-a case series[J/OL]. Surg Neurol Int, 2020, 11: 414. DOI: 10.25259/SNI_490_2020.
|
| [3] |
CARNEIRO S S, SCHEITHAUER B W, NASCIMENTO A G, HIROSE T, DAVIS D H. Solitary fibrous tumor of the meninges: a lesion distinct from fibrous meningioma. A clinicopathologic and immunohistochemical study[J]. Am J Clin Pathol, 1996, 106: 217-224. DOI:10.1093/ajcp/106.2.217 |
| [4] |
BEGG C F, GARRET R. Hemangiopericytoma occurring in the meninges: case report[J]. Cancer, 1954, 7: 602-606. DOI:10.1002/1097-0142(195405)7:3<602::AID-CNCR2820070319>3.0.CO;2-A |
| [5] |
LOUIS D N, PERRY A, REIFENBERGER G, VON DEIMLING A, FIGARELLA-BRANGER D, CAVENEE W K, et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary[J]. Acta Neuropathol, 2016, 131: 803-820. DOI:10.1007/s00401-016-1545-1 |
| [6] |
朱培培, 邹珏, 陈军, 徐蓉蓉, 颜红柱. 颅内孤立性纤维性肿瘤/血管周细胞瘤20例临床病理特征分析[J]. 诊断学理论与实践, 2017, 16: 622-626. |
| [7] |
MELONE A G, D'ELIA A, SANTORO F, SALVATI M, DELFINI R, CANTORE G, et al. Intracranial hemangiopericytoma: our experience in 30 years: a series of 43 cases and review of the literature[J]. World Neurosurg, 2014, 81: 556-562. DOI:10.1016/j.wneu.2013.11.009 |
| [8] |
YANG B T, SONG Z L, WANG Y Z, DONG J Y, WANG Z C. Solitary fibrous tumor of the sinonasal cavity: CT and MR imaging findings[J]. AJNR Am J Neuroradiol, 2013, 34: 1248-1251. DOI:10.3174/ajnr.A3485 |
| [9] |
曹钟, 魏建国, 岑红兵, 袁晓露, 夏丹萍, 敖启林. 孤立性纤维性肿瘤/脑膜血管周细胞瘤中STAT6、PAX8和CD34的表达及意义[J]. 临床与实验病理学杂志, 2017, 33: 669-671. |
| [10] |
YAMAMOTO Y, HAYASHI Y, MURAKAMI I. Recurrence of solitary fibrous tumor/hemangiopericytoma could be predicted by Ki-67 regardless of its origin[J]. Acta Med Okayama, 2020, 74: 335-343. |
| [11] |
AHMAD Z, TARIQ M U, DIN N U. Meningeal solitary fibrous tumor/hemangiopericytoma: emphasizing on STAT6 immunohistochemistry with a review of literature[J]. Neurol India, 2018, 66: 1419-1426. DOI:10.4103/0028-3886.241365 |
| [12] |
KERR D A, PINTO A, SUBHAWONG T K, WILKY B A, SCHLUMBRECHT M P, ANTONESCU C R, et al. Pericytoma with t(7;12) and ACTB-GLI1 fusion: reevaluation of an unusual entity and its relationship to the spectrum of GLI1 fusion-related neoplasms[J]. Am J Surg Pathol, 2019, 43: 1682-1692. DOI:10.1097/PAS.0000000000001360 |
| [13] |
SAHM F, REUSS D E, GIANNINI C. WHO 2016 classification: changes and advancements in the diagnosis of miscellaneous primary CNS tumours[J]. Neuropathol Appl Neurobiol, 2018, 44: 163-171. DOI:10.1111/nan.12397 |
| [14] |
LOTTIN M, ESCANDE A, PEYRE M, SEVESTRE H, MAURAGE C A, CHAUFFERT B, et al. What's new in the management of meningeal solitary fibrous tumor/hemangiopericytoma?[J]. Bull Cancer, 2020, 107: 1260-1273. DOI:10.1016/j.bulcan.2020.09.011 |
| [15] |
GONZÁLEZ-VARGAS P M, THENIER-VILLA J L, SANROMÁN ÁLVAREZ P, SERANTES COMBO A, CALERO FÉLIX L, GALÁRRAGA CAMPOVERDE R A, et al. Hemangiopericytoma/solitary fibrous tumor in the central nervous system. Experience with surgery and radiotherapy as a complementary treatment: a 10-year analysis of a heterogeneous series in a single tertiary center[J]. Neurocirugia (Astur: Engl Ed), 2020, 31: 14-23. |
 2021, Vol. 42
2021, Vol. 42


