糖尿病肾病(diabetic kidney disease,DKD)是糖尿病的主要微血管并发症,也是终末期肾病患者进行血液透析或肾移植的首要因素和糖尿病患者死亡的重要原因[1-2]。DKD发病机制复杂,但其病理改变与肾小球基底膜增厚、系膜基质扩张、细胞外基质(extracellular matrix,ECM)积聚导致的肾小球硬化密切相关[3]。增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)是细胞周期中S期细胞数量的重要标志,反映了细胞的增殖活性,在DKD扩张的系膜基质中高表达[4]。ECM蛋白包括胶原蛋白Ⅳ(collagen Ⅳ)、胶原蛋白Ⅰ(collagenⅠ)和纤连蛋白(fibronectin)等,其中胶原蛋白Ⅰ主要在分布在肾小管间质中,但肾脏纤维化早期即可在肾小球积聚,因而是评价肾小球纤维化的灵敏指标[5]。进行性降低的肾小球滤过率、持续的蛋白尿和动脉压升高是DKD的三大特点,但在DKD进入大量蛋白尿期之前往往没有明显的临床表现,这无疑加大了DKD临床诊疗的难度。因此,深入研究DKD发病机制、找到有效治疗靶点对延缓DKD进程有着现实且重要的意义。
miRNA是内源性的非编码短链RNA,可以通过阻断蛋白质翻译、诱导mRNA降解来充当基因表达的转录后调控因子,在人体生理功能调控中发挥重要作用。miRNA-455-3p通过减少ECM蛋白的积累起抗心肌纤维化作用[6],亦有研究表明其参与高糖条件下肾小球系膜细胞的炎症反应[7],但是在DKD中的功能尚不清楚。DKD发病机制复杂,目前临床干预主要针对肾脏血流动力学异常活跃的肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)。血管紧张素Ⅱ受体抑制剂(angiotensin Ⅱ receptor inhibitor,ARB)厄贝沙坦能保护糖尿病大鼠肾脏足细胞,降低蛋白尿,可一定程度延缓肾小球硬化[8]。本研究通过建立稳定的DKD动物模型研究miRNA-455-3p对胶原蛋白Ⅰ及PCNA表达的影响,同时探讨厄贝沙坦干预对miRNA-455-3p表达及肾小球硬化的作用。
1 材料和方法 1.1 仪器、试剂与动物荧光定量PCR仪(美国Applied Biosystems公司),低温高速离心机(长沙湘仪离心机仪器有限公司),成像系统(美国Bio-Rad公司),电泳仪(北京六一仪器有限公司)。厄贝沙坦[150 mg/片,赛诺菲(杭州)制药有限公司,产品编号:A14202003031],链脲佐菌素(streptozotocin,STZ;美国Sigma公司)。SPF级雄性SD大鼠36只,体重180~200 g,购自上海斯莱克实验动物有限责任公司[动物生产许可证号:SCXK(沪)2017-0005;动物合格证号:2015000542372],饲养条件为明暗12 h交替、自由饮水、温度23~25 ℃。
1.2 动物分组、造模及干预miRNA-455-3p激动剂干预实验:18只大鼠适应性饲养1周后,随机取其中6只作为对照组;其余12只造模成功后随机分为DKD模型组(STZ组)和过表达miRNA-455-3p组(STZ+miRNA-455-3p组),每组6只。STZ组和STZ+miRNA-455-3p组大鼠用高糖高脂饲料喂养,6周后予30 mg/kg STZ(溶于0.1 mmol/L柠檬酸缓冲液,pH 4.4)腹腔注射;对照组以普通饲料喂养,6周后注射相同给药容量的柠檬酸缓冲液。72 h后剪尾端取血测末梢血空腹血糖(取血前大鼠禁食12 h),以血糖≥16.7 mmol/L判定为高血糖,未达标的大鼠再予30 mg/kg STZ注射1次,此后每3 d检测血糖1次,血糖稳定≥16.7 mmol/L且出现持续蛋白尿为DKD造模成功。STZ+miRNA-455-3p组分别在STZ注射后第2周和第5周时以20 mg/kg的剂量腹腔注射miRNA-455-3p激动剂(广州锐博生物技术有限公司)。
厄贝沙坦干预实验:18只雄性SD大鼠适应性喂养1周后随机分为对照组、模型组(STZ组)、厄贝沙坦干预组(STZ+厄贝沙坦组),DKD造模方法同前,其中STZ+厄贝沙坦组以50 mg/kg厄贝沙坦悬浊液灌胃12周,模型组和对照组灌胃给予等体积生理盐水。
1.3 样本采集末次灌胃结束后,收集各组大鼠24 h尿液,用考马斯亮蓝法检测24 h尿蛋白水平。大鼠禁食12 h,以10%水合氯醛1.0 mL腹腔注射麻醉,腹主动脉采血,室温静置1 h,845×g离心10 min,分离血清,置于-80 ℃冰箱保存。
1.4 光镜下观察肾组织形态摘取各组大鼠肾脏,用多聚甲醛溶液固定后依次脱水、包埋、切片,然后进行过碘酸希夫染色。每张切片至少观察40个肾小球,根据肾小球硬化灶所占肾小球的比例进行肾小球硬化指数评分:0为无肾小球病变,1为1%~25%的肾小球受损,2为26%~50%的肾小球受损,3为51%~75%的肾小球受损,4为76%~100%的肾小球受损。每张切片随机选择10个视野进行系膜扩张指数评分:0为正常肾小球,1为1%~25%的肾小球出现基质扩张,2为26%~50%的肾小球出现基质扩张,3为51%~75%的肾小球出现基质扩张,4为76%~100%的肾小球出现基质扩张。
1.5 血清及肾组织中miRNA-455-3p水平测定取100 μL血清或40 mg肾组织加入TRIzol裂解液[生工生物工程(上海)股份有限公司],以氯仿-异丙醇体系提取样品总RNA,并溶解于无RNA酶水中,参照miScript反转录试剂盒[宝生物工程(大连)有限公司]说明书进行反转录,并参照miScript SYBR Green PCR试剂盒[宝生物工程(大连)有限公司]说明书进行qRT-PCR。miRNA-455-3p的上游引物为5'-GACGTCCACGGGCAT-3',下游引物为5'-GTGCAGGGTCCGAGGT-3';内参照U6的上游引物为5'-TTATGGGTCCTAGCCTGAC-3',下游引物为5'-CACTATTGCGGGTCTGC-3'(上海维术生物科技有限公司)。以2-ΔΔCt法计算样品中miRNA-455-3p的相对表达量。
1.6 肾组织中PCNA和胶原蛋白Ⅰ表达水平的检测采用蛋白质印迹法检测肾组织中目的蛋白的表达水平。提取肾组织总蛋白,使用BCA蛋白质浓度测定试剂盒(北京碧云天生物技术研究所)检测蛋白质浓度后进行SDS-PAGE,电转移至NC膜,用5%脱脂牛奶封闭。加入鼠抗PCNA单克隆抗体、兔抗胶原蛋白Ⅰ多克隆抗体、鼠抗β-actin单克隆抗体(武汉三鹰生物技术有限公司)4 ℃孵育过夜,使用TBST溶液将膜上未被结合的抗体洗去。加入相应HRP标记的山羊抗兔IgG(武汉三鹰生物技术有限公司)后,室温条件下孵育2 h,洗膜。使用ECL发光剂在暗室中发光、曝光显影并记录结果。以β-actin作为内参照对目的蛋白的表达进行半定量分析。
1.7 统计学处理采用SPSS 21软件进行数据处理。计量资料符合正态分布且方差齐,以x±s表示,多组间比较采用单因素方差分析,两两比较采用最小显著性差异法。检验水准(α)为0.05。
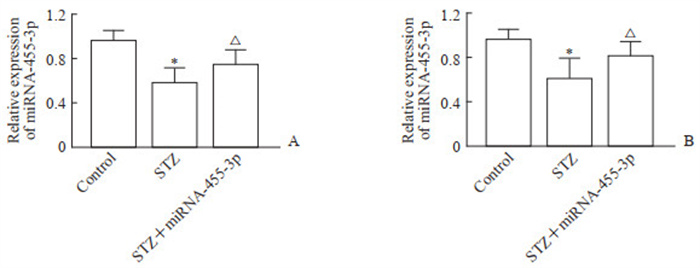
2 结果 2.1 miRNA-455-3p激动剂干预后DKD大鼠血清及肾组织中miRNA-455-3p的表达qRT-PCR检测结果显示,STZ组大鼠血清及肾组织中miRNA-455-3p表达均较对照组降低,差异均有统计学意义(P均<0.05)。注射miRNA-455-3p激动剂后,STZ+miRNA-455-3p组血清及肾组织中miRNA-455-3p表达与STZ组比较均升高,差异均有统计学意义(P均<0.05)。见图 1。
|
图 1 miRNA-455-3p激动剂干预后DKD大鼠血清(A)和肾组织(B)中miRNA-455-3p的表达变化 Fig 1 Expression of miRNA-455-3p in sera (A) and kidney tissues (B) of DKD rats after miRNA-455-3p agonist intervention *P < 0.05 vs control group; △P < 0.05 vs STZ group. n= 6, x±s. miRNA: MicroRNA; DKD: Diabetic kidney disease; STZ: Streptozotocin. |
2.2 miRNA-455-3p激动剂干预后DKD大鼠24 h尿量及24 h尿蛋白水平变化
对照组、STZ组、STZ+miRNA-455-3p组大鼠的24 h尿量分别为(18.22±2.59)、(117.65±52.34)、(71.18±13.84)mL,24 h尿蛋白水平分别为(8.75±2.02)、(134.97±77.91)、(67.12±23.25)mg。统计分析表明,STZ组、STZ+miRNA-455-3p组大鼠的24 h尿量及24 h尿蛋白水平均较正常对照组升高,STZ+miRNA-455-3p组大鼠24 h尿量、24 h尿蛋白水平均较STZ组降低,差异均有统计学意义(P均<0.05)。
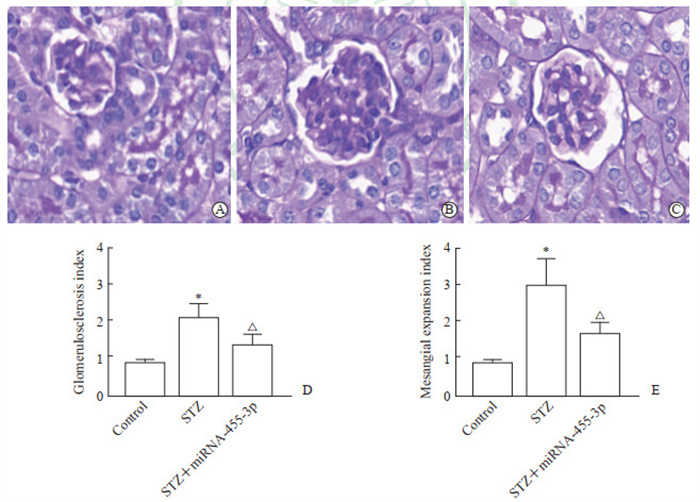
2.3 miRNA-455-3p激动剂干预后DKD大鼠肾组织病理学变化过碘酸希夫染色结果显示,与对照组(图 2A)相比,STZ模型组(图 2B)大鼠肾小球肿胀、肥大,系膜细胞明显增生,肾小球系膜基质弥漫性增多,毛细血管基底膜明显增厚。过表达miRNA-455-3p可改善DKD大鼠这些肾脏病理改变(图 2C)。统计学分析结果表明,STZ组肾小球硬化指数和系膜扩张指数均较对照组增大,而STZ+miRNA-455-3p组大鼠的这2个参数与STZ组比较均减小(P均<0.05,图 2D、2E)。
|
图 2 miRNA-455-3p激动剂干预后DKD大鼠肾皮质形态、肾小球硬化指数和系膜扩张指数的变化 Fig 2 Renal cortex morphology, glomerulosclerosis index and mesangial expansion index of DKD rats after miRNA-455-3p agonist intervention A: Periodic acid-Schiff staining of renal cortex in the control group (400×); B: Periodic acid-Schiff staining of renal cortex in the STZ group (400×); C: Periodic acid-Schiff staining of renal cortex in the STZ+ miRNA-455-3p group (400×); D: Comparison of the glomerulosclerosis index among the 3 groups; E: Comparison of the mesangial expansion index among the 3 groups. *P < 0.05 vs control group; △P < 0.05 vs STZ group. n= 6, x±s. miRNA: MicroRNA; DKD: Diabetic kidney disease; STZ: Streptozotocin. |
2.4 miRNA-455-3p激动剂干预后DKD大鼠肾组织中PCNA和胶原蛋白Ⅰ的表达变化
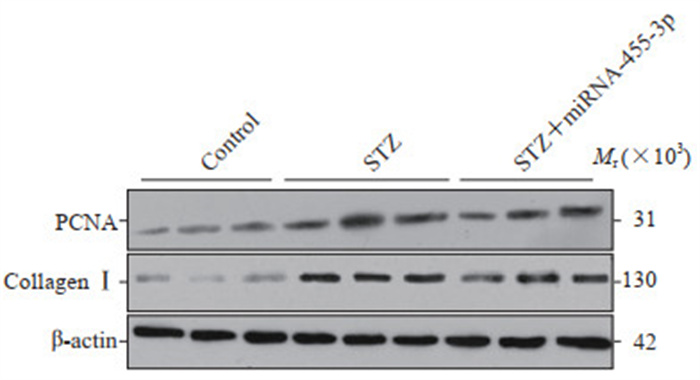
蛋白质印迹法检测结果(图 3)表明,STZ组大鼠肾组织中PCNA和胶原蛋白Ⅰ的表达水平均较对照组升高(0.65±0.03 vs 0.41±0.09、0.58±0.09 vs 0.32±0.09),而STZ+miRNA-455-3p组中PCNA和胶原蛋白Ⅰ的表达水平均较STZ组降低(0.45±0.05 vs 0.65±0.03、0.43±0.07 vs 0.58±0.09),差异均有统计学意义(P均<0.01)。
|
图 3 miRNA-455-3p激动剂干预后DKD大鼠肾组织中PCNA和胶原蛋白Ⅰ的表达变化 Fig 3 Expression levels of PCNA and collagen Ⅰ in kidney tissues of DKD rats after miRNA-455-3p agonist intervention miRNA: MicroRNA; DKD: Diabetic kidney disease; PCNA: Proliferating cell nuclear antigen; STZ: Streptozotocin. |
2.5 厄贝沙坦干预后DKD大鼠血清和肾组织中miRNA-455-3p的表达
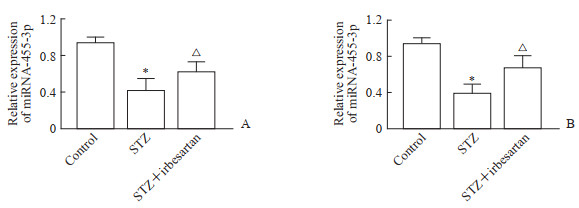
qRT-PCR检测结果(图 4)显示,STZ组大鼠血清及肾组织中miRNA-455-3p表达水平均较对照组降低,STZ+厄贝沙坦组大鼠血清及肾组织中miRNA-455-3p表达水平均较STZ组升高,差异均有统计学意义(P均<0.05)。
|
图 4 厄贝沙坦干预后DKD大鼠血清(A)和肾组织(B)中miRNA-455-3p的表达变化 Fig 4 Expression of miRNA-455-3p in sera (A) and kidney tissues (B) of DKD rats after irbesartan intervention *P < 0.05 vs control group; △P < 0.05 vs STZ group. n=6, x±s. DKD: Diabetic kidney disease; miRNA: MicroRNA; STZ: Streptozotocin. |
2.6 厄贝沙坦干预后DKD大鼠24 h尿量、24 h尿蛋白水平变化
对照组、STZ组、STZ+厄贝沙坦组大鼠的24 h尿量分别为(17.95±2.70)、(152.60±15.20)、(78.53±9.96)mL,24 h尿蛋白水平分别为(7.6±2.07)、(171.42±43.40)、(62.71±12.56)mg。统计学分析表明,STZ组、STZ+厄贝沙坦组大鼠的24 h尿量及24 h尿蛋白水平均较对照组升高,STZ+厄贝沙坦组大鼠24 h尿量、24 h尿蛋白水平均较STZ组降低,差异均有统计学意义(P均<0.05)。
2.7 厄贝沙坦干预后DKD大鼠的肾组织病理学变化过碘酸希夫染色结果显示,与对照组(图 5A)相比,STZ组(图 5B)肾小球肿胀、肥大,系膜细胞明显增生,肾小球系膜基质弥漫性增多,毛细血管基底膜明显增厚。厄贝沙坦干预可改善DKD大鼠肾脏的这些病理改变(图 5C)。统计学分析结果表明,STZ组大鼠肾小球硬化指数和系膜扩张指数均较对照组增大,而STZ+厄贝沙坦组大鼠的这2个参数与STZ组比较均减小(P均<0.05,图 5D、5E)。

|
图 5 厄贝沙坦干预后DKD大鼠肾皮质形态、肾小球硬化指数和系膜扩张指数的变化 Fig 5 Renal cortex morphology, glomerulosclerosis index and mesangial expansion index of DKD rats after irbesartan intervention A: Periodic acid-Schiff staining of renal cortex in the control group (400×); B: Periodic acid-Schiff staining of renal cortex in the STZ group (400×); C: Periodic acid-Schiff staining of renal cortex in the STZ+ irbesartan group (400×); D: Comparison of glomerulosclerosis index among the 3 groups; E: Comparison of mesangial expansion index among the 3 groups. *P < 0.05 vs control group; △ P < 0.05 vs STZ group. n= 6, x±s. DKD: Diabetic kidney disease; STZ: Streptozotocin. |
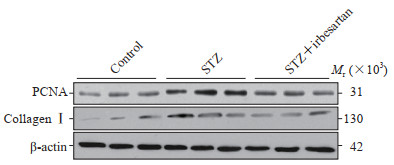
2.8 厄贝沙坦干预后DKD大鼠肾组织中PCNA和胶原蛋白Ⅰ表达变化
蛋白质印迹法检测结果(图 6)表明,STZ组大鼠肾组织中PCNA和胶原蛋白Ⅰ表达较对照组升高(0.59±0.14 vs 0.37±0.07、0.51±0.05 vs 0.28±0.04),而厄贝沙坦干预后抑制了肾组织中PCNA和胶原蛋白Ⅰ表达的升高(0.38±0.08 vs 0.59±0.14、0.36±0.09 vs 0.51±0.05),差异均有统计学意义(P均<0.01)。
|
图 6 厄贝沙坦干预后DKD大鼠肾组织中PCNA和胶原蛋白Ⅰ的表达变化 Fig 6 Expression levels of PCNA and collagenⅠ in kidney tissues of DKD rats after irbesartan intervention DKD: Diabetic kidney disease; PCNA: Proliferating cell nuclear antigen; STZ: Streptozotocin. |
3 讨论
作为糖尿病最常见的慢性微血管并发症之一,DKD具有起病隐匿、进展慢、预后差的特点,其发病人数占糖尿病患者总数的20%~40%,是我国部分地区新发终末期肾衰竭的主要原因[9]。DKD患者在出现临床蛋白尿后大多数都不可避免地发展成为终末期肾病,但是在疾病早期进行干预可以延缓DKD的发展,DKD的早期防治至关重要。从早期肾小球和肾小管基底膜的增厚、系膜基质的扩增,到入球及出球动脉的透明样变、结节性硬化,乃至终末期肾小球硬化, 肾小球硬化在DKD进程中扮演着重要角色[10]。
miRNA是一种长约1~23个核苷酸的短链非编码RNA,通过与靶标基因mRNA的3'非翻译区结合诱导其降解或破坏其稳定性,从而抑制该蛋白的合成,进而在一系列生理进程(细胞增殖、分化、凋亡、糖代谢、胰岛素分泌等)的调控中发挥重要作用,影响生物体的生长、发育,并与人类多种疾病的发生、发展密切相关[11-13]。miRNA-455-3p是miRNA-455的一个亚型,位于染色体脆性区域9q32位点上,具有组织特异性。Zhu等[7]发现高糖可以激活Hottip/miRNA-455-3p/Wnt2B通路,上调Hottip和Wnt2B的表达、下调miRNA-455-3p的表达,使胶原蛋白Ⅰ和Ⅳ等蛋白表达水平增加、ECM积聚,促进db/db DKD小鼠系膜细胞增殖。本研究中,DKD大鼠血清和肾组织中miRNA-455-3p水平降低,而过表达miRNA-455-3p可以降低DKD大鼠24 h尿蛋白水平,减少DKD大鼠肾组织中PCNA和胶原蛋白Ⅰ蛋白表达,减轻肾小球硬化,说明miRNA-455-3p是DKD大鼠肾脏的保护因子。
RAAS在慢性肾脏疾病的病理生理过程中起着非常重要的作用。高糖可以激活RAAS,使得肾组织中血管紧张素Ⅱ含量增加,通过血管紧张素受体结合致使肾小球内压升高、滤过屏障损害,经过一系列血流动力学及非血流动力学效应最终促进肾小球硬化,而ARB类药物可以阻断RAAS,使肾脏病变减轻[14]。多项研究表明,ARB类药物对miRNA谱的表达具有调控作用,如Wang等[15]研究发现缬沙坦可以通过调控miRNA-21改善DKD小鼠心肌纤维化程度,刘红等[16]发现厄贝沙坦对健康人血浆miRNA谱的表达具有调控作用。在本研究中,DKD大鼠经厄贝沙坦干预后24 h尿量、24 h尿蛋白水平均降低,表明厄贝沙坦能一定程度改善大鼠的肾功能损害。miRNA-455-3p在DKD大鼠肾组织和血清中表达下调,但经过厄贝沙坦干预后其表达水平上调,同时肾组织中PCNA和胶原蛋白Ⅰ蛋白表达下降,这些结果说明厄贝沙坦可通过上调miRNA-455-3p减少ECM积聚和肾小球系膜细胞的增殖,减轻DKD大鼠肾小球硬化程度。
综上所述,miRNA-455-3p参与大鼠DKD进程,可能是DKD治疗的新靶点,而厄贝沙坦能够减少DKD大鼠蛋白尿、延缓肾小球硬化进程,其保护肾脏的机制可能与上调miRNA-455-3p的表达有关。
| [1] |
马晓华, 周亚男, 王荣荣, 聂屾, 李石磊, 王博, 等. 持续低效缓慢血液透析治疗终末期糖尿病肾病临床观察[J]. 解放军医药杂志, 2019, 31: 57-59. |
| [2] |
AZUSHIMA K, GURLEY S B, COFFMAN T M. Modelling diabetic nephropathy in mice[J]. Nat Rev Nephrol, 2018, 14: 48-56. DOI:10.1038/nrneph.2017.142 |
| [3] |
JHA J C, BANAL C, OKABE J, GRAY S P, HETTIGE T, CHOW B S M, et al. NADPH oxidase Nox5 accelerates renal injury in diabetic nephropathy[J]. Diabetes, 2017, 66: 2691-2703. DOI:10.2337/db16-1585 |
| [4] |
VAN DIERENDONCK J H, WIJSMAN J H, KEIJZER R, VAN DE VELDE C J, CORNELISSE C J. Cell-cycle-related staining patterns of anti-proliferating cell nuclear antigen monoclonal antibodies. Comparison with BrdUrd labeling and Ki-67 staining[J]. Am J Pathol, 1991, 138(1165): 1172. |
| [5] |
GENOVESE F, MANRESA A A, LEEMING D J, KARSDAL M A, BOOR P. The extracellular matrix in the kidney: a source of novel non-invasive biomarkers of kidney fibrosis?[J/OL]. Fibrogenesis Tissue Repair, 2014, 7: 4. DOI: 10.1186/1755-1536-7-4.
|
| [6] |
HUANG Z W, TIAN L H, YANG B, GUO R N. Long noncoding RNA H19 acts as a competing endogenous RNA to mediate CTGF expression by sponging miR-455 in cardiac fibrosis[J]. DNA Cell Biol, 2017, 36: 759-766. DOI:10.1089/dna.2017.3799 |
| [7] |
ZHU X J, GONG Z, LI S J, JIA H P, LI D L. Long noncoding RNA Hottip modulates high-glucose-induced inflammation and ECM accumulation through miR-455-3p/WNT2B in mouse mesangial cells[J]. Int J Clin Exp Pathol, 2019, 12: 2435-2445. |
| [8] |
杨岳, 谢席胜, 冯胜刚, 左川, 李孜, 樊均明. 厄贝沙坦对糖尿病大鼠肾脏足细胞保护作用的研究[J]. 西部医学, 2012, 24: 214-217. DOI:10.3969/j.issn.1672-3511.2012.02.002 |
| [9] |
GAN L, ZUO L. Current ESRD burden and its future trend in Beijing, China[J]. Clin Nephrol, 2015, 83(7 Suppl 1): 17-20. |
| [10] |
GNUDI L. Angiopoietins and diabetic nephropathy[J]. Diabetologia, 2016, 59: 1616-1620. DOI:10.1007/s00125-016-3995-3 |
| [11] |
MENDELL J T, OLSON E N. MicroRNAs in stress signaling and human disease[J]. Cell, 2012, 148: 1172-1187. DOI:10.1016/j.cell.2012.02.005 |
| [12] |
MASSART J, KATAYAMA M, KROOK A. MicroManaging glucose and lipid metabolism in skeletal muscle: role of microRNAs[J]. Biochim Biophys Acta, 2016, 1861(12 Pt B): 2130-2138. |
| [13] |
ESTEVES J V, ENGUITA F J, MACHADO U F. MicroRNAs-mediated regulation of skeletal muscle GLUT4 expression and translocation in insulin resistance[J/OL]. J Diabetes Res, 2017, 2017: 7267910. DOI: 10.1155/2017/7267910.
|
| [14] |
KINOSHITA Y, KONDO S, URUSHIHARA M, SUGA K, MATSUURA S, TAKAMATSU M, et al. Angiotensin Ⅱ type Ⅰ receptor blockade suppresses glomerular renin-angiotensin system activation, oxidative stress, and progressive glomerular injury in rat anti-glomerular basement membrane glomerulonephritis[J]. Transl Res, 2011, 158: 235-248. DOI:10.1016/j.trsl.2011.05.003 |
| [15] |
WANG J Y, DUAN L J, GAO Y B, ZHOU S H, LIU Y M, WEI S H, et al. Angiotensin Ⅱ receptor blocker valsartan ameliorates cardiac fibrosis partly by inhibiting miR-21 expression in diabetic nephropathy mice[J]. Mol Cell Endocrinol, 2018, 472: 149-158. DOI:10.1016/j.mce.2017.12.005 |
| [16] |
刘红, 韩璐璐, 谢爽, 娄莹, 蒋娟娟, 田蕾, 等. 连续口服厄贝沙坦对健康中国志愿者血浆MicroRNAs表达的影响[J]. 中国循环杂志, 2011, 26(增刊): 248. |
 2021, Vol. 42
2021, Vol. 42


