2. 解放军总医院第一医学中心风湿免疫科, 北京 100853
2. Department of Rheumatology and Immunology, the First Medical Center, PLA General Hospital, Beijing 100853, China
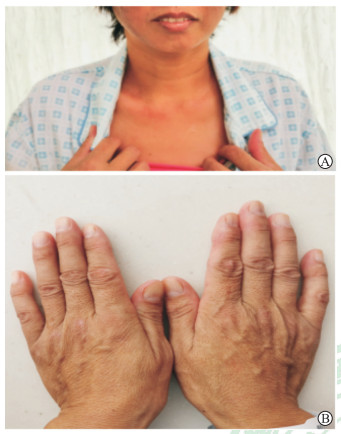
患者女,46岁。因“面颈部红斑3个月余,四肢无力伴疼痛2个月余”于2019年9月15日收入解放军总医院第一医学中心风湿免疫科。发病前2个月,患者在进行硫酸铜溶液喷洒养殖场水面作业时,部分溶液沾染至面部,当天下午自感面部发红、不适。3 d后面部、双眼睑肿胀,伴面额、眶周硬币大小紫红色皮疹,无畏寒、发热、寒战、肌无力、肌痛、吞咽困难、声嘶、饮水呛咳、指端遇冷变色、口腔溃疡等不适。25 d后出现四肢近端肌肉群疼痛伴乏力,行走、上举提物及吞咽食物困难,说话语音较既往低,无复视及饮水呛咳。胸部CT检查示双肺透亮度正常、双侧胸膜下可见条索状影,气管、支气管通畅,叶间裂无增厚及位移,考虑双肺间质性肺炎。既往体健,无药物、食物过敏史,否认饮酒、吸烟史。入院后体格检查:体温36.5 ℃,脉率94 min-1,呼吸频率20 min-1,血压100/75 mmHg(1 mmHg=0.133 kPa),神志清,精神可;全身皮肤及巩膜无黄染,双上眼睑水肿,伴额面部水肿性紫红色斑,未累及颧部、鼻唇沟,前胸见“ V ”字形红斑(图 1A),双手掌指关节伸侧面见绿豆大小扁平紫红色皮疹、上覆薄层鳞屑,双手桡侧面皮肤粗糙、上覆鳞屑(图 1B),双肘伸侧面皮肤粗糙;心、肺、腹未见异常;颈屈肌肌力3-级,抬头困难,双上肢近端肌力4-级,双下肢近端肌力5-级,双上肢、下肢远端肌力正常,双侧肱二头肌、三头肌腱反射及双膝、跟腱反射正常,双侧巴宾斯基征阴性。辅助检查:实验室检查示红细胞计数3.57×109/L,白细胞计数3.55×109/L,中性粒细胞比例0.852,血小板计数103×109/L,CRP 1.0 mg/L,丙氨酸转氨酶19.7 U/L,天冬氨酸转氨酶95.9 U/L,碱性磷酸酶112.2 U/L,肌酸激酶74.3 U/L,乳酸脱氢酶528.2 U/L;血气分析示pH 7.41,氧分压81.2 mmHg,二氧化碳分压43.2 mmHg,氧饱和度97%;免疫相关检查示抗核抗体、抗中性粒细胞胞质抗体谱、抗心磷脂抗体阴性,IgG、IgA、IgE、补体C3和C4正常,IgM 3 890 mg/L, 黑色素瘤分化相关基因5(melanoma differentiation-associated gene 5,MDA5)抗体(┼┼┼);毒物检测示血清铜2.1 μg/mL(正常参考值0.3~1.1 μg/mL);肌电图检查示肌源性受损;肺通气和换气功能测定示限制性通气功能障碍,通气功能障碍分级为轻度,呼气峰流速下降,弥散功能轻度降低;骨髓穿刺活检示造血细胞生成活跃,三系增生,未见明显异常细胞灶。诊断:皮肌炎;双肺间质性肺炎。
|
图 1 患者前胸和双手皮肤表现 A:前胸见“ V ”字形红斑;B:双手掌指关节伸侧面见绿豆大小扁平紫红色皮疹、上覆薄层鳞屑,双手桡侧面皮肤粗糙、上覆鳞屑. |
给予硫酸羟氯喹0.2 g每天2次、他克莫司胶囊1 mg每天1次、甲泼尼龙片36 mg每天1次,同时加用青霉胺片0.25 μg每天4次,共治疗5 d。治疗后7 d复查血气分析示pH 7.4、氧分压85.9 mmHg、二氧化碳分压45.3 mmHg、氧饱和度97%,毒物检测示血清铜0.7 μg/mL。肌力、皮疹渐好转。1个月后随访,患者肌力明显恢复、皮疹明显好转,复查肺部CT示双侧胸膜下可见条片状及条索状影,与前次CT影像比较大致相仿。
2 讨论皮肌炎是一种特发性炎性肌病,典型的临床和实验室表现包括近端肌无力伴肌酶升高、典型的皮肤病变(向阳性皮疹和Grottron丘疹)和特异性血清自身抗体阳性。本例患者无肿瘤、无他汀类药物服用史,有四肢近端肌肉群疼痛、对称乏力,伴额面部红斑、典型Grottron丘疹,肌酶谱升高,抗MDA5抗体阳性,胸部CT提示双肺间质性肺炎,因此皮肌炎诊断明确。皮肌炎的确切病因尚不明确,一般认为与遗传、病毒感染、免疫失衡、肿瘤有关。本例患者在发病前暴露部位沾染少量硫酸铜溶液,沾染后面部出现大面积发红并感不适,在糖皮质激素治疗同时加用青霉胺排铜治疗后皮疹、肌力等均有好转,考虑此次发病与接触化学物品有关。沾染化学物品诱发的皮肌炎案例国内外鲜有报道。宗阳如和王翠凤[1]、张运汉[2]曾分别报道因在苯胺类化学物质超标的水田里劳作和接触有机磷农药1059后经历了与本例患者类似病程、而后经相关检查确诊为皮肌炎的病例;罗蕾等[3]也曾报道1例食用小龙虾诱发的皮肌炎伴肺间质病变患者。
铜离子通过与铜蓝蛋白、白蛋白、氨基酸及维生素结合形成复合物在体内进行运输。硫酸铜的中毒机制在于其抑制了葡萄糖-6-磷酸脱氢酶和谷胱甘肽的巯基基团,降低了后者清除自由基的活性而导致血管内溶血,同时钠钾ATP酶的抑制也会增加细胞的通透性而损伤组织细胞[4],并造成肌肉组织破坏[5]。Liu等[6]发现,铜通过负向调节过氧化氢酶和谷胱甘肽活性刺激活性氧的产生并加剧氧化应激效应,同时通过下调线粒体膜电位和表面Bcl-2/Bax蛋白比值诱导肌细胞线粒体损伤和凋亡。研究显示,多种免疫和非免疫机制共同参与了炎性肌病的病理生理过程,坏死凋亡的肌细胞可被固有免疫系统Toll样受体3识别,产生的细胞因子刺激适应性免疫,参与皮肌炎的发生和发展[7]。本例患者接触硫酸铜后,暴露区皮肤出现红肿、瘙痒,但无金属铜中毒的典型肝脏和血液系统损害表现,推测暴露剂量低于急性全身中毒剂量,但引发了局部皮肤反应。有研究指出,人体的免疫失衡是诱发皮肌炎的一个重要因素,某次意外过度激活的固有免疫、适应性免疫或两者之间的相互作用可能是皮肌炎发病机制的一个重要早期步骤[8]。由于缺乏对相关机制的研究,推测本例患者此次发病可能源自铜与肌细胞反应后形成自身抗原并激活固有和适应性免疫,从而诱发细胞自噬、参与肌炎的发生发展。
MDA5抗体与无肌病型皮肌炎和快速进展性肺间质性病变密切相关,免疫抑制治疗效果不佳、预后较差。MDA5是可以识别双链RNA病毒的一种特定RNA解旋酶,并在固有免疫系统中充当模式识别受体[9],可与病毒特异性结合并产生相应效应,诱导机体进行抗病毒防御。本例患者在接触硫酸铜后出现抗MDA5抗体阳性及相关临床表现,推测铜离子损伤肌细胞后的细胞成分可能与机体某些蛋白结合形成了自身抗原。高达50%~70%的抗MDA5抗体阳性患者可并发快速进展性肺间质性病变[10],并可在短时间内因肺纤维化导致呼吸衰竭而死亡,故及时评估患者肺部病情并给予相应治疗尤为重要。本例患者并无肺部异常不适及异常肺部体征,影像学仅提示小范围的肺部条索状影,给予糖皮质激素及他克莫司治疗后,肌力和皮疹迅速好转,复查血气分析显示呼吸功能未进一步恶化,提示本例患者间质性肺炎并未进一步发展。
综上所述,我们报道了1例皮肤沾染硫酸铜后出现抗MDA5抗体阳性皮肌炎并肺间质病变的患者,在糖皮质激素、免疫抑制剂结合排毒治疗后,患者病情明显缓解。但重金属与炎性肌病发病间的关系及机制尚不明确,需进一步研究。
| [1] |
宗阳如, 王翠凤. 中毒性多发性皮肌炎1例病理观察报告[J]. 皮肤病与性病, 1993, 15: 26-28. |
| [2] |
张云汉. 农药1059中毒伴发皮肌炎一例[J]. 河南医学院学报, 1981, 16: 12-13. |
| [3] |
罗蕾, 黄文瀚, 任飞凤, 夏宁, 王嘉佳, 周俊, 等. 吡非尼酮治疗小龙虾所致皮肌炎相关肺间质病变1例报告[J]. 检验医学与临床, 2019, 16: 138-141. |
| [4] |
FRANCHITTO N, GANDIA-MAILLY P, GEORGES B, GALINIER A, TELMON N, DUCASSÉ J L, et al. Acute copper sulphate poisoning: a case report and literature review[J]. Resuscitation, 2008, 78: 92-96. |
| [5] |
BENDERS A A G M, LI J, LOCK R A C, BINDELS R J M, WENDELAAR BONGA S E, VEERKAMP J H. Copper toxicity in cultured human skeletal muscle cells: the involvement of Na+/K+-ATPase and the Na+/Ca2+- exchanger[J]. Pflügers Arch, 1994, 428: 461-467. DOI:10.1007/BF00374566 |
| [6] |
LIU Y, LIANG J, WANG Q, HE Y, CHEN Y. Copper nanoclusters trigger muscle cell apoptosis and atrophy in vitro and in vivo[J]. J Appl Toxicol, 2016, 36: 454-463. DOI:10.1002/jat.3263 |
| [7] |
LAHOUTI A H, CHRISTOPHER-STINE L. Polymyositis and dermatomyositis: novel insights into the pathogenesis and potential therapeutic targets[J]. Discov Med, 2015, 19: 463-470. |
| [8] |
HORNUNG T, WENZEL J. Innate immune-response mechanisms in dermatomyositis: an update on pathogenesis, diagnosis and treatment[J]. Drugs, 2014, 74: 981-998. |
| [9] |
BARRAL P M, SARKAR D, SU Z Z, BARBER G N, DESALLE R, RACANIELLO V R, et al. Functions of the cytoplasmic RNA sensors RIG-I and MDA-5:key regulators of innate immunity[J]. Pharmacol Ther, 2009, 124: 219-234. |
| [10] |
TEMMOKU J, SATO S, FUJITA Y, ASANO T, SUZUKI E, KANNO T, et al. Clinical significance of myositis-specific autoantibody profiles in Japanese patients with polymyositis/dermatomyositis[J/OL]. Medicine (Baltimore), 2019, 98: e15578. DOI: 10.1097/MD.0000000000015578.
|
 2021, Vol. 42
2021, Vol. 42


